Pha Chế Dung Dịch - Chuyên đề Môn Hóa Học Lớp 8
Có thể bạn quan tâm
Nâng cấp gói Pro để trải nghiệm website VnDoc.com KHÔNG quảng cáo, và tải file cực nhanh không chờ đợi.
Tìm hiểu thêm » Mua ngay Từ 79.000đ Hỗ trợ ZaloChuyên đề Hóa học lớp 8: Pha chế dung dịch được VnDoc sưu tầm và giới thiệu tới các bạn học sinh cùng quý thầy cô tham khảo. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 8 hiệu quả hơn. Mời các bạn tham khảo.
Chuyên đề: Pha chế dung dịch
- A/ Lý thuyết bài: Pha chế dung dịch
- B/ Trắc nghiệm bài: Pha chế dung dịch
A/ Lý thuyết bài: Pha chế dung dịch
1. Cách pha chế theo nồng độ
BT: từ muối NaCl, nước cất và những dụng cụ cần thiết, hãy tính toán và giới thiệu cách pha chế
a. 100g dung dịch NaCl 10%
b. 100ml dung dịch NaCl 1M
| a. Tính toán - Tìm khối lượng chất tan mNaCl = 100.10/100 = 10g - Tìm khối lượng dung môi mdm = mdd – mct = 100 – 10 = 90g | Cách pha chế: - Cân lấy 10g NaCl khan cho vào cốc có dung tích 200 ml. Cân 90g (hoặc đong 90 ml) nước cất rồi đổ dần vào cốc rồi khuấy nhẹ. Được 100g NaCl 10% |
| b. Tính toán - Tính số mol chất tan nNaCl = 100/1000 = 0,1 mol - Khối lượng 0,1 mol NaCl mNaCl = 0,1 × 58,5 = 5,85 g | Cách pha chế: - Cân lấy 5,85g NaCl cho vào cốc thủy tinh dung tích 200ml. Đổ dần nước cất vào cốc và khuấy nhẹ cho đủ 100ml dung dịch. Ta được 100ml dung dịch NaCl 1M |
2. Cách pha loãng dung dịch theo m = nồng độ cho trước
BT2: có nước cất và những dụng cụ cần thiết hãy tính toán và giới thiệu các cách pha chế:
a. 100ml dung dịch NaSO4 0,1M từ dung dich NaSO4 1M
b. 100g dung dịch KCl 5% từ dung dịch KCl 10%
| a. Tính toán: - Tìm số mol chất tan trong 100ml dung dịch NaSO4 0,1M: nNaSO4 = (0,1*100)/1000 = 0.01 mol - Tìm thể tích dung dịch NaSO4 1M trong đó chứa 0,01 ml NaSO4 Vml = (1000*0.01)/1 = 10 ml | Cách pha chế: - Đong lấy 10ml dung dịch NaSO4 1M cho vào cốc chia độ có dung tích 200ml. Thêm từ từ nước cất vào cốc đến vạch 100ml và khuấy đều, ta được 100ml dung dịch NaSO4 0,1M |
| b. Tính toán: - Tìm khối lượng KCl có trong 100g dung dịch KCl 5% mKCl = (100.5)/100 = 5g - Tìm khối lượng dung dịch KCl ban đầu có chứa 5g KCl mdd = (100.5)/10 = 50g - Tìm khối lượng nước cần dùng để pha chế: mH2O = 100 - 50 = 50 g | Cách pha chế: - Cân lấy 50g dung dịch KCl 10% bạn đầu, sau đó đổ vào cốc hoặc bình tam giác có dung tích 200ml - Cân lấy 50g nước cất, sau đó đổ vào cốc đựng dung dịch KCl nói trên. Khuất đều, ta được 100g dung dịch KCl 5% |
B/ Trắc nghiệm bài: Pha chế dung dịch
Câu 1: Bằng cách nào sau đây có thể pha chế được dung dịch NaCl 15%.
A. Hoà tan 15g NaCl vào 90g H2O
B. Hoà tan 15g NaCl vào 100g H2O
C. Hoà tan 30g NaCl vào 170g H2O
D. Hoà tan 15g NaCl vào 190g H2O
Câu 2: Để tính nồng độ mol của dung dịch KOH, người ta làm thế nào?
A. Tính số gam KOH có trong 100g dung dịch
B. Tính số gam KOH có trong 1 lít dung dịch
C. Tính số gam KOH có trong 1000g dung dịch
D. Tính số mol KOH có trong 1 lít dung dịch
Câu 3: Để tính nồng độ phần trăm của dung dịch H2SO4, người ta làm thế nào?
A. Tính số gam H2SO4 có trong 100 gam dung dịch
B. Tính số gam H2SO4 có trong 1 lít dung dịch
C. Tính số gam H2SO4 có trong 1000 gam dung dịch
D. Tính số mol H2SO4 có trong 10 lít dung dịch
Câu 4: Muốn pha 400ml dung dịch CuCl2 0,2M thì khối lượng CuCl2 cần lấy là
A. 10,8 gam B. 1,078 gam C. 5,04 gam D. 10 gam
Câu 5: Cho 3 mẫu thử mất nhãn là Fe2O3,CuO, Al2O3. Để phân biệt mấy dung dịch trên, cần sử dụng mấy chất để phân biệt? là những chất nào
A. Nước, NaOH
B. NaOH,HCl
C. CuCl2, NH3
D. Chất nào cũng được
Câu 6: Cần thêm bao nhiêu gam Na2O vào 400 gam NaOH 10% để được dung dịch NaOH 25%
A. 75 gam B. 89 gam C. 80 gam D. 62 gam
Câu 7: Chỉ dung duy nhất một chất để phân biệt Cu và Ag
A. Nước B. Quỳ tính C. AgCl2 D. NaOH
Câu 8: Có 60g dung dịch NaOH 30%. Khối lượng NaOH cần cho thêm vào dung dịch trên để được dung dịch 44% là:
A.18 gam B.15 gam C.23 gam D.21 gam
Câu 9: Để pha 100g dung dịch BaSO4 7% thì khối lượng nước cần lấy là
A. 93 gam B. 9 gam C. 90 gam D. 7 gam
Câu 10: Cách cơ bản đề nhận biết kim loại chất rắn tan hay không tan là
A. Quỳ tím
B. Nước
C. Hóa chất
D. Cách nào cũng được
Đáp án:
| 1.C | 2.D | 3.A | 4.A | 5.B |
| 6.C | 7.C | 8.B | 9.A | 10.B |
Hướng dẫn:
Câu 4: nCuCl2 = 0,2.0,4 = 0,08 mol → mCuCl2 = 0,08.135 = 10,8 gam
Câu 5:
+ Đầu tiên cho NaOH, thấy Al2O3 tan trong dung dịch
2NaOH + Al2O3 → 2NaAlO2 + H2O
+ Còn lại Fe2O3,CuO. Cho HCl vào nhóm còn lại
Mẫu thử xuất hiện dung dịch vàng nâu chất ban đầu là Fe2O3
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
Mẫu thử xuất hiện dung dịch xanh chất ban đầu là CuO
CuO + 2HCl → CuCl2 + H2O
Câu 6: Gọi mNa2O cần thêm là x (g)
mdd sau = 400 + x (gam)
mNaOH = 400.10% = 40 (gam)
mNaOH sau = 40 + x (gam)
Ta có: 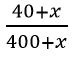 . 100% = 25% → x = 80 gam
. 100% = 25% → x = 80 gam
Câu 7: Cho AgCl vào 2 mẫu thử
Dung dịch màu xanh → Cu
Cu + 2AgCl → CuCl2 + 2Ag
Câu 8: Khối lượng NaOH có chứa trong 60 gam dung dịch 30% là:
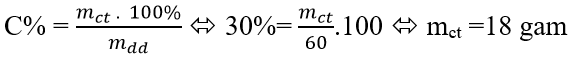
Gọi khối lượng NaOH thêm vào là a (gam), ta có
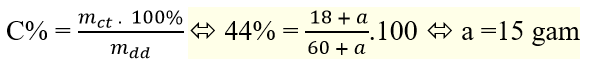
Câu 9:
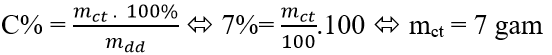
mdd = mct + mnước ⇔ 100 = 7 + mnước ⇔ mnước = 93 gam
Với chuyên đề: Pha chế dung dịch trên đây chúng ta có thể hiểu rõ về khái niệm, cách thức pha chế một dung dịch.
Trên đây VnDoc đã giới thiệu tới các bạn lý thuyết Hóa học 8: Pha chế dung dịch. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Chuyên đề Hóa học 8, Giải bài tập Hóa học lớp 8, Giải bài tập Vật Lí 8, Tài liệu học tập lớp 8 mà VnDoc tổng hợp và giới thiệu tới các bạn đọc.
Từ khóa » Bài Toán Pha Chế Dung Dịch Lớp 8
-
Bài Tập Pha Chế Một Dung Dịch Theo Nồng độ Cho Trước Cực Hay, Có ...
-
Bài Tập Về Pha Chế Dung Dịch - Sách Bài Tập Môn Hóa Học Lớp 8
-
Bài Tập độ Tan-nồng độ Dung Dịch - Chuyên Mục Hóa Học Lớp 8
-
Pha Chế Dung Dịch
-
Hoá Học 8 Bài 43: Pha Chế Dung Dịch - HOC247
-
Giải Bài Tập Hóa Học 8 - Bài 43: Pha Chế Dung Dịch
-
Hoá Học 8 Bài 43: Pha Chế Dung Dịch
-
Giải Bài 43 Hóa Học 8: Pha Chế Dung Dịch - Tech12h
-
Lý Thuyết Pha Chế Dung Dịch | SGK Hóa Lớp 8
-
Giải Hóa Học 8 Bài 43: Pha Chế Dung Dịch
-
Đề Kiểm Tra 15 Phút Môn Hóa Học Lớp 8 Bài: Bài Pha Chế Dung Dịch
-
Pha Loãng Hoặc Cô đặc Dung Dịch Môn Hóa Lớp 8 - Luyện Tập 247
-
Giải Bài Tập Hóa 8 Bài 43: Pha Chế Dung Dịch
-
Hóa Học Lớp 8 - Bài 43 - Pha Chế Dung Dịch ( Phần Lý Thuyết )