Photpho | Kiến Thức Wiki | Fandom
- Cấu hình e: 1s2 2s2 2p6 3s2 3p3 + Chu kì 3 + Nhóm VA + Vị trí: ô 15 - Biểu diễn e trên obitan:
↑↓ | ↑ ↑ ↑ 3s 3p→ P có hóa trị 3 - Ở trạng thái kích thích:
↑ | ↑ ↑ ↑ | ↑→ P có hóa trị 5
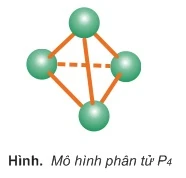
1. Tính chất vật líThường gặp 2 dạng thù hình phổ biến là P đỏ và P trắng: - P trắng là chất rắn trong suốt, màu trắng hoặc vàng nhạt, giống sáp, cấu trúc mạng tinh thể phân tử. P trắng mềm, dễ nóng chảy. P trắng không tan trong nước nhưng tan nhiều trong các dung môi hữu cơ; rất độc, gây bỏng nặng khi rơi vào da; bốc cháy trong không khí ở nhiệt độ trên 400c, bảo quản bằng cách ngâm trong nước. Ở nhiệt độ thường, P trăng phát quang màu lục nhạt trong bóng tối.

- P đỏ là chất bột màu đỏ có cấu trúc polime, khó nóng chảy và khó bay hơi hơn P trắng; không tan trong các dung môi hữu cơ thông thường, dễ hút ẩm và chảy rữa, bền trong không khí ở nhiệt độ thường và không phát quang trong bóng tối. Chỉ bốc cháy ở nhiệt độ trên 2500c. Khi đun nóng không có không khí, P đỏ chuyển thành dạng hơi, khi làm lạnh thì hơi của nó ngưng tụ lại thành P trắng.
 Photpho đỏ
Photpho đỏ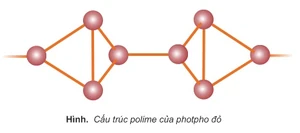 2. Tính chất hóa học
2. Tính chất hóa học - Các mức oxi hóa có thể có của P: -3, 0, +3, +5. - P hoạt động hóa học mạnh hơn N2 vì liên kết P - P kém bền hơn so với liên kết N ≡ N. - P trắng hoạt động hơn P đỏ (vì P trắng có kiểu mạng phân tử còn P đỏ có cấu trúc kiểu polime).
a. Tính oxi hóaP có phản ứng với nhiều kim loại → muối photphua: 2P + 3Mg → Mg3P2 Các muối photphua bị thủy phân mạnh giải phóng photphin (PH3). Ca3P2 + 6H2O → 2PH3 + 3Ca(OH)2 Photphin là một khí không màu rất độc, có mùi tỏi, bốc cháy trong không khí ở nhiệt độ gần 1500C. 2PH3 + 4O2 → P2O5 + 3H2O
b. Tính khử- Phản ứng với phi kim: O2, halogen... 4P + 3O2 → 2P2O3 4P + 5O2 → 2P2O5 (nếu O2 dư) (P trắng phản ứng được ở ngay nhiệt độ thường và có hiện tượng phát quang hóa học; P đỏ chỉ phản ứng khi nhiệt độ > 2500C). 2P + 3Cl2 → 2PCl3 2P + 5Cl2 → 2PCl5 - Phản ứng với các chất oxi hóa khác 6Pđ + 3KClO3 → 3P2O5 + 5KCl (t0) (phản ứng xảy ra khi quẹt diêm) 6Pt + 5K2Cr2O7 → 5K2O + 5Cr2O3 + 3P2O5 P + 5HNO3 → H3PO4 + 5NO2 + H2O 2P + 5H2SO4 đặc → 2H3PO4 + 3H2O + 5SO2
3. Trạng thái tự nhiên và điều chế- Trong tự nhiên chỉ tồn tại ở dạng hợp chất. Hai khoáng vật chính là apatit 3Ca3(PO4)2.CaF2 và photphorit Ca3(PO4)2. - Điều chế: Ca3(PO4)2 + 3SiO2 + 5C → 3CaSiO3 + 2P + 5CO (lò điện ở 15000C) P hơi ---> P rắn, trắng (đk làm lạnh) 4; Ứng dụng - Sản xuất diêm, axitphotphoric H3PO4. - Dùng vào mục đích quân sự như sản xuất bom.
Từ khóa » M Phốtpho
-
Phosphor – Wikipedia Tiếng Việt
-
Photpho Nguyên Tử Khối - Học Tốt Hóa Cùng Toppy!
-
Photpho Có Hóa Trị Mấy? M Của Photpho? - TopLoigiai
-
Nguyên Tử Khối Của Các Nguyên Tố Hoá Học Flashcards | Quizlet
-
Phốtpho - Phosphorus
-
Tính Chất Hoá Học Của Photpho (P), Cấu Tạo Phân Tử Và Bài Tập Về ...
-
Bán Kính Nguyên Tử ☢️ (Phốtpho, P) 2022 - Å, Pm, Nm, M, µin
-
Bảng Tuần Hoàn - Ptable
-
Tổng Quan Về Rối Loạn Nồng độ Phosphat - Cẩm Nang MSD
-
Dấu Hiệu Cơ Thể Thiếu Phốt Pho
-
Bán Kính Ion ☢️ (Phốtpho, P) 2022 - Å, Pm, Nm, M, µin - Vật Chất (VN)
-
Cho M Gam Hỗn Hợp A Gồm Bột Lưu Huỳnh Và Photpho Vào 500 Ml ...
-
Phốt Pho | Facebook
