Phương Pháp Dùng Hoá Chất để Phân Biệt Các Chất Hữu Cơ Và Vô Cơ
Có thể bạn quan tâm
- Trang Chủ
- Đăng ký
- Đăng nhập
- Upload
- Liên hệ

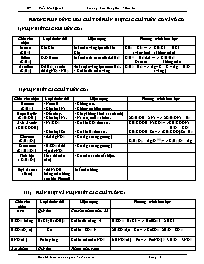
Chất cần nhận Loại thuốc thử Hiện tượng
Metan
(CH4 ) Khí Clo
Mất màu vàng lục của khí Clo
Etilen
(C2H4 ) D.D Brom Mất màu da cam của d.d Br2
Axetilen
(C2H2 ) Dd Br2 , sau đó
dd AgNO3 / NH3 -Mất màu vàng lục nước Br2.
- Có kết tửa màu vàng
 haiha30
haiha30  1388
1388 2 Download Bạn đang xem tài liệu "Phương pháp dùng hoá chất để phân biệt các chất hữu cơ và vô cơ", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trênPHƯƠNG PHÁP DÙNG HOÁ CHẤT ĐỂ PHÂN BIỆT CÁC CHẤT HỮU CƠ VÀ VÔ CƠ I) NHẬN BIẾT CÁC KHÍ HỮU CƠ : Chất cần nhận Loại thuốc thử Hiện tượng Phương trình hoá học Metan (CH4 ) Khí Clo Mất màu vàng lục của khí Clo CH4 + Cl2 --- > CH3Cl + HCl ( vàng lục) ( không màu) Etilen (C2H4 ) D.D Brom Mất màu da cam của d.d Br2 C2H4 + Br2 d.d --- > C2H4Br2 Da cam không màu Axetilen (C2H2 ) Dd Br2 , sau đó dd AgNO3 / NH3 -Mất màu vàng lục nước Br2. - Có kết tửa màu vàng C2H2 + Br2 -- > Ag – C = C – Ag + H2O ( vàng ) II) NHẬN BIẾT CÁC CHẤT HỮU CƠ : Chất cần nhận Loại thuốc thử Hiện tượng Phương trình hoá học Benzen (C6H6 ) - Nước lã - Kim loại Na - Không tan. - Không có hiện tượng. Rượu Etylic (C2H5OH ) - Đốt cháy. - Kim loại Na. - Cháy không khói ( xanh mờ) - Na tan, có H2 sinh ra. 2C2H5OH +2 Na -- > 2C2H5ONa + H2 Axit Axetic ( CH3COOH ) - Na2CO3 - Kim loại Zn - Có khí CO2 thoát ra. - Có khí H2 thoát ra. CH3COOH+Na2CO3 -- >CH3COONa + H2O + CO2 CH3COOH+Zn -- > (CH3COO)2Zn +H2 Glucozơ (C6H12O6) - d.d AgNO3 - Có Ag ( tráng gương ) C6H12O6 + Ag2O NH3-- > C6H12O7 + Ag Saccarozơ (C12H22O11) - H2SO4 đ rồi vào AgNO3 - Có Ag ( tráng gương ) Tinh bột ( C6H10O5) I ốt ( dd màu nâu) - Có màu xanh xuất hiện. Etyl Axetat ( Este) - dd NaOH loãng màu hồng ( có hòa Phenol) Mất màu hồng PHÂN BIỆT VÀ NHẬN BIẾT CÁC CHẤT LỎNG : Chất cần nhận Loại thuốc thử Hiện tượng Phương trình hoá học Axit Quỳ tím Chuyển thành màu đỏ H2SO4 loãng BaCl2 ; Ba(OH)2 Có kết tủa trắng H2SO4 + BaCl2 -- > BaSO4 + 2 HCl H2SO4 (Đ, n) Cu Có khí SO2 2H2SO4đ,n + Cu -- > CuSO4 + 2H2O + SO2 HNO3 (đ ) Fe hay Mg Có khí màu nâu NO2 6 HNO3 (đ ) + Fe -- > Fe(NO3)3 +3 H2O + 3NO2 Bazơ kiềm Quỳ tím Thành màu xanh Bazơ kiềm Nhôm Tan ra, có khí H2 Al + NaOH + H2O -- > NaAlO2 + H2 Ca(OH)2 CO2 hoặc SO2 Có kết tủa trắng Ca(OH)2 + CO2 -- > CaCO3 + H2O H2O Kim loại Na, K Có khí H2 2 H2O + 2 Na --- > 2 NaOH + H2 Muối : Cl AgNO3 Có kết tủa AgCl AgNO3 + KCl -- > AgCl + KNO3 Muối : CO3 HCl hoặc H2SO4 Tan ra, có khí CO2 2HCl + CaCO3 -- > CaCl2 + H2O + CO2 Muối : SO3 HCl hoặc H2SO4 Tan ra, có khí SO2 H2SO4 + Na2SO3 -- > Na2SO4 + H2O + SO2 Muối : PO4 AgNO3 Có Ag3PO4 vàng 3AgNO3 + Na3PO4 -- > Ag3PO4 + 3 NaNO3 Muối : SO4 BaCl2 ; Ba(OH)2 Có kết tủa trắng BaCl2 + Na2SO4 -- > 2NaCl + BaSO4 Muối : NO3 H2SO4đặc + Cu Có dd xanh + NO2 nâu H2SO4đ + Cu + NaNO3 -- > Cu(NO3)2 + Na2SO4 + NO2 + H2O Muối Sắt ( III NaOH d.d Có Fe(OH)3 nâu đỏ 3 NaOH + FeCl3 -- > 3NaCl + Fe(OH)3 Muối Sắt ( II ) NaOH d.d Fe(OH)2 trằng sau bị hoá nâu đỏ ngoài k. khí 2NaOH + FeCl2 -- > 2NaCl + Fe(OH)2 4 Fe(OH)2 + 2 H2O + O2 -- > 4 Fe(OH)3 Muối Đồng D. dịch có màu xanh. Muối Nhôm NaOH dư Al(OH)3 ; sau đó tan ra . 3 NaOH + AlCl3 -- > 3 NaCl + Al(OH)3 Al(OH)3 + NaOH -- > NaAlO2 + H2O Muối Can xi Na2CO3 d.d Có CaCO3 Na2CO3 + CaCl2 -- > 2NaCl + CaCO3 Muối Chì Na2S d.d PbS màu đen Na2S + PbCl2 -- > 2 NaCl + PbS IV) NHẬN BIẾT CÁC CHẤT KHÍ : Chất cần nhận Loại thuốc thử Hiện tượng Phương trình hoá học NH3 Quỳ tím ướt Đổi thành màu Xanh Mùi khai NO2 - Màu chất khí - Giấy qùi tím ẩm Màu nâu Quì tím chuyển thành đỏ 3 NO2 +H2O -- > 2 HNO3 + NO NO Dùng không khí hoặc Oxi để trộn Từ không màu, hoá thành nâu 2 NO + O2 --- > 2 NO2 H2S Cu(NO3)2 CuS màu đen Khí có mùi trứng thối H2S + CuCl2 -- > CuS + HCl O2 Tàn đóm đỏ Bùng cháy sáng CO2 Nước vôi trong Ca(OH)2 hoặc tàn đóm Nước vôi trong bị đục - Tàn đóm tắt đi CO2 + Ca(OH)2 --- > CaCO3 + H2O CO Đốt cháy, cho sản phẩm qua nước vôi trong Sản phẩm làm nước vôi trong bị đục 2CO + O2 ---- > 2CO2 CO2 + Ca(OH)2 --- > CaCO3 + H2O SO2 Nước vôi trong Ca(OH)2 Nước vôi trong bị đục SO2 + Ca(OH)2 --- > CaSO3 + H2O SO3 Qùi tím ẩm D.D BaCl Quì tím hoá đỏ Nước vôi trong bị đục SO3 + Ca(OH)2 -- > CaSO4 + H2O Cl2 Quì tìm ẩm Quì tím mất màu HCl Quì tìm ẩm Quì tím hóa thành đỏ H2 Đốt: có tiếng nổ nhỏ Sản phẩm không đục nước vôi trong Không khí Tàn đóm còn đỏ Tàn đóm vẫn bình thường V) NHẬN BIẾT CÁC KIM LOẠI : Chất cần nhận Loại thuốc thử Hiện tượng Phương trình hoá học Na ; K Nước (H2O) Tan và có khí H2 4K + O2 --- > 2 K2O Ca Nước (H2O) Tan và có khí H2. Dd làm nước vôi trong đục. Al Dd Kiềm : NaOH Hoặc: HNO3 đặc - Tan ra và có khí H2 - Không tan trong HNO3 đặc 2Al + 2NaOH + 2H2O --- > 2 NaAlO2 +3H2 Zn Dd Kiềm : NaOH Hoặc: HNO3 đặc - Tan ra và có khí H2 - Tan, có NO2 nâu Mg -- > Pb Axit HCl - Có H2 sinh ra. Cu d.d AgNO3 - Tan ra; có chất rắn trắng xám bám ngòai; dd màu xanh. Ag - HNO3 -Rồi vào d.d NaCl - Tan, có khí màu nâu NO2 - Có kết tủa trắng VI) NHẬN BIẾT CÁC PHI KIM : Chất cần nhận Loại thuốc thử Hiện tượng Phương trình hoá học I2 (Rắn -tím) Hồ tinh bột Có màu xanh xuất hiện. S (Rắn - vàng) Đốt trong O2 hoặc không khí Có khí SO2 trắng, mùi hắc P ( Rắn - Đỏ ) - Đốt cháy rồi cho SP vào nước, thử quì tím Sản phẩm làm quì tím hóa đỏ C (Rắn - Đen ) Đôt cháy cho SP vào nước vôi trong - Nước vôi trong bị đục
2 Download Bạn đang xem tài liệu "Phương pháp dùng hoá chất để phân biệt các chất hữu cơ và vô cơ", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trênPHƯƠNG PHÁP DÙNG HOÁ CHẤT ĐỂ PHÂN BIỆT CÁC CHẤT HỮU CƠ VÀ VÔ CƠ I) NHẬN BIẾT CÁC KHÍ HỮU CƠ : Chất cần nhận Loại thuốc thử Hiện tượng Phương trình hoá học Metan (CH4 ) Khí Clo Mất màu vàng lục của khí Clo CH4 + Cl2 --- > CH3Cl + HCl ( vàng lục) ( không màu) Etilen (C2H4 ) D.D Brom Mất màu da cam của d.d Br2 C2H4 + Br2 d.d --- > C2H4Br2 Da cam không màu Axetilen (C2H2 ) Dd Br2 , sau đó dd AgNO3 / NH3 -Mất màu vàng lục nước Br2. - Có kết tửa màu vàng C2H2 + Br2 -- > Ag – C = C – Ag + H2O ( vàng ) II) NHẬN BIẾT CÁC CHẤT HỮU CƠ : Chất cần nhận Loại thuốc thử Hiện tượng Phương trình hoá học Benzen (C6H6 ) - Nước lã - Kim loại Na - Không tan. - Không có hiện tượng. Rượu Etylic (C2H5OH ) - Đốt cháy. - Kim loại Na. - Cháy không khói ( xanh mờ) - Na tan, có H2 sinh ra. 2C2H5OH +2 Na -- > 2C2H5ONa + H2 Axit Axetic ( CH3COOH ) - Na2CO3 - Kim loại Zn - Có khí CO2 thoát ra. - Có khí H2 thoát ra. CH3COOH+Na2CO3 -- >CH3COONa + H2O + CO2 CH3COOH+Zn -- > (CH3COO)2Zn +H2 Glucozơ (C6H12O6) - d.d AgNO3 - Có Ag ( tráng gương ) C6H12O6 + Ag2O NH3-- > C6H12O7 + Ag Saccarozơ (C12H22O11) - H2SO4 đ rồi vào AgNO3 - Có Ag ( tráng gương ) Tinh bột ( C6H10O5) I ốt ( dd màu nâu) - Có màu xanh xuất hiện. Etyl Axetat ( Este) - dd NaOH loãng màu hồng ( có hòa Phenol) Mất màu hồng PHÂN BIỆT VÀ NHẬN BIẾT CÁC CHẤT LỎNG : Chất cần nhận Loại thuốc thử Hiện tượng Phương trình hoá học Axit Quỳ tím Chuyển thành màu đỏ H2SO4 loãng BaCl2 ; Ba(OH)2 Có kết tủa trắng H2SO4 + BaCl2 -- > BaSO4 + 2 HCl H2SO4 (Đ, n) Cu Có khí SO2 2H2SO4đ,n + Cu -- > CuSO4 + 2H2O + SO2 HNO3 (đ ) Fe hay Mg Có khí màu nâu NO2 6 HNO3 (đ ) + Fe -- > Fe(NO3)3 +3 H2O + 3NO2 Bazơ kiềm Quỳ tím Thành màu xanh Bazơ kiềm Nhôm Tan ra, có khí H2 Al + NaOH + H2O -- > NaAlO2 + H2 Ca(OH)2 CO2 hoặc SO2 Có kết tủa trắng Ca(OH)2 + CO2 -- > CaCO3 + H2O H2O Kim loại Na, K Có khí H2 2 H2O + 2 Na --- > 2 NaOH + H2 Muối : Cl AgNO3 Có kết tủa AgCl AgNO3 + KCl -- > AgCl + KNO3 Muối : CO3 HCl hoặc H2SO4 Tan ra, có khí CO2 2HCl + CaCO3 -- > CaCl2 + H2O + CO2 Muối : SO3 HCl hoặc H2SO4 Tan ra, có khí SO2 H2SO4 + Na2SO3 -- > Na2SO4 + H2O + SO2 Muối : PO4 AgNO3 Có Ag3PO4 vàng 3AgNO3 + Na3PO4 -- > Ag3PO4 + 3 NaNO3 Muối : SO4 BaCl2 ; Ba(OH)2 Có kết tủa trắng BaCl2 + Na2SO4 -- > 2NaCl + BaSO4 Muối : NO3 H2SO4đặc + Cu Có dd xanh + NO2 nâu H2SO4đ + Cu + NaNO3 -- > Cu(NO3)2 + Na2SO4 + NO2 + H2O Muối Sắt ( III NaOH d.d Có Fe(OH)3 nâu đỏ 3 NaOH + FeCl3 -- > 3NaCl + Fe(OH)3 Muối Sắt ( II ) NaOH d.d Fe(OH)2 trằng sau bị hoá nâu đỏ ngoài k. khí 2NaOH + FeCl2 -- > 2NaCl + Fe(OH)2 4 Fe(OH)2 + 2 H2O + O2 -- > 4 Fe(OH)3 Muối Đồng D. dịch có màu xanh. Muối Nhôm NaOH dư Al(OH)3 ; sau đó tan ra . 3 NaOH + AlCl3 -- > 3 NaCl + Al(OH)3 Al(OH)3 + NaOH -- > NaAlO2 + H2O Muối Can xi Na2CO3 d.d Có CaCO3 Na2CO3 + CaCl2 -- > 2NaCl + CaCO3 Muối Chì Na2S d.d PbS màu đen Na2S + PbCl2 -- > 2 NaCl + PbS IV) NHẬN BIẾT CÁC CHẤT KHÍ : Chất cần nhận Loại thuốc thử Hiện tượng Phương trình hoá học NH3 Quỳ tím ướt Đổi thành màu Xanh Mùi khai NO2 - Màu chất khí - Giấy qùi tím ẩm Màu nâu Quì tím chuyển thành đỏ 3 NO2 +H2O -- > 2 HNO3 + NO NO Dùng không khí hoặc Oxi để trộn Từ không màu, hoá thành nâu 2 NO + O2 --- > 2 NO2 H2S Cu(NO3)2 CuS màu đen Khí có mùi trứng thối H2S + CuCl2 -- > CuS + HCl O2 Tàn đóm đỏ Bùng cháy sáng CO2 Nước vôi trong Ca(OH)2 hoặc tàn đóm Nước vôi trong bị đục - Tàn đóm tắt đi CO2 + Ca(OH)2 --- > CaCO3 + H2O CO Đốt cháy, cho sản phẩm qua nước vôi trong Sản phẩm làm nước vôi trong bị đục 2CO + O2 ---- > 2CO2 CO2 + Ca(OH)2 --- > CaCO3 + H2O SO2 Nước vôi trong Ca(OH)2 Nước vôi trong bị đục SO2 + Ca(OH)2 --- > CaSO3 + H2O SO3 Qùi tím ẩm D.D BaCl Quì tím hoá đỏ Nước vôi trong bị đục SO3 + Ca(OH)2 -- > CaSO4 + H2O Cl2 Quì tìm ẩm Quì tím mất màu HCl Quì tìm ẩm Quì tím hóa thành đỏ H2 Đốt: có tiếng nổ nhỏ Sản phẩm không đục nước vôi trong Không khí Tàn đóm còn đỏ Tàn đóm vẫn bình thường V) NHẬN BIẾT CÁC KIM LOẠI : Chất cần nhận Loại thuốc thử Hiện tượng Phương trình hoá học Na ; K Nước (H2O) Tan và có khí H2 4K + O2 --- > 2 K2O Ca Nước (H2O) Tan và có khí H2. Dd làm nước vôi trong đục. Al Dd Kiềm : NaOH Hoặc: HNO3 đặc - Tan ra và có khí H2 - Không tan trong HNO3 đặc 2Al + 2NaOH + 2H2O --- > 2 NaAlO2 +3H2 Zn Dd Kiềm : NaOH Hoặc: HNO3 đặc - Tan ra và có khí H2 - Tan, có NO2 nâu Mg -- > Pb Axit HCl - Có H2 sinh ra. Cu d.d AgNO3 - Tan ra; có chất rắn trắng xám bám ngòai; dd màu xanh. Ag - HNO3 -Rồi vào d.d NaCl - Tan, có khí màu nâu NO2 - Có kết tủa trắng VI) NHẬN BIẾT CÁC PHI KIM : Chất cần nhận Loại thuốc thử Hiện tượng Phương trình hoá học I2 (Rắn -tím) Hồ tinh bột Có màu xanh xuất hiện. S (Rắn - vàng) Đốt trong O2 hoặc không khí Có khí SO2 trắng, mùi hắc P ( Rắn - Đỏ ) - Đốt cháy rồi cho SP vào nước, thử quì tím Sản phẩm làm quì tím hóa đỏ C (Rắn - Đen ) Đôt cháy cho SP vào nước vôi trong - Nước vôi trong bị đục Tài liệu đính kèm:
 PHUONG PHAP DUNG HOA CHAT DE PHAN BIET CAC CHAT HUUCO VA VO CO.doc
PHUONG PHAP DUNG HOA CHAT DE PHAN BIET CAC CHAT HUUCO VA VO CO.doc
 Kế hoạch nâng cao chất lượng học kì I Vật lí Lớp 8 - Năm học 2009-2010 - Đoàn Năng Nghiễm
Kế hoạch nâng cao chất lượng học kì I Vật lí Lớp 8 - Năm học 2009-2010 - Đoàn Năng Nghiễm Lượt xem: 808
Lượt xem: 808  Lượt tải: 0
Lượt tải: 0 Giáo án Hóa học 8 - Bài 10: Một số muối quan trọng
Giáo án Hóa học 8 - Bài 10: Một số muối quan trọng Lượt xem: 1362
Lượt xem: 1362  Lượt tải: 0
Lượt tải: 0 Giáo án Vật lí Lớp 8 - Tiết 15: Thực hành nghiệm lại Lực đẩy Acsimet - Năm học 2011-2012
Giáo án Vật lí Lớp 8 - Tiết 15: Thực hành nghiệm lại Lực đẩy Acsimet - Năm học 2011-2012 Lượt xem: 840
Lượt xem: 840  Lượt tải: 0
Lượt tải: 0 Bài giảng Vật lý Lớp 8 - Bài 2: Vận tốc
Bài giảng Vật lý Lớp 8 - Bài 2: Vận tốc Lượt xem: 1105
Lượt xem: 1105  Lượt tải: 0
Lượt tải: 0 Giáo án Vật lí Lớp 8 - Tiết 2, Bài 2: Vận tốc - Năm học 2009-2010 - Hoàng Đình Tuấn
Giáo án Vật lí Lớp 8 - Tiết 2, Bài 2: Vận tốc - Năm học 2009-2010 - Hoàng Đình Tuấn Lượt xem: 890
Lượt xem: 890  Lượt tải: 0
Lượt tải: 0 Giáo án Hóa học 8 - Tuần 26 - Năm học 2020-2021 - Phạm Bích Tuyền
Giáo án Hóa học 8 - Tuần 26 - Năm học 2020-2021 - Phạm Bích Tuyền Lượt xem: 74
Lượt xem: 74  Lượt tải: 0
Lượt tải: 0 Giáo án Vật lí Khối 8 - Tiết 12 đến 14
Giáo án Vật lí Khối 8 - Tiết 12 đến 14 Lượt xem: 678
Lượt xem: 678  Lượt tải: 0
Lượt tải: 0 Giáo án Vật lí Lớp 8 - Chương trình cơ bản - Năm học 2005-2006
Giáo án Vật lí Lớp 8 - Chương trình cơ bản - Năm học 2005-2006 Lượt xem: 991
Lượt xem: 991  Lượt tải: 0
Lượt tải: 0 Giáo án Vật lí Lớp 8 - Tiết 2: Bài tập về vận tốc
Giáo án Vật lí Lớp 8 - Tiết 2: Bài tập về vận tốc Lượt xem: 1132
Lượt xem: 1132  Lượt tải: 1
Lượt tải: 1 Giáo án môn Sinh học lớp 7 năm 2009 - Tiết 21: Thực hành quan sát một số thân mềm
Giáo án môn Sinh học lớp 7 năm 2009 - Tiết 21: Thực hành quan sát một số thân mềm Lượt xem: 917
Lượt xem: 917  Lượt tải: 0
Lượt tải: 0
Copyright © 2026 Lop8.net - Giáo án điện tử lớp 8, Thư viện giáo án điện tử, Thư viện giáo án tiểu học


Từ khóa » Cách Nhận Biết Khí Br2
-
Nhận Biết Các Chất Khí Sau: F2,Cl2,Br2,I2,O2,CO2 Câu Hỏi 237336
-
Nhận Biết Các Chất Hóa Học - Kiến Thức Hoá Học
-
Nhận Biết Khí SO2 Ta Dùng Dung Dịch Nước Br2 Dư Hiện Tượng Xảy Ra ...
-
Dấu Hiệu Nhận Biết Khí - Thư Viện Đề Thi
-
Tôi Yêu Hóa Học - PHƯƠNG PHÁP GIẢI BÀI TẬP NHẬN BIẾT
-
Nhận được CO2 ( Làm đục Nước Vôi Trong) CO2 + Ca(OH ... - Facebook
-
Nêu Phương Pháp Nhận Biết ( Chứng Minh ) Các Khí Hay Hỗn Hợp ...
-
NHẬN BIẾT MỘT SỐ CHẤT KHÍ 1 Nhận Biết Khí CO
-
Cách Nhận Biết Chất Trong Hóa Học - Tài Liệu Text - 123doc
-
Phương Trình Phản ứng H2+Br2→HBr - Hóa Học 24H
-
Cách Nhận Biết Một Số Hợp Chất Hữu Cơ
-
Nhận Biết & Phân Biệt CO2 Và SO2 Bằng Phương Pháp Hoá Học
-
Cách Nhận Biết Và Phân Biệt So2 Và Co2 Như Thế Nào?