Phương Pháp Giải Bài Tập Có Chất Dư Trong Phản ứng Hóa Học
Có thể bạn quan tâm
Tóm tắt nội dung
Xem online Tải về NONE
NONE Để giúp các em nắm vững phương pháp giải bài tập hóa học, HOC247 xin cung cấp tài liệu Phương pháp giải bài tập có chất dư trong phản ứng hóa học môn Hóa học 8 được sưu tầm và tổng hợp dưới đây. Hi vọng sẽ giúp các em củng cố kiến thức và ôn luyện thật tốt.
ATNETWORKI. Lý thuyết & phương pháp giải
II. Ví dụ minh họa
III. Bài tập vận dụng
PHƯƠNG PHÁP GIẢI BÀI TẬP CÓ CHẤT DƯ TRONG PHẢN ỨNG HÓA HỌC
I. Lý thuyết & phương pháp giải
Bài toán cho biết lượng của hai chất tham gia và yêu cầu tính lượng chất tạo thành. Trong số hai chất tham gia phản ứng sẽ có một chất phản ứng hết, chất kia có thể phản ứng hết hoặc dư.
Các bước giải toán:
Bước 1: Tính số mol: đổi lượng chất đề bài cho (khối lượng, thể tích) ra số mol.
Bước 2: Viết và cân bằng phương trình hóa học:
aA + bB → cC + dD
Bước 3: So sánh tỉ lệ: nA/a và nB/b ( nA, nB lần lượt là số mol của A và B)
+ nA/a = nB/b => A và B là 2 chất phản ứng hết (vừa đủ)
+ nA/a > nB/b => Sau phản ứng thì A còn dư và B đã phản ứng hết
+ nA/a < nB/b => Sau phản ứng thì A phản ứng hết và B còn dư
Tính lượng các chất theo chất phản ứng hết.
Lưu ý: Bài toán cho cả lượng chất tham gia và lượng chất sản phẩm thì tính toán theo lượng chất sản phẩm.
II. Ví dụ minh họa
Ví dụ 1: Cho 6,5 gam kẽm tác dụng với 36,5 gam dung dịch HCl thu được ZnCl2 và khí H2 . Tính khối lượng muối tạo thành sau phản ứng.
Hướng dẫn giải:
nZn = 6,5/65 = 0,1 mol
nHCl = 36,5/36,5 = 0,1 mol
Phương trình hóa học: Zn + 2HCl → ZnCl2 + H2↑
Xét tỉ lệ:
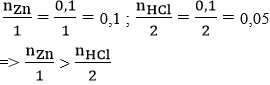
nên sau phản ứng HCl hết, Zn còn dư, lượng các chất tính theo lượng HCl
Zn + 2HCl → ZnCl2 + H2↑
0,1 → 0,05 (mol)
Khối lượng muối tạo thành sau phản ứng là:
mZnCl2 = nZnCl2 .MZnCl2 = 0,05 . (65 + 35,5.2) = 6,8 gam
Ví dụ 2: Khi cho miếng nhôm tan hết vào dung dịch có chứa 0,5 mol HCl thì thu được muối AlCl3 và 3,36 lít khí hiđro (đktc).
a. Tính khối lượng miếng nhôm đã phản ứng
b. Axit clohiđric còn dư hay không? Nếu còn dư thì khối lượng dư là bao nhiêu?
Hướng dẫn giải:
Chú ý: Bài toán cho cả lượng chất tham gia (0,5 mol HCl) và lượng chất sản phẩm (3,36 lít khí H2) thì tính toán lượng chất phản ứng theo lượng chất sản phẩm.
nH2 = 3,36/22,4 = 0,15 mol
a. Phương trình hóa học:
2Al + 6HCl → 2AlCl3 + 3H2↑
2 ← 3 mol
0,1 ← 0,15 (mol)
Khối lượng miếng nhôm đã phản ứng là:
mAl = nAl.MAl = 0,1.27 = 2,7 gam
b. Theo phương trình, nHCl phản ứng = 2nH2 = 0,15.2 = 0,3 mol
nHCl dư = nHCl ban đầu - nHCl phản ứng = 0,5 - 0,3 = 0,2 mol
Khối lượng HCl dư = 0,2 . 36,5 = 7,3 gam
Ví dụ 3: Sắt tác dụng với dung dịch CuSO4 thu được muối FeSO4 và Cu
Nếu cho 11,2 gam sắt vào dung dịch chứa 40 gam CuSO4 thì sau phản ứng thu được khối lượng Cu là bao nhiêu?
Hướng dẫn giải:
nFe = 11,2/56 = 0,2 mol
nCuSO4 = 40/(64 +32+16.4) = 0,25 mol
Phương trình hóa học: Fe + CuSO4 → FeSO4 + Cu
Xét tỉ lệ:
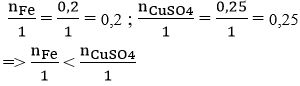
nên sau phản ứng Fe hết, CuSO4 còn dư, tính số mol Cu thu được theo số mol Fe.
Fe + CuSO4 → FeSO4 + Cu
1 → 1 mol
0,2 → 0,2 (mol)
Khối lượng Cu tạo thành sau phản ứng là:
mCu = nCu .MCu = 0,2 . 64 = 12,8 gam
III. Bài tập vận dụng
Câu 1: Cho 5,6 gam Fe phản ứng với 0,15 mol HCl theo phương trình:
Fe + 2HCl → FeCl2 + H2. Kết luận nào sau đây là chính xác:
A. Fe là chất hết.
B. HCl là chất hết.
C. Cả 2 chất cùng hết.
D. Cả 2 chất cùng dư.
Đáp án
Đáp án B
nFe = 5,6/56 = 0,1 mol
nHCl = 0,15 mol
Phương trình hóa học: Fe + 2HCl → FeCl2 + H2↑
Xét tỉ lệ:
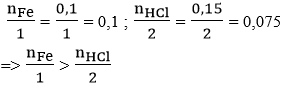
nên sau phản ứng HCl hết, Fe còn dư
Câu 2: Cho phương trình hóa học: CuO + 2HCl → CuCl2 + H2O
Nếu cho 4 gam CuO tác dụng với 2,92 gam HCl thì sau phản ứng kết luận nào sau đây đúng?
A. HCl là chất dư.
B. CuO là chất dư.
C. Cả 2 chất cùng hết.
D. Cả 2 chất cùng dư.
---Để xem tiếp nội dung của tài liệu các em vui lòng xem online hoặc tải về máy---
Trên đây là trích dẫn một phần nội dung tài liệu Phương pháp giải bài tập có chất dư trong phản ứng hóa học môn Hóa học 8. Để xem thêm nhiều tài liệu tham khảo hữu ích khác các em chọn chức năng xem online hoặc đăng nhập vào trang hoc247.net để tải tài liệu về máy tính.
Ngoài ra các em học sinh có thể tham khảo các tài liệu cùng chuyên mục:
- Phương pháp giải bài tập tính theo phương trình hóa học môn Hóa học 8
- Dạng bài tập xác định công thức hóa học hợp chất khi biết thành phần môn Hóa học 8
Chúc các em học tốt!
 NONE
NONE Tư liệu nổi bật tuần
-
Đề cương ôn tập giữa HK1 môn Vật lý 12 năm 2023 - 2024
09/10/2023 1718 -
Đề cương ôn tập giữa HK1 môn Ngữ văn 12 năm 2023-2024
09/10/2023 1109 -
Lý thuyết và Bài tập Chuyển động Cơ - Chuyển động thẳng đều Vật lí 10 có lời giải chi tiết
15/08/2023 517 -
Tổng hợp bài tập Trắc nghiệm về Các đại lượng đặc trưng của Dao động điều hòa môn Vật lý 11 có đáp án
14/08/2023 444 -
100 bài tập về Dao động điều hoà tự luyện môn Vật lý lớp 11
14/08/2023 676 - Xem thêm
 Bộ đề thi nổi bật
Bộ đề thi nổi bật  UREKA Xem online ERROR:connection to 10.20.1.101:9312 failed (errno=111, msg=Connection refused)ERROR:connection to 10.20.1.101:9312 failed (errno=111, msg=Connection refused)AANETWORK
UREKA Xem online ERROR:connection to 10.20.1.101:9312 failed (errno=111, msg=Connection refused)ERROR:connection to 10.20.1.101:9312 failed (errno=111, msg=Connection refused)AANETWORK 
XEM NHANH CHƯƠNG TRÌNH LỚP 8
Toán 8
Toán 8 Kết Nối Tri Thức
Toán 8 Chân Trời Sáng Tạo
Toán 8 Cánh Diều
Giải bài tập Toán 8 KNTT
Giải bài tập Toán 8 CTST
Giải bài tập Toán 8 Cánh Diều
Trắc nghiệm Toán 8
Ngữ văn 8
Ngữ Văn 8 Kết Nối Tri Thức
Ngữ Văn 8 Chân Trời Sáng Tạo
Ngữ Văn 8 Cánh Diều
Soạn Văn 8 Kết Nối Tri Thức
Soạn Văn 8 Chân Trời Sáng Tạo
Soạn Văn 8 Cánh Diều
Văn mẫu 8
Tiếng Anh 8
Tiếng Anh 8 Kết Nối Tri Thức
Tiếng Anh 8 Chân Trời Sáng Tạo
Tiếng Anh 8 Cánh Diều
Trắc nghiệm Tiếng Anh 8 KNTT
Trắc nghiệm Tiếng Anh 8 CTST
Trắc nghiệm Tiếng Anh 8 Cánh Diều
Tài liệu Tiếng Anh 8
Khoa học tự nhiên 8
Khoa học tự nhiên 8 KNTT
Khoa học tự nhiên 8 CTST
Khoa học tự nhiên 8 Cánh Diều
Giải bài tập KHTN 8 KNTT
Giải bài tập KHTN 8 CTST
Giải bài tập KHTN 8 Cánh Diều
Trắc nghiệm Khoa học tự nhiên 8
Lịch sử và Địa lý 8
Lịch sử & Địa lí 8 KNTT
Lịch sử & Địa lí 8 CTST
Lịch sử & Địa lí 8 Cánh Diều
Giải bài tập LS và ĐL 8 KNTT
Giải bài tập LS và ĐL 8 CTST
Giải bài tập LS và ĐL 8 Cánh Diều
Trắc nghiệm Lịch sử và Địa lí 8
GDCD 8
GDCD 8 Kết Nối Tri Thức
GDCD 8 Chân Trời Sáng Tạo
GDCD 8 Cánh Diều
Giải bài tập GDCD 8 KNTT
Giải bài tập GDCD 8 CTST
Giải bài tập GDCD 8 Cánh Diều
Trắc nghiệm GDCD 8
Công nghệ 8
Công Nghệ 8 KNTT
Công Nghệ 8 CTST
Công Nghệ 8 Cánh Diều
Trắc nghiệm Công Nghệ 8
Giải bài tập Công Nghệ 8 KNTT
Giải bài tập Công Nghệ 8 CTST
Giải bài tập Công Nghệ 8 CD
Tin học 8
Tin Học 8 Kết Nối Tri Thức
Tin Học 8 Chân Trời Sáng Tạo
Trắc nghiệm Tin học 8
Giải bài tập Tin học 8 CD
Tin Học 8 Cánh Diều
Cộng đồng
Hỏi đáp lớp 8
Tư liệu lớp 8
Xem nhiều nhất tuần
Đề thi giữa HK2 lớp 8
Đề thi HK2 lớp 8
Đề thi giữa HK1 lớp 8
Đề thi HK1 lớp 8
5 bài văn mẫu hay về bài thơ Nhớ rừng
Chiếu dời đô
Tiếng Anh Lớp 8 Unit 12
Hịch tướng sĩ
Nước Đại Việt ta
Tiếng Anh Lớp 8 Unit 11
Video Toán Nâng cao lớp 8- HK2
Video Toán Nâng cao lớp 8- HK1
Video Toán Nâng cao lớp 8- HK Hè
YOMEDIA YOMEDIA ×Thông báo
Bạn vui lòng đăng nhập trước khi sử dụng chức năng này.
Bỏ qua Đăng nhập ×Thông báo
Bạn vui lòng đăng nhập trước khi sử dụng chức năng này.
Đồng ý ATNETWORK ON QC Bỏ qua >>
QC Bỏ qua >> 
Từ khóa » Chuyên đề Bài Toán Dư Hóa 8
-
Các Bài Tập Về Lượng Chất Dư Hóa Học 8
-
Các Bài Tập Về Lượng Chất Dư Lớp 8
-
Cách Giải Bài Toán Dư Hóa Học 8 Hay Nhất - TopLoigiai
-
Cách Giải Bài Tập Hóa Có Chất Dư Trong Phản ứng Cực Hay, Chi Tiết
-
Tải Các Bài Tập Về Lượng Chất Dư Hóa Học 8 - Tài Liệu Text - 123doc
-
Chuyên đề Hóa Học "Xác định Lượng Chất Dư" - Tài Liệu Text - 123doc
-
Cách Tìm Chất Dư Hóa 8 - Tính Theo Phương Trình Hóa Học
-
Dạng Bài Tập Tính Lượng Chất Dư - Hóa Học Lớp 8 - SoanBai123
-
Lý Thuyết Phương Pháp Giải Bài Tập Tính Lượng Chất Dư, Chất Hết Hóa 8
-
Bài Toán Lượng Dư
-
BÀI TẬP CÓ LƯỢNG DƯ - HÓA 8 - Hóa Học 8 - Mai Hoa
-
Cách Tính Số Mol Dư Hóa Học 8, Các Bài Tập Về Lượng Chất Dư ...
-
Chuyên đề: Tính Theo Phương Trình Hóa Học - Thư Viện Đề Thi