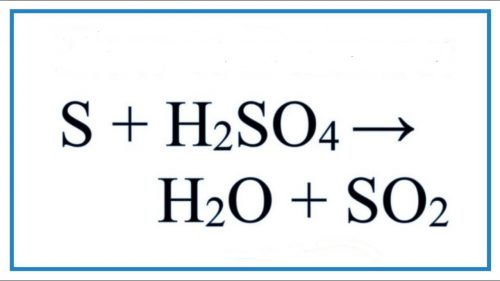
S + H2SO4 → SO2 + H2O Cân Bằng Phương Trình Hóa Học.
Có thể bạn quan tâm
Trong phản ứng hóa học ta dùng Sulfua (S) kết hợp với axit sulfuric đậm đặc (H2So4) thu được kết quả như thế nào? Mời các bạn cùng xem cân bằng phương trình hóa học S + H2SO4 đầy đủ nhất.
Bạn có thể quan tâm : al2o3 + h2so4
S + H2SO4 Sản Phẩm Tạo Ra.
S + 2H2SO4 → 3SO2 + 2H2O
Trong đó
- S : Dung dịch axit Sulfuric đậm đặc không màu
- H2SO4 : Sulfua rắn màu vàng chanh
- SO2 : Khí Lưu huỳnh Dioxit không màu có mùi hắc
- H2O : Nước
Điều kiện phản ứng: Nhiệt độ
Hiện tượng gặp phải : Chất rắn màu vàng Lưu huỳnh (S) tan dần và xuất hiện khí mùi hắc Lưu huỳnh dioxit (SO2) làm sủi bọt khí.
Bài tập có chứa S và H2SO4
Ví dụ 1: Lưu huỳnh tác dụng với dung dịch H2SO4 đặc nóng:
S + H2SO4 → SO2 + H2O.
Trong phản ứng này có tỉ lệ số nguyên tử S bị khử với số nguyên tử S bị oxi hoá là:
A. 2:1.
B. 1:2.
C. 1:3.
D. 3:1.
Lời giải
Tỉ lệ số nguyên tử S bị khử với số nguyên tử S bị oxi hoá là: 2 : 1
Chọn đáp án : A
Ví dụ 2: Trong các phương trình dưới đây, phương trình nào S vừa đóng vai trò là chất khử vừa đóng vai trò là chất oxi hóa?
A. 4S + 6NaOH (đặc) 2Na2S + Na2S2O3 +3H2O
B. S + 3F2 SF6
C. S + 6HNO3 (đặc) H2SO4 + 6NO2 + 2H2O
D. S + 2Na Na2S
B. 3,6 g
C. 0,72 g
D. 0,36 g
Lời giải
Phương trình phản ứng
2FeO + 4H2SO4 → Fe2(SO4)3 + SO2 + 4H2O
0,01 0,005 mol
mFeO = 0,01.72 = 0,72 gam
Chọn đáp án : C
Rate this postTừ khóa » H2so4 Tạo Ra S
-
H2S + H2SO4 → 2H2O + S + SO2 | , Phản ứng Oxi-hoá Khử
-
H2S, H2SO4 → H2O, S, SO2Tất Cả Phương Trình điều Chế Từ H2S ...
-
H2S + H2SO4 → SO2 + H2O + S - THPT Sóc Trăng
-
H2S + H2SO4 = S + H2O - Trình Cân Bằng Phản ứng Hoá Học
-
S + H2O = H2SO4 + H2S - Trình Cân Bằng Phản ứng Hoá Học
-
S + H2SO4 → SO2 + H2O
-
S Ra H2so4
-
Chất Tạo Ra H2SO4 Bằng Một Phản ứng - Chemical Equation Balance
-
H2SO4 + S | H2O + SO2 | Cân Bằng Phương Trình Hóa Học
-
H2S + H2SO4 → SO2 + H2O + S | H2S Ra S
-
Lưu Huỳnh Tác Dụng Với Dung Dịch H2SO4 đặc Nóng
-
Kim Loại + H2SO4 (đặc) Khi Nào Ra Sp Khử Là SO2, Khi ... - MTrend
-
S + H2SO4 → SO2 + H2O - Trường THPT Thành Phố Sóc Trăng