Sắt
Có thể bạn quan tâm
KIM LOẠI SẮT
1. Vị trí – cấu hình e – tính chất vật lí:
- Fe thuộc ô 26, chu kì 4, nhóm VIIIB
- Cấu hình e: 1s2 2s22p63s23p63d6 4s2, => Fe là nguyên tố d, có 2e ngoài cùng, 8e hoá trị
- Fe là kim loại nặng, dễ rèn, màu trắng hơi xám, có tính dẫn điện, dẫn nhiệt tốt và có tính nhiễm từ ( khác với các kim loại khác), Fe có cấu tạo mạng tinh thể lập phương tâm diện hoặc tâm khối tuỳ vào nhiệt độ
2. Tính chất hoá học: Fe là kim loại có tính khử trung bình
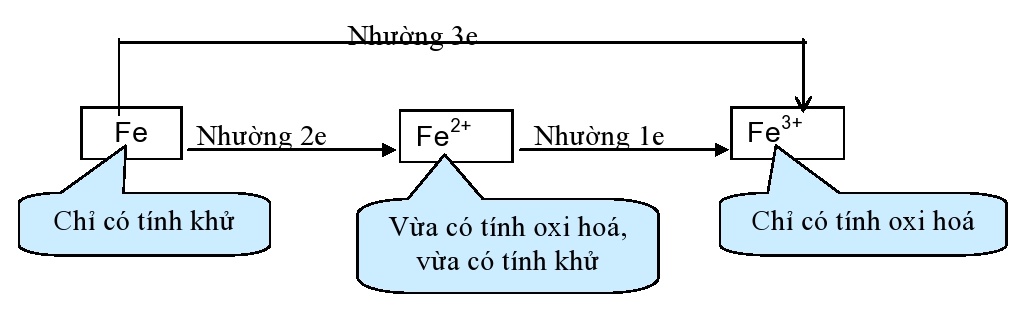
Các phương trình phản ứng
a Tác dụng với phi kim:
Fe + S \(\rightarrow\) FeS
3Fe + 2O2 \(\rightarrow\) Fe3O4, ( Có thể tạo ra hỗn hợp sản phẩm FeO, Fe2O3....)
2Fe + 3Cl2 \(\rightarrow\) 2FeCl3
b) Tác dụng với axit Fe \(\rightarrow\) Fe2+ + H2
Fe \(\rightarrow\) Fe3+ + sp khử của \(\rightarrow\) + H2O (*)
- Đối với phản ứng (*) nếu Fe dư thì Fe + 2Fe3+ \(\rightarrow\) 3Fe2+
- Fe thụ động trong HNO3 đặc nguội hoặc H2SO4 đặc nguội
c) Tác dụng với dung dịch muối: Fe bị oxi hoá thành Fe2+
Fe + 2AgNO3 \(\rightarrow\) Fe(NO3)2 + 2Ag (1)
d) Tác dụng với nước
* Ở nhiệt độ thường Fe không phản ứng với nước, nhưng Fe bị tan trong nước có khí oxi
4Fe + 6H2O + 3O2 \(\rightarrow\) 4Fe(OH)3
* Ở nhiệt độ cao( >5700) Fe + H2O \(\rightarrow\) FeO + H2
Ở nhiệt độ cao (<5700) 3Fe + 4H2O \(\rightarrow\) Fe3O4 + 4H2
3.Điều chế:
·FeCl2 \(\rightarrow\) Fe + Cl2↑
·FeSO4 + H2O \(\rightarrow\) Fe+ O2↑+ H2SO4
·FeSO4 + Mg \(\rightarrow\)Fe + MgSO4
·FeO + H2 \(\rightarrow\)Fe + H2O
·Fe3O4 + 4CO \(\rightarrow\)Fe + 4CO2↑
Từ khóa » Fe Tác Dụng Với Nước ở Nhiệt độ Cao
-
Nhận định Nào Không đúng Về Khả Năng Phản ứng Của Sắt Với Nước?
-
Cho Fe Tác Dụng Với Hơi Nước ở Nhiệt độ Cao Hơn 5700C Thì Thu ...
-
Sắt Tác Dụng Với Nước ở Nhiệt độ Cao Hơn 570oC Ch - Tự Học 365
-
Kim Loại Tác Dụng Với Nước ở Nhiệt độ Thường Là - TopLoigiai
-
Kim Loại Nào Trong Fe, Na, K, Ca Tác Dụng được Với Nước ở Nhiệt độ ...
-
Cho Fe Tác Dụng Với H2 O ở Nhiệt độ Lớn Hơn 570 0C Ta Thu được ...
-
Cho Fe Tác Dụng Với Hỏi Nước ở Nhiệt độ Cao Hơn 570 độ C Thi Thu ...
-
Lý Thuyết Về Sắt (Có Bài Tập áp Dụng)
-
Kim Loại Tác Dụng Với Nước ở Nhiệt độ Thường - Top Tài Liệu
-
Sắt Tác Dụng Với H2O ở Nhiệt độ Cao Hom 570 C Thì Tạo Ra H2 Và...
-
Sắt Tác Dụng Với H2O ở Nhiệt độ Cao Hơn 570°C Thì Tạo Ra H2 Và Sản ...
-
3Fe + 4H2O → 4H2 + Fe3O4 | , Phản ứng Oxi-hoá Khử
-
Ở Nhiệt độ Thường, Kim Loại Fe Tác Dụng được Với Dung Dịch Nào Sau...
-
Fe Tác Dụng Với Chất Nào Sau đây ở Nhiệt độ Thường