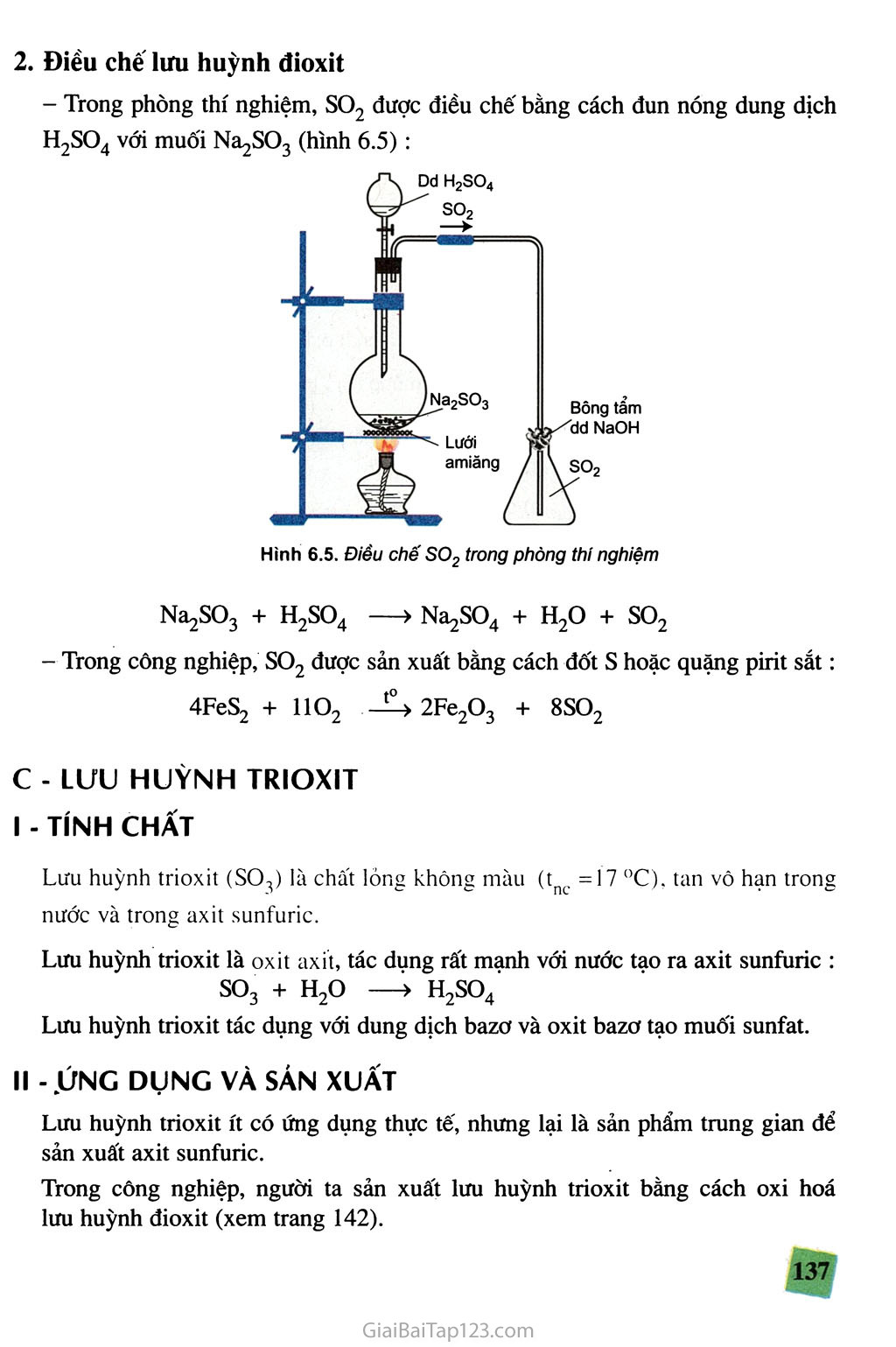
SGK Hóa Học 10 - Bài 32. Hiđro Sunfua - Lưu Huỳnh Trioxit
Có thể bạn quan tâm


- Home
- Lớp 1,2,3
- Lớp 1
- Giải Toán Lớp 1
- Tiếng Việt Lớp 1
- Lớp 2
- Giải Toán Lớp 2
- Tiếng Việt Lớp 2
- Văn Mẫu Lớp 2
- Lớp 3
- Giải Toán Lớp 3
- Tiếng Việt Lớp 3
- Văn Mẫu Lớp 3
- Giải Tiếng Anh Lớp 3
- Lớp 4
- Giải Toán Lớp 4
- Tiếng Việt Lớp 4
- Văn Mẫu Lớp 4
- Giải Tiếng Anh Lớp 4
- Lớp 5
- Giải Toán Lớp 5
- Tiếng Việt Lớp 5
- Văn Mẫu Lớp 5
- Giải Tiếng Anh Lớp 5
- Lớp 6
- Soạn Văn 6
- Giải Toán Lớp 6
- Giải Vật Lý 6
- Giải Sinh Học 6
- Giải Tiếng Anh Lớp 6
- Giải Lịch Sử 6
- Giải Địa Lý Lớp 6
- Giải GDCD Lớp 6
- Lớp 7
- Soạn Văn 7
- Giải Bài Tập Toán Lớp 7
- Giải Vật Lý 7
- Giải Sinh Học 7
- Giải Tiếng Anh Lớp 7
- Giải Lịch Sử 7
- Giải Địa Lý Lớp 7
- Giải GDCD Lớp 7
- Lớp 8
- Soạn Văn 8
- Giải Bài Tập Toán 8
- Giải Vật Lý 8
- Giải Bài Tập Hóa 8
- Giải Sinh Học 8
- Giải Tiếng Anh Lớp 8
- Giải Lịch Sử 8
- Giải Địa Lý Lớp 8
- Lớp 9
- Soạn Văn 9
- Giải Bài Tập Toán 9
- Giải Vật Lý 9
- Giải Bài Tập Hóa 9
- Giải Sinh Học 9
- Giải Tiếng Anh Lớp 9
- Giải Lịch Sử 9
- Giải Địa Lý Lớp 9
- Lớp 10
- Soạn Văn 10
- Giải Bài Tập Toán 10
- Giải Vật Lý 10
- Giải Bài Tập Hóa 10
- Giải Sinh Học 10
- Giải Tiếng Anh Lớp 10
- Giải Lịch Sử 10
- Giải Địa Lý Lớp 10
- Lớp 11
- Soạn Văn 11
- Giải Bài Tập Toán 11
- Giải Vật Lý 11
- Giải Bài Tập Hóa 11
- Giải Sinh Học 11
- Giải Tiếng Anh Lớp 11
- Giải Lịch Sử 11
- Giải Địa Lý Lớp 11
- Lớp 12
- Soạn Văn 12
- Giải Bài Tập Toán 12
- Giải Vật Lý 12
- Giải Bài Tập Hóa 12
- Giải Sinh Học 12
- Giải Tiếng Anh Lớp 12
- Giải Lịch Sử 12
- Giải Địa Lý Lớp 12
Các bài học tiếp theo
- Bài 33. Axit sunfuric - Muối sunfat
- Bài 34. Luyện tập: Oxit và lưu huỳnh
- Bài 35. Bài thực hành số 5. Tính chất các hợp chất của lưu huỳnh
- Bài 36. Tốc độ phản ứng hóa học
- Tư liệu. Chất xúc tác men (enzim)
- Bài 37. Bài thực hành số 6. Tốc độ phản ứng hóa học
- Bài 38. Căn bằng hóa học
- Tư liệu. Một phương pháp sản xuất hiđrô trong công nghiệp
- Bài đọc thêm. Hằng số cân bằng
- Bài 39. Luyện tập: Tốc độ phản ứng và cân bằng hóa học
Các bài học trước
- Bài 31. Bài thực hành số 4. Tính chất của oxit, lưu huỳnh
- Bài 30. Lưu huỳnh
- Bài đọc thêm. Sự suy giảm tầng ozon
- Bài 29. Oxit - Ozon
- Bài đọc thêm. Ô nhiễm đất do phân hóa học và thuốc bảo vệ thực vật
- Bài 28. Bài thực hành số 3. Tính chất hóa học của brom và iot
- Bài 27. Bài thực hành số 2. Tính chất hóa học của khí clo và hợp chất của clo
- Bài 26. Luyện tập: Nhóm halogen
- Bài đọc thêm. Flo và iot
- Tư liệu. Hợp chất CFC
Tham Khảo Thêm
- Giải Bài Tập Hóa Học 10
- Giải Hóa 10
- Sách Giáo Khoa - Hóa Học 10(Đang xem)
Sách Giáo Khoa - Hóa Học 10
- Chương I - NGUYÊN TỬ
- Bài 1. Thành phần nguyên tử
- Bài 2. Hạt nhân nguyên tử - Nguyên tố hóa học - Đồng vị
- Tư liệu. Ứng dụng của đồng vị phóng xạ và sử dụng năng lượng hạt nhân vì mục đích hòa bình
- Bài 3. Luyện tập: Thành phần nguyên tử
- Bài 4. Cấu tạo vỏ nguyên tử
- Bài đọc thêm. Khái niệm về obitan nguyên tử
- Bài 5. Cấu hình electron nguyên tử
- Bài 6. Luyện tập: Cấu tạo vỏ nguyên tử
- Chương 2 - BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC VÀ ĐỊNH LUẬT TUẦN HOÀN
- Bài 7. Bảng tuần hoàn các nguyên tố hóa học
- Tư liệu. Đôi nét về Đi - mi - tri I - va - nô - vich Men - đê - lê - ép và định luật tuần hoàn các nguyên tố hóa học - Bảng tuần hoàn các nguyên tố hóa học
- Bài 8. Sự biến đổi tuần hoàn cấu hình electron nguyên tử của các nguyên tố hóa học
- Bài 9. Sự biến đổi tuần hoàn tính chất của các nguyên tố hóa học. Định luật tuần hoàn
- Bài 10. Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
- Bài 11. Luyện tập: Bảng tuần hoàn, sự biến đổi tuần hoàn cấu hình electron nguyên tử và tính chất của các nguyên tố hóa học
- Chương 3 - LIÊN KẾT HÓA HỌC
- Bài 12. Liên kết ion - Tinh thể ion
- Bài 13. Liên kết cộng hóa trị
- Bài đọc thêm
- §1. Sự xen phủ các obitan nguyên tử. Sự lai hóa các obitan nguyên tử
- §2. Sự tạo thành phân tử H2O và NH3 (Có cấu tạo góc)
- Bài 14. Tinh thể nguyên tử và tinh thể phân tử
- Tư liệu. Tinh thể phân tử của nước đá
- Bài 15. Hóa trị và số oxi hóa
- Bài 16. Luyện tập: Liên kết hóa học
- Chương 4 - PHẢN ỨNG OXI HÓA - KHỬ
- Bài 17. Phản ứng oxi hóa - khử
- Bài 18. Phân loại phản ứng trong hóa học vô cơ
- Bài 19. Luyên tập: Phản ứng oxi hóa - khử
- Bài đọc thêm: Mưa axit
- Bài 20. Bài thực hành số 1. Phản ứng oxi - khử
- Chương 5 - NHÓM HALOGEN
- Bài 21. Khái quát về nhóm halogen
- Bài 22. Clo
- Bài 23. Hiđroclorua - Axit clohiđric và muối clorua
- Tư liệu. Vai trò quan trọng của axit clohiđric
- Bài 24. Sơ lược về tổ hợp chất có oxi của clo
- Bài 25. Flo - Brom - Iot
- Tư liệu. Hợp chất CFC
- Bài đọc thêm. Flo và iot
- Bài 26. Luyện tập: Nhóm halogen
- Bài 27. Bài thực hành số 2. Tính chất hóa học của khí clo và hợp chất của clo
- Bài 28. Bài thực hành số 3. Tính chất hóa học của brom và iot
- Bài đọc thêm. Ô nhiễm đất do phân hóa học và thuốc bảo vệ thực vật
- Chương 6 - OXIT - LƯU HUỲNH
- Bài 29. Oxit - Ozon
- Bài đọc thêm. Sự suy giảm tầng ozon
- Bài 30. Lưu huỳnh
- Bài 31. Bài thực hành số 4. Tính chất của oxit, lưu huỳnh
- Bài 32. Hiđro sunfua - Lưu huỳnh đioxit - Lưu huỳnh trioxit(Đang xem)
- Bài 33. Axit sunfuric - Muối sunfat
- Bài 34. Luyện tập: Oxit và lưu huỳnh
- Bài 35. Bài thực hành số 5. Tính chất các hợp chất của lưu huỳnh
- Chương 7 - TỐC ĐỘ PHẢN ỨNG VÀ CÂN BẰNG HÓA HỌC
- Bài 36. Tốc độ phản ứng hóa học
- Tư liệu. Chất xúc tác men (enzim)
- Bài 37. Bài thực hành số 6. Tốc độ phản ứng hóa học
- Bài 38. Căn bằng hóa học
- Tư liệu. Một phương pháp sản xuất hiđrô trong công nghiệp
- Bài đọc thêm. Hằng số cân bằng
- Bài 39. Luyện tập: Tốc độ phản ứng và cân bằng hóa học
Từ khóa » So2 Ra Lưu Huỳnh Trioxit
-
Hidro Sunfua (H2S), Lưu Huỳnh Dioxit (SO2), Lưu Huỳnh Trioxit (SO3 ...
-
Hidro Sunfua (H2S), Lưu Huỳnh đioxit (SO2), Lưu Huỳnh Trioxit (SO3)
-
Tính Chất Hóa Học Của Hidro Sunfua H2S, Lưu Huỳnh Dioxit SO2 ...
-
Tính Chất Vật Lý, Tính Chất Hóa Học Của Hidro Sunfua H2S, Lưu Huỳnh ...
-
Lưu Huỳnh Dioxit, Trioxit
-
Bài Giảng So2 Và Lưu Huỳnh Trioxit - Tài Liệu Text - 123doc
-
Tính Hóa Trị Của Nguyên Tố Lưu Huỳnh Trong Hợp Chất Lưu Huỳnh đi ...
-
Sự Khác Biệt Giữa SO2 Và SO3 - Sawakinome
-
[PDF] HIĐRO SUNFUA – LƯU HUỲNH ĐIOXIT - THPT Nguyễn Hữu Cảnh
-
S+O2 → SO2 Và S Ra SO3 - Hóa Học 24H
-
[PDF] BÀI 28. HIĐRO SUNFUA – LƯU HUỲNH ĐIOXIT
-
Hợp Chất Của Lưu Huỳnh - YouTube
-
Top 10 Công Thức Hóa Học Của Lưu Huỳnh Trioxit - Ôn Thi HSG