Sơ đồ Tư Duy Este - TopLoigiai
Tổng hợp kiến thức hóa 12 phần Este qua sơ đồ tư duy Este do Top lời giải biên soạn, gồm sơ đồ tư duy, lý thuyết, bài tập liên quan đến este. Phần này rất quan trọng đối với các bạn học sinh lớp 12. Đây là phần giúp cho các bạn lấy điểm tốt ở kì thi học kì ở trường và kì thi trung học.
Mục lục nội dung Sơ đồ tư duy EsteSơ đồ tư duy mẫu số 1Sơ đồ tư duy mẫu số 2 Sơ đồ tư duy mẫu số 3Sơ đồ tư duy mẫu số 4B. Lý thuyết EsteC. Các dạng bài tập về tính chất hóa học của EsteSơ đồ tư duy Este
Sơ đồ tư duy mẫu số 1
Sơ đồ tư duy mẫu số 2
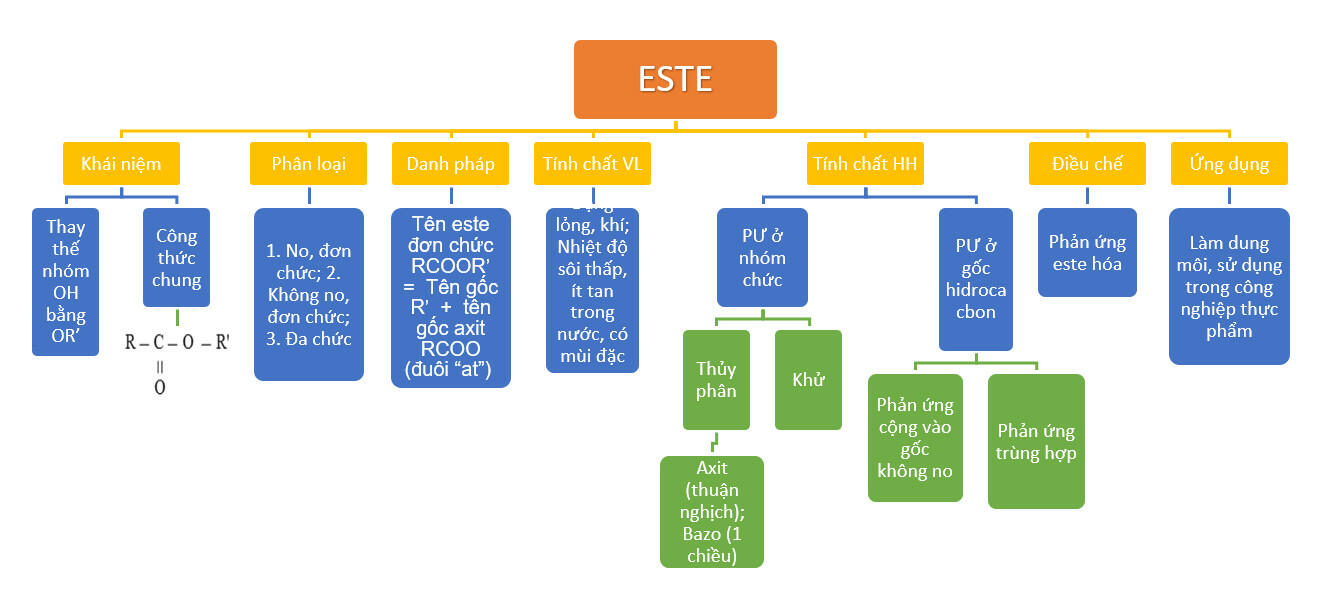
Sơ đồ tư duy mẫu số 3
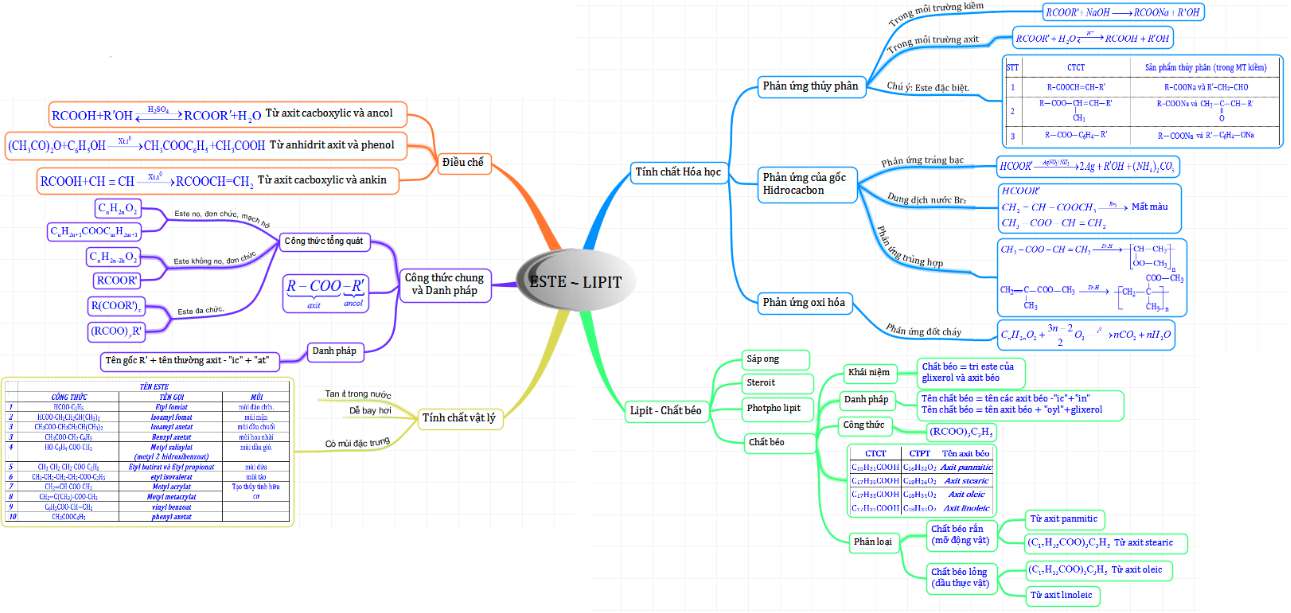
Sơ đồ tư duy mẫu số 4
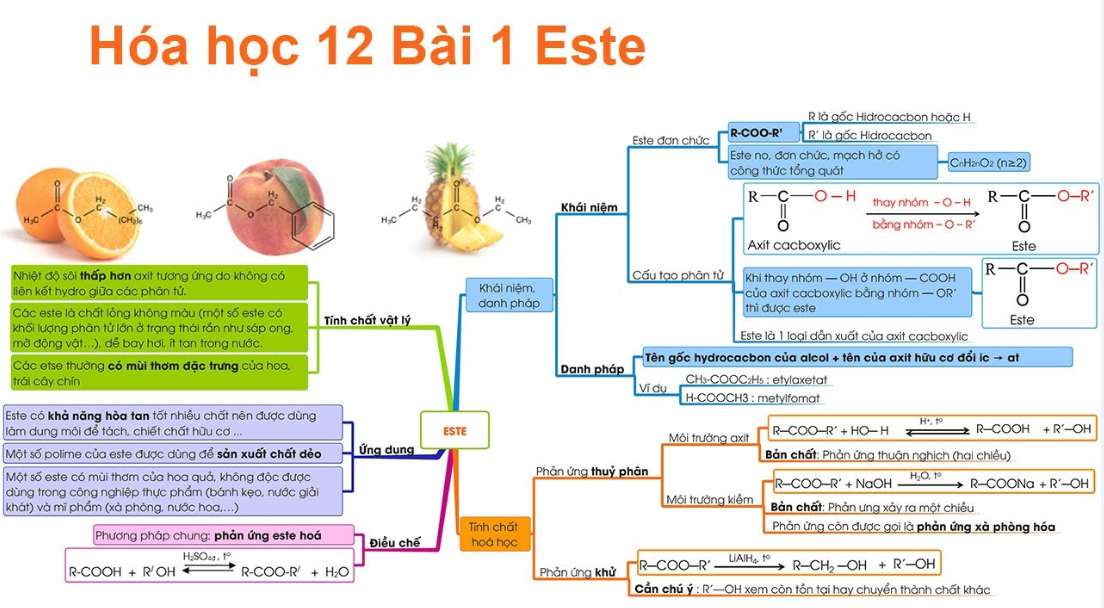
B. Lý thuyết Este
I. Định nghĩa
- Este là sản phẩm thu được khi thay thế nhóm OH trong axit cacboxylic bằng nhóm OR.
- Công thức tổng quát của một số loại este hay gặp:
+ Este no, đơn chức, mạch hở: CnH2n+1COOCmH2m+1 hay CxH2xO2 (n ≥ 0; m ≥ 1; x ≥ 2).
+ Este đơn chức: CxHyO2 hoặc RCOOR’ (x ≥ 2; y ≥ 4; y chẵn; y ≤ 2x):
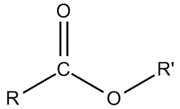
(Cấu tạo của este đơn chức)
+ Este của axit đơn chức và Ancol đa chức: (RCOO)xR’.
+ Este của axit đa chức và Ancol đơn chức: R(COOR’)x.
+ Este của axit đa chức và Ancol đa chức: Rt(COO)xyR’x.
Lưu ý rằng số chức este là bội số chung nhỏ nhất của số chức ancol và số chức axit.
II. Danh pháp
1. Tên thay thế
Gốc Ancol + tên thay thế của axit (đổi đuôi ic thành đuôi at).
2. Tên thường
Gốc Ancol + tên thường của axit (đổi đuôi ic thành đuôi at)
III. Tính chất vật lí
- Thường là chất lỏng dễ bay hơi có mùi thơm dễ chịu của trái cây.
- Nhẹ hơn nước, ít tan trong nước, dễ tách chiết bằng phễu chiết.
- Nhiệt độ sôi của este thấp hơn nhiều so với nhiệt độ sôi của các axit và Ancol có cùng số nguyên tử C vì giữa các phân tử este không có liên kết hiđro.
- Là dung môi tốt để hòa tan các chất hữu cơ.
IV. Tính chất hóa học
1. Phản ứng thủy phân
Ry(COO)xyR’x + xyH2O ↔ yR(COOH)x + xR’(OH)y
- Phản ứng thực hiện trong môi trường axit loãng và được đun nóng.
- Muốn tăng hiệu suất của phản ứng thủy phân este phải dùng dư nước và sử dụng chất xúc tác axit, đun nóng hỗn hợp phản ứng.
- Nếu ancol sinh ra không bền thì phản ứng xảy ra theo một chiều.
2. Phản ứng thủy phân trong môi trường kiềm (phản ứng xà phòng hóa)
Ry(COO)xyR’x + xyNaOH → yR(COONa)x + xR’(OH)y
- mchất rắn sau phản ứng = mmuối + mkiềm dư.
- Với este đơn chức: neste phản ứng = nNaOHphản ứng = nmuối = nancol.
3. Phản ứng khử este bởi LiAlH4 tạo hỗn hợp ancol
4. Một số phản ứng riêng
- Este của ancol không bền khi thủy phân hoặc xà phòng hóa không thu được ancol:
RCOOCH=CH2 + H2O → RCOOH + CH3CHO
- Este của phenol phản ứng tạo ra hai muối và nước:
RCOOC6H5 + 2NaOH → RCOONa + C6H5ONa + H2O
- Este của axit fomic (HCOO)xR có khả năng tham gia phản ứng tráng gương.
(HCOO)xR + 2xAgNO3 + 3xNH3 + xH2O → (NH4CO3)xR + 2xAg + 2xNH4NO3
- Nếu este có gốc axit hoặc gốc Ancol không no thì este đó còn tham gia được phản ứng cộng, phản ứng trùng hợp và phản ứng oxi hóa không hoàn toàn.
CH2=CH-COOCH3 + Br2 → CH2Br-CHBr-COOCH3
nCH2=C(CH3)COOCH3 → (-CH2-C(CH3)(COOCH3)-)n
(Poli(MetylMetacrylat) - Plexiglass - thủy tinh hữu cơ)
nCH3COOCH=CH2 → (-CH2-CH(OOCCH3)-)n
(poli(vinyl axetat) - PVA)
V. Điều chế
1. Thực hiện phản ứng este hóa giữa ancol và axit
yR(COOH)x + xR’(OH)y ↔ Ry(COO)xyR’x + xyH2O (H+, t0)
2. Thực hiện phản ứng cộng giữa axit và hiđrocacbon không no
RCOOH + C2H2 → RCOOCH = CH2
3. Thực hiện phản ứng giữa muối Na của axit và dẫn xuất halogen
RCOONa + R’X → RCOOR’ + NaX (xt, t0)
4. Thực hiện phản ứng giữa phenol và anhidrit axit
(RCO)2O + C6H5OH → RCOOC6H5 + RCOOH
VI. Nhận biết este
- Este của axit fomic có khả năng tráng gương.
- Các este của ancol không bền bị thủy phân tạo anđehit có khả năng tráng gương.
- Este không no có phản ứng làm mất màu dung dịch Brom
- Este của glixerol hoặc chất béo khi thủy phân cho sản phẩm hòa tan Cu(OH)2.
C. Các dạng bài tập về tính chất hóa học của Este
Câu 1. Số este đơn chức có chung công thức phân tử C5H10O2 là:
9 este.
7 este.
8 este.
10 este
Đáp án
HCOOC4H9 4đp
CH3COOC3H7 2đp
C2H5COOC2H5 1đp
C3H7COOCH3 2đp
Câu 2. Thủy phân vinyl axetat trong dung dịch NaOH thu được:
axit axetic và ancol vinylic
natri axetat và ancol vinylic
natri axetat và anđehit axetic
axit axetic và anđehit axetic
Đáp án
CH3COOCH=CH2 + NaOH → CH3COONa + CH3-CH=O
Câu 3. Cho các este: C6H5OCOCH3 (1); CH3COOCH=CH2 (2); CH2=CH-COOCH3 (3); CH3-CH=CH-OCOCH3 (4); (CH3COO)2CH-CH3 (5)
Những este nào khi thủy phân không tạo ra ancol?
1 , 2 , 4 , 5
1 , 2 , 4
1 , 2 , 3
1 , 2 , 3 , 4 , 5
Đáp án
1. CH3COOC6H5+ H2O → CH3COOH + C6H5OH (phenol)
2. CH3COOCH=CH2+ H2O → CH3COOH + CH3CHO (andehit)
3. CH2=CH−COOCH3+ H2O ⇌ CH2=CH−COOH + CH3OH (ancol)
4. CH3COO−CH=CH−CH3+ H2O→CH3COOH + CH3−CH2−CHO
5. (CH3COO)2CH-CH3+ 2H2O → 2CH3COOH + CH3CHO + H2O (andehit)
Câu 4. Este X mạch hở có công thức phân tử C5H8O2, được tạo bởi một axit Y và một ancol Z. Vậy Y không thể là:
C3H5COOH.
CH3COOH.
HCOOH.
C2H5COOH.
Đáp án
Do trong X có số liên kết pi là 2, 1 trong COO, 1 trong gốc hidrocacbon, có thể có 2 trường hợp xảy ra:
+ TH1: ancol no, axit không no ⇒ 4 > Số C trong axit > 2.
+ TH2: ancol không no, axit no ⇒ số C trong ancol > 2 ⇒ Số C trong axit < 3.
⇒ axit không thể là C2H5COOH.
Câu 5. Có thể phân biệt HCOOCH3 và CH3COOC2H5 bằng:
CaCO3.
AgNO3.
H2O.
Dung dịch Br2.
Đáp án
Do HCOOCH3 có nhóm CHO nên có khả năng phản ứng tráng bạc, điều mà CH3COOC2H5 không có.
Câu 6. Phát biểu nào sau đây SAI:
Nhiệt độ sôi của este thấp hơn hẳn so với ancol có cùng phân tử khối.
Trong công nghiệp có thể chuyển hóa chất béo lỏng thành chất béo rắn.
Số nguyên tử hidro trong phân tử este đơn và đa chức luôn là một số chẵn.
Sản phẩm của phản ứng xà phòng hóa chất béo là axit béo và glixerol.
Đáp án
Đáp án A đúng vì ancol có liên kết hiđro nên có nhiệt độ sôi cao hơn este có cùng phân tử khối.
Đáp án B đúng. Trong công nghiệp có thể chuyển hóa chất béo lỏng thành chất béo rắn bằng phản ứng hiđro hóa.
Đáp án C đúng. CTC của este là CnH2n + 2 - 2k - 2xO2x nên este đơn chức và đa chức luôn là một số chẵn.
Đáp án D sai. Sản phẩm của phản ứng xà phòng hóa chất béo là xà phòng và glixerol.
Câu 7. Để điều chế este của phenol, ta có thể dùng phản ứng giữa phenol với:
Axit cacboxylic
Anhiđrit axit
Halogenua axit
Anhiđrit axit hoặc halogenua axit
Đáp án
Phenol không thể tác dụng trực tiếp với axit theo phản ứng este hoá
Do đó nếu muốn điều chế este của phenol thì phải cho tác dụng với những chất có khả năng OXH mạnh hơn như là anhiđrit axit hoặc halogenua axit
Câu 8. Cho các nhận định sau:
Chất béo là trieste của glixerol với các axit monocacboxylic có mạch C dài không phân nhánh.
Lipit gồm các chất béo, sáp, steroid, photpholipit,...
Chất béo là chất lỏng
Chất béo chứa các gốc axit không no thường là chất lỏng ở nhiệt độ thường và được gọi là dầu.
Phản ứng thủy phân chất béo trong môi trường kiềm là phản ứng thuận nghịch.
Chất béo là thành phần chính của dầu mỡ động vật, thực vật.
Số nhận định đúng là:
5
2
4
3
Đáp án
1. Sai, vì chất béo là trieste của axit monocacboxylic có số C chẵn từ 12-24, không phân nhánh
3. Sai, vì chất béo no là chất rắn
5. Sai, vì phản ứng thủy phân chất béo trong môi trường kiềm là phản ứng 1 chiều
Vậy có 3 ý đúng.
Câu 9. Etyl axetat có thể phản ứng với chất nào sau đây?
Dung dịch NaOH
Natri kim loại
Dung dịch AgNO3trong nước amoniac
Dung dịch Na2CO3
Đáp án
CH3COOC2H5 + NaOH → CH3COONa + C2H5OH
Câu 10. Cho các phản ứng sau:
1) Thủy phân este trong môi trường axit.
2) Thủy phân este trong dung dịch NaOH, đun nóng.
3) Cho este tác dụng với dung dịch KOH, đun nóng.
4) Thủy phân dẫn xuất halogen trong dung dịch NaOH, đun nóng.
5) Cho axit hữu cơ tác dụng với dung dịch NaOH.
Các phản ứng không được gọi là phản ứng xà phòng hóa là:
1, 2, 3, 4
1, 4, 5
1, 3, 4, 5
3, 4, 5
Đáp án
Phản ứng xà phòng hóa là phản ứng thủy phân este trong môi trường kiềm. ⇒ 1,4,5 không phải phản ứng xà phòng hóa.
Từ khóa » Sơ đồ Este Lipit
-
Sơ đồ Tư Duy Hóa 12 Chương 1 - TopLoigiai
-
Sơ đồ Tư Duy Lipit Lớp 12 Chi Tiết Nhất - Giáo Dục Trung Học Đồng Nai
-
Bài 15. Lý Thuyết Về Este, Lipit - Sơ đồ Tư Duy (Phần 4) - Hocmai
-
Este - Lipit: Sơ đồ Tư Duy Hóa Học! P/s - Facebook
-
Sơ đồ Tư Duy Este Chi Tiết Nhất
-
Sơ Đồ Tư Duy Este Lipit - .vn
-
Top 14 Este Lipit Sơ đồ Tư Duy Este 2022
-
Sơ Đồ Tư Duy Lipit
-
Sơ đồ Tư Duy Hóa 12 Chương 1
-
SƠ ĐỒ TƯ DUY HÓA HỌC HỮU CƠ - ThiênBảo Edu
-
Sơ đồ Tư Duy Hóa Học Lớp 12 - [email protected]
-
Sơ đồ Tư Duy Este Hóa Học 12
-
Sơ đồ Tư Duy Hóa Học Lớp 12?