Sự điện Li Là Gì? Lý Thuyết Và Giải Bài Tập Chi Tiết - Monkey
Có thể bạn quan tâm
Đăng ký nhận tư vấn về sản phẩm và lộ trình học phù hợp cho con ngay hôm nay!
*Vui lòng kiểm tra lại họ tên *Vui lòng kiểm tra lại SĐT *Vui lòng kiểm tra lại Email Học tiếng Anh cơ bản (0-6 tuổi) Nâng cao 4 kỹ năng tiếng Anh (3-11 tuổi) Học Toán theo chương trình GDPT Học Tiếng Việt theo chương trình GDPT *Bạn chưa chọn mục nào! Đăng Ký Ngay X
ĐĂNG KÝ NHẬN TƯ VẤN THÀNH CÔNG!
Monkey sẽ liên hệ ba mẹ để tư vấn trong thời gian sớm nhất! Hoàn thành X
ĐÃ CÓ LỖI XẢY RA!
Ba mẹ vui lòng thử lại nhé! Hoàn thành X Bé học tiếng Anh dễ dàng cùng Monkey Junior Nhận tư vấn về chương trình Hết hạn sau 00 Ngày 00 Giờ 00 Phút 00 Giây *Vui lòng kiểm tra lại họ tên *Vui lòng để lại tuổi *Vui lòng kiểm tra lại SĐT Bạn là phụ huynh hay học sinh ? Học sinh Phụ huynh *Vui lòng chọn vai trò *Bạn chưa chọn mục nào! Nhận tư vấn miễn phí_(1).png) x
x 
Đăng ký nhận bản tin mỗi khi nội dung bài viết này được cập nhật
*Vui lòng kiểm tra lại Email Đăng Ký- Trang chủ
- Ba mẹ cần biết
- Giáo dục
- Kiến thức cơ bản
 Kiến thức cơ bản Sự điện li là gì? Lý thuyết và giải bài tập chi tiết
Kiến thức cơ bản Sự điện li là gì? Lý thuyết và giải bài tập chi tiết .png) Tham vấn bài viết:
Tham vấn bài viết: .png) Hoàng Mỹ Hạnh
Hoàng Mỹ Hạnh Thạc sĩ Ngôn ngữ - Chuyên gia Giáo dục sớm
Tác giả: Đào Vân
Ngày cập nhật: 17/07/2022
Nội dung chínhSự điện li là gì? Chất điện li là gì? Làm thế nào để phân biệt các chất điện li mạnh và điện li yếu? Cùng Monkey tìm hiểu lý thuyết chi tiết và thực hành một số bài tập về sự điện li.

Khái niệm sự điện li là gì? Chất điện li là gì?
Sự điện li (ion hóa) là quá trình phân ly các chất trong nước tạo thành ion âm (anion) và ion dương (cation). Đây là nguyên nhân khiến các dung dịch axit, bazo hay muối có thể dẫn điện được.

Cụ thể hơn, đây là quá trình một nguyên tử hoặc phân tử tích một điện tích âm hoặc dương bằng cách nhận thêm hay mất đi electron để tạo thành các ion. Quá trình này thường đi kèm nhiều thay đổi hóa học khác.
-
Ion dương được tạo thành khi chúng hấp thụ đủ năng lượng (lớn hơn hoặc bằng thế năng tương tác của electron trong nguyên tử) để giải phóng electron (còn được gọi là electron tự do). Năng lượng ion hóa là năng lượng cần thiết để diễn ra quá trình này.
-
Ion âm được tạo thành khi một electron tự do đập vào một nguyên tử mang điện trung hòa, ngay lập tức bị giữ lại và thiết lập hàng rào thế năng với nguyên tử này. Nguyên nhân vì nó không đủ năng lượng để thoát khỏi nguyên tử này nữa, từ đó hình thành ion âm.
Trường hợp điện li đơn giản là chất có liên kết ion hoặc có liên kết cộng hoá trị phân cực bị tách thành các ion riêng biệt trong môi trường nước, điển hình là NaCl.
Chất điện li (chất điện giải, chất điện phân): Là những chất tan trong nước (hoặc nóng chảy) phân li ra ion. Chúng bao gồm: axit, bazo và muối.
Sự điện li được biểu diễn bằng phương trình điện li.
Ví dụ:
NaCl → Na+ + Cl-
NaOH → Na+ + OH-
HCl → H+ + Cl-
Nguyên nhân tính dẫn điện của các dung dịch axit, bazo và muối
Qua thực nghiệm năm 1887, A-rê-ni-ut kết luận rằng: Các dung dịch axit, bazo và muối có khả năng dẫn điện được do trong dung dịch của chúng chứa các tiểu phân mang điện tích chuyển động tự do, còn gọi là các ion (bao gồm anion và cation).
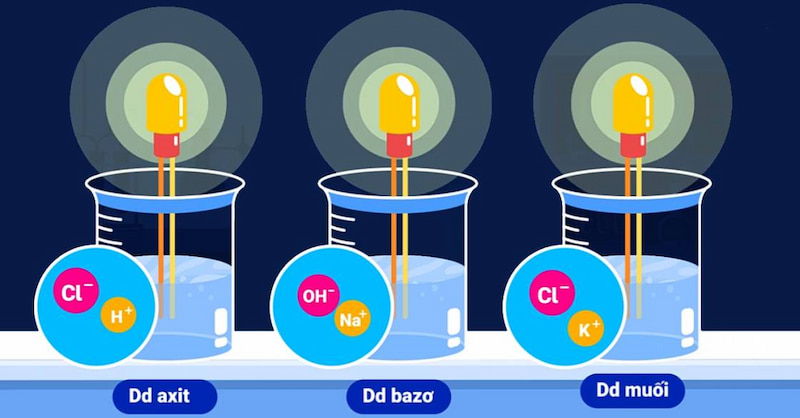
Cụ thể, phân tử nước bị phân cực thành hai đầu âm và dương do nguyên tử oxi có độ âm điện lớn hơn nguyên tử hydro. Do đó, cặp electron chung bị lệch về phía oxi. Vì vậy, khi một chất có liên kết ion hay liên kết cộng hóa trị phân cực hòa tan trong nước thì phân tử của nó sẽ bị bao bọc và tương tác với phân tử nước, tách các chất này ra thành các ion, ion dương (-) tách ra bởi nguyên tử oxi (mang điện âm) và ion âm (-) được tách ra bởi nguyên tử hydro (mang điện dương). Liên kết các nguyên từ bị phá vỡ nên quá trình này có giải phóng năng lượng.
Trong khi đó, các dung dịch như glixerol, đường saccarozo, ancol etylic không thể dẫn điện vì trong dung dịch chúng không phân li ra các ion âm và dương. Nguyên nhân là do trong phân tử có liên kết phân cực nhưng rất yếu.
Phân loại các chất điện li
Để phân loại các chất điện li, người ta làm thí nghiệm sau. Chuẩn bị 2 cốc: HCl 0,10M, và CH3COOH 0,10M, lắp vào dụng cụ như hình. Khi dẫn điện cùng một nguồn vào đầu dây dẫn, bóng đèn ở phía HCl sáng hơn bóng đèn phía dung dịch CH3COOH. Như vậy, ta có thể kết luận: Nồng độ ion trong HCl lớn hơn CH3COOH, nghĩa là số phân từ HCl phân li ra nhiều ion hơn.
Dựa trên thí nghiệm này, người ta chia chất điện li thành 2 loại: Chất điện li mạnh và chất điện li yếu.

Chất điện li mạnh
Khái niệm: Chất điện li mạnh là chất khi tan trong nước, các phân tử hòa tan đều phân li ra ion.
Ví dụ về các chất điện li mạnh:
-
Axit HCl, HNO3, H2SO4,...
-
Bazo mạnh như NaOH, KOH, Ba(OH)2 Ca(OH)2,...
-
Hầu hết các muối của axit mạnh và bazơ mạnh như NaCl, KNO3, KCI, K2SO4,...
Trong phương trình điện li của chất điện li mạnh, người ta sử dụng mũi tên 1 chiều chỉ chiều của quá trình điện li.
Ví dụ về phương trình điện li:
-
NaCl là chất điện li mạnh, nếu trong dung dịch chứa 100 phân tử NaCl hoà tan thì cả 100 phân tử này đều phân li ra ion. NaCl → Na+ + Cl-
-
Trong dung dịch Na2SO4 0,1M, vì sự điện li của Na2SO4 là hoàn toàn nên có thể tính được nồng độ các ion do Na2SO4 phân li lần lượt Na là 0,2M và SO2 là 0,1M. Phương trình phân li: Na2SO4 → 2Na+ +S04(2-)
Chất điện li yếu
Khái niệm: Chất điện li yếu là chất khi tan trong nước chỉ có một phần số phân tử hòa tan phân li ra ion, phần còn lại vẫn tồn tại dưới dạng phân tử trong dung dịch.
Ví dụ về các chất điện li yếu:
-
Các axit yếu như các axit hữu cơ CH3COOH, axit HClO, H2S, HE, HCN H2SO3,...
-
Các bazơ yếu như Bi(OH)3, Mg(OH)2, ...
Trong phương trình điện li của các chất điện li yếu, người ta sử dụng mũi tên 2 chiều.
Ví dụ về phương trình điện li:
CH3COOH ⇌ CH3COO- + H+
Mg(OH)2 ⇌ Mg2+ + 2OH-
Sự điện li của chất điện li yếu là một quá trình thuận nghịch. Cân bằng điện li được thiết lập khi tốc độ phân li ra ion bằng với tốc độ kết hợp các ion thành phân tử. Đây là cân bằng động với hằng số cân bằng K và giống như mọi cân bằng khác, chúng tuân theo nguyên lí chuyển dịch cân bằng LG Sa-tơ-li-ê.
Sự pha loãng có ảnh hưởng gì đến sự điện li? Khi pha loãng dung dịch, các ion (+) và (-) của chất điện li rời xa nhau, ít có điều kiện va chạm để tạo lại phân tử khiến cho độ điện li tăng.
Xem thêm: Phản ứng trao đổi ion: Điều kiện xảy ra phản ứng và viết phương trình ion rút gọn
Bài tập về sự điện li SGK Hóa học 11 kèm lời giải chi tiết
Để giúp bạn đọc nắm chắc các kiến thức về sự điện li, sau đây là một số bài tập cơ bản trong SGK Hóa học 11 kèm lời giải chi tiết.

Giải bài 1 trang 7 SGK Hóa 11
Các dung dịch axit như HCl, bazơ như NaOH và muối như NaCl dẫn điện được, còn các dung dịch như ancol etylic, saccarozơ, glixerol không dẫn điện được là do nguyên nhân gì?
Lời giải:
Trong dung dịch: Các axit, bazơ và muối phân li ra các ion dương và ion âm chuyển động tự do nên dung dịch của chúng có khả năng dẫn điện.
Ví dụ :
HCl → H+ + Cl-
NaOH → Na+ + OH-
NaCl → Na+ + Cl-
Còn các dung dịch như ancol etylic, đường saccarozơ, glixerol không dẫn điện vì trong dung dịch chúng không phân li ra các ion dương và ion âm.
Giải bài 2 SGK Hóa 11 trang 7
Sự điện li, chất điện li là gì? Những loại chất nào là chất điện li? Thế nào là chất điện li mạnh, chất điện li yếu? Lấy thí dụ và viết phương trình điện li của chúng?
Lời giải:
Sự điện li là sự phân li thành các cation (ion dương) và anion (ion âm) của phân tử chất điện li khi tan trong nước.
-
Chất điện li là những chất tan trong nước và tạo thành dung dịch dẫn được điện.
-
Các chất là chất điện li như axit, các bazơ, các muối tan được trong nước.
-
Chất điện li mạnh là những chất khi tan trong nước các phân tử hoà tan đều phân li ra ion.
Ví dụ:
H2SO4 → 2H+ + SO4(2-)
KOH → K+ + OH-
Na2SO4 → 2Na+ + SO42-
Chất điện li yếu là những chất khi tan trong nước chỉ có một phần số phân tử hoà tan phân li ra ion, phần còn lại vẫn tồn tại dưới dạng phân tử trong dung dịch.
Ví dụ: H2S ⇌ H+ + HS-
Giải bài 3 SGK trang 7 Hóa 11
Viết phương trình điện li của những chất sau:
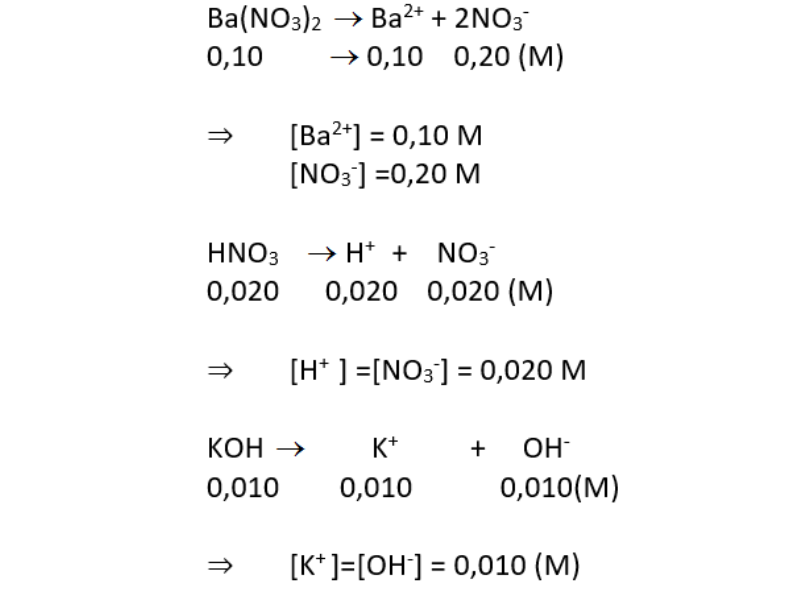
a. Các chất điện li mạnh: Ba(NO3)2 0.10 M; HNO3 0,020 M; KOH 0,010 M. Tính nồng độ mol của từng ion trong dung dịch.
b. Các chất điện li yếu HClO; HNO2.
Lời giải:
a. Các chất điện li mạnh:
b. Các chất điện li yếu: HClO, HNO2
HClO ⇌ H+ + ClO-
HNO2 ⇌ H+ + NO2-
Giải bài 4 trang 7 Hóa 11 SGK
Chọn câu trả lời đúng trong các câu sau đây:
Dung dịch chất điện li dẫn được điện là do:
A. Sự dịch chuyển của các electron.
B. Sự dịch chuyển của các cation.
C. Sự dịch chuyển của các phân tử hoà tan.
D. Sự dịch chuyển của cả cation và anion.
Lời giải: Đáp án D.
Do khi hoà tan (trong nước) các phân tử chất điện li phân li ra thành các cation và anion.
Giải bài 5 Hóa 11 SGK trang 7
Chất nào sau đây không dẫn điện được?
A. KCl rắn, khan.
B. CaCl2 nóng chảy.
C. NaOH nóng chảy.
D. HBr hoà tan trong nước.
Lời giải: Đáp án A.
Do KCl rắn, khan tồn tại dưới dạng mạng tinh thể ion rất bền vững. Vì vậy, chúng không phân li ra được ion dương và ion âm (di chuyển tự do) nên không có khả năng dẫn điện.
Như vậy, bài viết này đã giúp bạn đọc giải đáp các thắc mắc xung quanh sự điện li, bao gồm: Sự điện li là gì, chất điện li là gì, làm thế nào để phân biệt các chất điện li mạnh và điện li yếu cùng một số bài tập thực hành về chủ đề này. Monkey hi vọng những thông tin này sẽ có ích cho bạn. Ấn “NHẬN CẬP NHẬT” để không bỏ lỡ nhiều kiến thức thú vị khác về môn Hóa học mỗi ngày!
Chia sẻ ngaySao chép liên kết
Thông tin trong bài viết được tổng hợp nhằm mục đích tham khảo và có thể thay đổi mà không cần báo trước. Quý khách vui lòng kiểm tra lại qua các kênh chính thức hoặc liên hệ trực tiếp với đơn vị liên quan để nắm bắt tình hình thực tế.
Bài viết liên quan- Tìm hiểu về Cacbon: Khái niệm, tính chất, cách điều chế
- Giải thích hiện tượng nhật thực nguyệt thực vật lý 7 dễ hiểu
- Giải thích công thức tính nhiệt lượng chi tiết nhất cùng bài tập thực hành (Vật Lý 8)
- Etilen (C2H4) là gì? Tính chất, điều chế, ứng dụng & bài tập có đáp án!
- Bán kính hình tròn là gì? Cách tính bán kính dễ hiểu, có ví dụ minh họa
 Giúp bé giỏi Tiếng Anh Sớm Đăng ký ngay tại đây *Vui lòng kiểm tra lại họ tên *Vui lòng kiểm tra lại SĐT *Vui lòng kiểm tra lại Email Đăng ký ngay Nhận các nội dung mới nhất, hữu ích và miễn phí về kiến thức Giáo dục trong email của bạn *Vui lòng kiểm tra lại Email Đăng Ký Các Bài Viết Mới Nhất
Giúp bé giỏi Tiếng Anh Sớm Đăng ký ngay tại đây *Vui lòng kiểm tra lại họ tên *Vui lòng kiểm tra lại SĐT *Vui lòng kiểm tra lại Email Đăng ký ngay Nhận các nội dung mới nhất, hữu ích và miễn phí về kiến thức Giáo dục trong email của bạn *Vui lòng kiểm tra lại Email Đăng Ký Các Bài Viết Mới Nhất  Công thức tính chu vi hình tròn (Ví dụ minh họa dễ hiểu)
Công thức tính chu vi hình tròn (Ví dụ minh họa dễ hiểu)  Công thức tính chu vi hình tứ giác + ví dụ, bài tập có lời giải dễ hiểu
Công thức tính chu vi hình tứ giác + ví dụ, bài tập có lời giải dễ hiểu  Lực đẩy Ác-si-mét là gì? Công thức và ví dụ dễ hiểu (Vật lý 8)
Lực đẩy Ác-si-mét là gì? Công thức và ví dụ dễ hiểu (Vật lý 8)  Tired đi với giới từ gì? Hướng dẫn cách dùng OF, WITH, FROM + ví dụ chi tiết
Tired đi với giới từ gì? Hướng dẫn cách dùng OF, WITH, FROM + ví dụ chi tiết  Discuss đi với giới từ gì? Cách dùng discuss & discussion chuẩn ngữ pháp
Discuss đi với giới từ gì? Cách dùng discuss & discussion chuẩn ngữ pháp  Công thức tính chu vi hình tròn (Ví dụ minh họa dễ hiểu)
Công thức tính chu vi hình tròn (Ví dụ minh họa dễ hiểu)  Công thức tính chu vi hình tứ giác + ví dụ, bài tập có lời giải dễ hiểu
Công thức tính chu vi hình tứ giác + ví dụ, bài tập có lời giải dễ hiểu  Lực đẩy Ác-si-mét là gì? Công thức và ví dụ dễ hiểu (Vật lý 8)
Lực đẩy Ác-si-mét là gì? Công thức và ví dụ dễ hiểu (Vật lý 8)  Tired đi với giới từ gì? Hướng dẫn cách dùng OF, WITH, FROM + ví dụ chi tiết
Tired đi với giới từ gì? Hướng dẫn cách dùng OF, WITH, FROM + ví dụ chi tiết  Discuss đi với giới từ gì? Cách dùng discuss & discussion chuẩn ngữ pháp
Discuss đi với giới từ gì? Cách dùng discuss & discussion chuẩn ngữ pháp .png)
Đăng ký tư vấn nhận ưu đãi
Monkey Junior
Mới! *Vui lòng kiểm tra lại họ tên *Vui lòng kiểm tra lại SĐT Bạn là phụ huynh hay học sinh ? Học sinh Phụ huynh *Bạn chưa chọn mục nào! Đăng Ký Mua Monkey JuniorTừ khóa » Chất điện Li Yếu Nhất
-
Chất Nào Sau đây Là Chất điện Li Yếu
-
Lý Thuyết Sự điện Li - Thầy Dũng Hóa
-
Điện Li – Wikipedia Tiếng Việt
-
Các Chất điện Li Yếu đầy đủ Nhất - Top Tài Liệu
-
Sự điện Li Là Gì? Phân Loại Chất điện Li Mạnh Và Chất điện Li Yếu
-
[ĐÚNG NHẤT] Chất điện Li Yếu Có độ điện Li Là Bao Nhiêu?
-
Các Dạng Bài Tập Hoá 11 Chương Sự Điện Li Cần Nắm Vững
-
Các Chất Điện Li Yếu - Sự Điện Li, Hóa Học Phổ Thông
-
Nacl Là Chất điện Li Mạnh Hay Yếu Và Tại Sao ?
-
Đây Chất Nào Sau đây Là Chất điện Li Yếu - Bí Quyết Xây Nhà
-
Tổng Hợp Sự điện Li: Phân Loại Chất điện Li Mạnh, Chất điện Li Yếu
-
Phân Biệt Chất điện Li Mạnh Và Yếu - ThiênBảo Edu
-
Các Chất điện Li Mạnh, Chất điện Li Yếu, định Nghĩa, Khái Niệm