Sự điện Li Là Gì, Phân Loại Chất điện Ly Mạnh Và Chất điện Li Yếu
Có thể bạn quan tâm
Vậy sự điện li diễn ra như thế nào, chất điện li là gì? làm thế nào để phân biệt và xác định được chất điện li mạnh và chất điện li yếu? chúng ta cùng tìm hiểu qua bài viết dưới đây.
I. Sự điện li là gì?
1. Khái niệm sự điện li
- Định nghĩa: Sự điện li là quá trình phân li các chất trong nước ra ion. Những chất khi tan trong nước phân li ra ion được gọi là chất điện li.
- Chất điện li gồm có: axit, bazo và muối.
- A-rê-ni-ut qua thực nghiệm xác nhận rằng: Các dung dịch axit, bazo, muối dẫn điện được do trong dung dịch của chúng có các tiểu phân mang điện tích chuyển động tự do được gọi gọi là các ion. (ion gồm có ion âm hay còn gọi là anion, và ion dương gọi là cation).
- Còn các dung dịch như ancol etylic, đường saccarazơ, glixerol không dẫn điện vì trong dung dịch chúng không phân li ra các ion dương và ion âm.

2. Quá trình điện li diễn ra thế nào?
a) Cơ chế của quá trình điện li:
- Quá trình điện li xảy ra khi có sự tương tác giữa phân tử nước và phân tử các chất điện li dẫn đến sự phân li của các chất này trong nước.
- Phân tử H2O là phân tử có cực, liên kết O–H trong H2O là liên kết cộng hóa trị phân cực, cặp e dùng chung lệch về phía oxi, nên ở oxi có dư điện tích âm, còn ở hidro có dư điện tích dương.
- Khi hòa tan chất điện li vào nước, chất điện li có thể là hợp chất ion (ví dụ NaCl) hoặc hợp chất cộng hóa trị có cực, sẽ xảy ra sự tương tác giữa các phân tử nước với các phân tử chất điện li, phần mang điện tích âm (anion) của phân tử chất điện li sẽ hút phần mang điện tích dương của phân tử nước, ngược lại, phần mang điện tích dương (cation) sẽ hút phần mang điện tích âm của phân tử H2O. Quá trình tương tác này kết hợp với sự chuyển động không ngừng của các phân tử nước dẫn đến sự điện li các phân tử chất điện li thành các ion mang điện tích (+) và (-) trong nước.
- Các hợp chất ancol etylic, glixerol,... không phải là chất điện li do trong phân tử có liên kết phân cực nhưng rất yếu, nên dưới tác dụng của các phân tử nước chúng không thể phân li ra ion được.
b) Biểu diễn sự điện li
- Sự điện li được biểu diễn bằng phương trình điện li, ví dụ:
NaCl → Na+ + Cl-
HCl → H+ + Cl-
NaOH → Na+ + OH-
CH3COOH 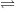 CH3COO- + H+
CH3COO- + H+
II. Cách phân loại và xác định chất điện li mạnh, chất điện li yếu
1. Cách xác định chất điện li mạnh
- Chất điện li mạnh là chất khi tan trong nước, các phân tử hòa tan đều phân li ra ion.
- Chất điện li mạnh bao gồm: các axit mạnh HCl, HNO3, H2SO4,... các bazo mạnh như NaOH, KOH, Ba(OH)2, Ca(OH)2,... và hầu hết các muối của axit mạnh và bazơ mạnh như NaCl, KNO3, KCl, K2SO4,...
- Phương trình điện li của chất điện li mạnh: dùng dấu mũi tên 1 chiều chỉ chiều của quá trình điện li.
- Ví dụ 1: NaCl là chất điện li mạnh, nếu trong dung dịch có 100 phân tử NaCl hoà tan thì cả 100 phân tử đều phân li ra ion, ví dụ: NaCl → Na+ + Cl-
- Ví dụ 2: Trong dung dịch Na2SO4 0,1M, vì sự điện li của Na2SO4 là hoàn toàn nên dễ dàng tính được nồng độ các ion do Na2SO4 phân li ra tương ứng Na+ là 0,2M và SO42- là 0,1M theo phương trình phân li sau: Na2SO4 → 2Na+ + SO42-
2. Cách xác định chất điện li yếu
- Chất điện li yếu là chất khi tan trong nước chỉ có một phần số phân tử hòa tan phân li ra ion, phần còn lại vẫn tồn tại dưới dạng phân tử trong dung dịch.
- Chất điện li yếu gồm các axit yếu như các axit hữu cơ CH3COOH, axit HClO, H2S, HF, HCN H2SO3,... và các bazo yếu như NH3 các Amin R-NH2, Bi(OH)3, Mg(OH)2,...
- Phương trình điện li của các chất điện li yếu: dùng dấu mũi tên 2 chiều
CH3COOH 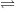 CH3COO- + H+
CH3COO- + H+
Mg(OH)2 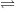 Mg2+ + 2OH-
Mg2+ + 2OH-
- Sự điện li của chất điện li yếu là quá trình thuận nghịch. Cân bằng điện li được thiết lập khi tốc độ phân li ra ion và tốc độ kết hợp các ion thành phân tử là bằng nhau. Cân bằng điện li là cân bằng động, cũng có hằng số cân bằng K và tuân theo nguyên lí chuyển dịch cân bằng Lơ Sa-tơ-li-ê, giống như mọi cân bằng hóa học khác.
- Ảnh hưởng của sự pha loãng đến sự điện li: Khi pha loãng dung dịch, độ điện li của các chất điện li đều tăng. Do sự pha loãng khiến cho các ion (+) và (-) của chất điện li rời xa nhau hơn, ít có điều kiện va chạm vào nhau để tạo lại phân tử, đồng thời sự pha loãng không làm cản trở đến sự điện li của các phân tử.
III. Bài tập vận dụng sự điện li
* Bài 1 trang 7 sgk hoá 11: Các dung dịch axit như HCl, bazơ như NaOH và muối như NaCl dẫn điện được, còn các dung dịch như ancol etylic, saccarozơ, glixerol không dẫn điện được là do nguyên nhân gì?
>> Lời giải bài 1 trang 7 sgk hoá 11
* Bài 2 trang 7 sgk hoá 11: Sự điện li, chất điện li là gì? Những loại chất nào là chất điện li? Thế nào là chất điện li mạnh, chất điện li yếu? Lấy thí dụ và viết phương trình điện li của chúng?
>> Lời giải bài 2 trang 7 sgk hoá 11
* Bài 3 trang 7 sgk hóa 11: Viết phương trình điện li của những chất sau:
a.) Các chất điện li mạnh: Ba(NO3)2 0.10 M; HNO3 0,020 M; KOH 0,010 M. Tính nồng độ mol của từng ion trong dung dịch.
b) Các chất điện li yếu HClO; HNO2.
>> Lời giải bài 3 trang 7 sgk hoá 11
* Bài 4 trang 7 sgk hóa 11: Chọn câu trả lới đúng trong các câu sau đây. Dung dịch chất điện li dẫn được điện là do:
A. Sự dịch chuyển của các electron.
B. Sự dịch chuyển của các cation.
C. Sự dịch chuyển của các phân tử hoà tan.
D. Sự dịch chuyển của cả cation và anion.
>> Lời giải bài 4 trang 7 sgk hoá 11
Từ khóa » Chất điện Li Yếu Gồm Các Chất Nào
-
Sự điện Li Là Gì? Lý Thuyết Và Giải Bài Tập Chi Tiết - Monkey
-
Chất Nào Sau đây Là Chất điện Li Yếu
-
Tổng Hợp Sự điện Li: Phân Loại Chất điện Li Mạnh, Chất điện Li Yếu
-
Điện Li – Wikipedia Tiếng Việt
-
[LỜI GIẢI] Dãy Gồm Các Chất điện Li Yếu Là - Tự Học 365
-
Các Dạng Bài Tập Hoá 11 Chương Sự Điện Li Cần Nắm Vững
-
Các Chất Điện Li Yếu - Sự Điện Li, Hóa Học Phổ Thông
-
Các Chất điện Li Yếu Là Những Chất Nào? - HOC247
-
KHÁI NIỆM VỀ CHẤT ĐIỆN LI, SỰ ĐIỆN LI. PHÂN LOẠI CHẤT ĐIỆN ...
-
Những Chất Điện Li Yếu - Sự Điện Li, Hóa Học Phổ Thông
-
Bài 1: Sự điện Li
-
Top 15 Chất Nào Có điện Li Yếu
-
Sự điện Li: Phân Loại Chất điện Li Mạnh, Chất điện Li Yếu - Hóa 11 Bài 1
-
Trong Dãy Các Chất Sau, Dãy Nào đều Gồm Các Chất điện Li Mạnh