Tính C% Của 1 Dung Dịch H2SO4 Nếu Biết Rằng Khi Cho 1 Lượng ...
Có thể bạn quan tâm
HOC24
Lớp học Học bài Hỏi bài Giải bài tập Đề thi ĐGNL Tin tức Cuộc thi vui Khen thưởng- Tìm kiếm câu trả lời Tìm kiếm câu trả lời cho câu hỏi của bạn
Lớp học
- Lớp 12
- Lớp 11
- Lớp 10
- Lớp 9
- Lớp 8
- Lớp 7
- Lớp 6
- Lớp 5
- Lớp 4
- Lớp 3
- Lớp 2
- Lớp 1
Môn học
- Toán
- Vật lý
- Hóa học
- Sinh học
- Ngữ văn
- Tiếng anh
- Lịch sử
- Địa lý
- Tin học
- Công nghệ
- Giáo dục công dân
- Tiếng anh thí điểm
- Đạo đức
- Tự nhiên và xã hội
- Khoa học
- Lịch sử và Địa lý
- Tiếng việt
- Khoa học tự nhiên
- Hoạt động trải nghiệm
- Hoạt động trải nghiệm, hướng nghiệp
- Giáo dục kinh tế và pháp luật
Chủ đề / Chương
Bài học
HOC24
 Khách vãng lai Đăng nhập Đăng ký Khám phá Hỏi đáp Đề thi Tin tức Cuộc thi vui Khen thưởng
Khách vãng lai Đăng nhập Đăng ký Khám phá Hỏi đáp Đề thi Tin tức Cuộc thi vui Khen thưởng - Tất cả
- Toán
- Vật lý
- Hóa học
- Sinh học
- Ngữ văn
- Tiếng anh
- Lịch sử
- Địa lý
- Tin học
- Công nghệ
- Giáo dục công dân
- Tiếng anh thí điểm
- Hoạt động trải nghiệm, hướng nghiệp
- Giáo dục kinh tế và pháp luật
Câu hỏi
Hủy Xác nhận phù hợp Chọn lớp Tất cả Lớp 12 Lớp 11 Lớp 10 Lớp 9 Lớp 8 Lớp 7 Lớp 6 Lớp 5 Lớp 4 Lớp 3 Lớp 2 Lớp 1 Môn học Toán Vật lý Hóa học Sinh học Ngữ văn Tiếng anh Lịch sử Địa lý Tin học Công nghệ Giáo dục công dân Tiếng anh thí điểm Đạo đức Tự nhiên và xã hội Khoa học Lịch sử và Địa lý Tiếng việt Khoa học tự nhiên Hoạt động trải nghiệm Hoạt động trải nghiệm, hướng nghiệp Giáo dục kinh tế và pháp luật Mới nhất Mới nhất Chưa trả lời Câu hỏi hay
- Hồ Trung Hợp
Tính C% của 1 dung dịch H2SO4 nếu biếu rằng khi cho 1 lượng dung dịch này tác dụng với lượng dư hỗn hợp Na- Mg thì lượng H2 thoát ra bằng 4,5% khối lượng dung dịch axit đã dùng.
Xem chi tiết Lớp 9 Toán Câu hỏi của OLM 1 0 Gửi Hủy
Gửi Hủy  Nguyễn Viết Ngọc
Nguyễn Viết Ngọc  28 tháng 8 2019 lúc 15:12
28 tháng 8 2019 lúc 15:12 Gọi m dung dịch = 100 g
=> m khí bay ra = 4,5 g
2Na + H2SO4 -> Na2SO4 + H2Mg + H2SO4->MgSo4 + H22Na + 2H2O->2NaOh + h22NaOH + MgSo4 -> Na2SO4 + Mg(OH)2
Theo PT 1,2 : n H2 = n H2SO4 = a mol
PT 3: n H2 =0,5 n H2O=0,5b
-> tổng n H2 =a + 0,5 b=2,25 (*)
mà m dung dịch =100 g-> 98 a + 18b =100 (*')
giải hệ pt a=19/62
-> m H2SO4 = ...
-> C% =30,03%
Đúng 2 Bình luận (0) Gửi Hủy
Gửi Hủy 
- Mina Trần
Tính nồng độ phần trăm của dung dịch H2SO4 nếu biết rằng khi cho 1 lượng dung dịch này tác dụng với một lượng dư hỗn hợp Na và Mg thì lượng H2 thoát ra bằng 4,5% khối lượng dung dịch axit đã dùng.
Xem chi tiết Lớp 9 Hóa học Chương I. Các loại hợp chất vô cơ 0 0 Gửi Hủy
Gửi Hủy 
- Đỗ Hà Phương
Câu 15: tính C% của 50ml dung dịch HCl 0,5M (biết d=1,05 g/ml)
Câu 16: Tính CM của 200g dung dịch H2SO4 9,8% (biết d=1,6 g/ml)
Câu 17: tính C% của dung dịch H2SO4 nếu bt khi cho 1 lượng dung dịch này tác dụng với lượng dư hỗn hợp Na, Mg thì lượng H2 thoát ra bằng 4,5% khối lượng dd axit đã dùng
Giúp mình với nha mn
Xem chi tiết Lớp 8 Hóa học Bài 42: Nồng độ dung dịch 0 0 Gửi Hủy
Gửi Hủy 
- Nguyễn Văn Thố
Ai cho mk biết vì sao trong trường hợp này Na lại dư ko: Tính C% của một dung dịch H2SO4 nếu biết rằng khi cho một lượng dung dịch tác dụng với lượng DƯ hỗn hợp Na-Mg thì lượng H2 thoát ra bằng 4.5% lượng dung dịch Axit đã dùng.
Xem chi tiết Lớp 8 Hóa học CHƯƠNG I: CHẤT - NGUYÊN TỬ - PHÂN TỬ 0 0 Gửi Hủy
Gửi Hủy 
- Khánh Thi
Tính C% của 1 dung dịch H2SO4 nếu biết rằng khi cho 1 lượng dung dịch này tác dụng với lượng dư hỗn hợp Na-Mg thì lượng H2 thoát ra = 4,5 % dung lượng dịch axit đã dùng
Xem chi tiết Lớp 8 Hóa học CHƯƠNG I: CHẤT - NGUYÊN TỬ - PHÂN TỬ 2 0 Gửi Hủy
Gửi Hủy  Linh Phương
Linh Phương  8 tháng 6 2017 lúc 15:34
8 tháng 6 2017 lúc 15:34 Coi lượng dung dịch axit đã dung = 100g thì lượng H2 thoát ra = 4,5g
+ 2Na + H2SO4 \(\Rightarrow\) Na2SO4 + H2
+ Mg + H2SO4 \(\Rightarrow\) MgSO4 + H2
+ 2Na + H2O \(\Rightarrow\)NaOH + H2
Theo PTPƯ lượng H2 = lượng H của H2SO4 + 1/2 lượng H của H2O
Do đó, nếu coi lượng axit = x g , ta có:
x / 98 . 2 + 100 - x / 18 = 4,5
\(\Rightarrow\) x = 30
Đúng 0 Bình luận (0) Gửi Hủy
Gửi Hủy  Nguyễn Sỹ Tài 7 tháng 10 2017 lúc 19:26
Nguyễn Sỹ Tài 7 tháng 10 2017 lúc 19:26 Giả sử khối lượng dung dịch =100 g -> khối lượng khí bay ra=4,5 g
PTPƯ : 2Na + H2SO4 -> Na2SO4 + H2 Mg + H2SO4->MgSo4 + H2 2Na + 2H2O->2NaOh + H2 2NaOH + MgSo4->Na2SO4 + Mg(OH)2 theo PT 1,2 : n H2 = n H2SO4 =a mol PT 3: n H2 =0,5 n H2O=0,5b -> tổng n H2 =a + 0,5 b=2,25 (mol) mà m dung dịch =100 g-> 98 a + 18b =100 (g) giải hệ pt
=> a= 0,3 b= 3,9 => m H2SO4 = 29,4 => C% =30,03%
Đúng 0 Bình luận (0) Gửi Hủy
Gửi Hủy 
- 8C Quyền
Bài 21. Cho 7,8 gam hỗn hợp Mg và Al tác dụng với 500 ml dung dịch H2SO4 1M
a. Chứng minh rằng sau phản ứng với Mg và Al , axit vẫn còn dư ?
b. Nếu phản ứng trên làm thoát ra 4,368 lít khí H2 (đktc) . Hãy tính % về khối lượng của Mg và Al đã dùng ban đầu ?
Xem chi tiết Lớp 8 Hóa học 1 0
 Gửi Hủy
Gửi Hủy  nguyễn thị hương giang
nguyễn thị hương giang  7 tháng 4 2022 lúc 20:53
7 tháng 4 2022 lúc 20:53 \(n_{H_2SO_4}=0,5\cdot1=0,5mol\)
\(Mg+H_2SO_4\rightarrow MgSO_4+H_2\)
x x x x
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
y 1,5y 0,5y 1,5y
\(\Rightarrow\left\{{}\begin{matrix}24x+27y=7,8\\x+1,5y=0,5\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=-\dfrac{1}{2}\left(n_oâm\right)\\y=\dfrac{7}{15}\end{matrix}\right.\)
Em kiểm tra lại đề nha!!!
Đúng 1 Bình luận (1) Gửi Hủy
Gửi Hủy 
- Nguyễn Kiều Anh
Cho 1 lượng hỗn hợp Mg, Al tác dụng với dung dịch HCl dư thu được 10,08l khí H2 (đktc). Mặt khác. cũng lượng hỗn hợp trên tác dụng với dung dịch NaOH dư thì thu được 6,72l H2 (đktc). Tính khối lượng của mỗi kim loại trong hỗn hợp ban đầu đã dùng.
Xem chi tiết Lớp 12 Hóa học 1 0 Gửi Hủy
Gửi Hủy  ๖ۣۜDũ๖ۣۜN๖ۣۜG
๖ۣۜDũ๖ۣۜN๖ۣۜG  17 tháng 4 2022 lúc 16:09
17 tháng 4 2022 lúc 16:09 - Xét TN2:
\(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH: 2Al + 2NaOH + 2H2O --> 2NaAlO2 + 3H2
0,2<--------------------------------0,3
=> mAl = 0,2.27 = 5,4 (g)
- Xét TN1:
\(n_{H_2}=\dfrac{10,08}{22,4}=0,45\left(mol\right)\)
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
0,2------------------->0,3
Mg + 2HCl --> MgCl2 + H2
0,15<------------------0,15
=> mMg = 0,15.24 = 3,6 (g)
Đúng 2 Bình luận (0) Gửi Hủy
Gửi Hủy 
- Nguyễn Hoàng Nam
Cho một lượng hỗn hợp Mg – Al tác dụng với dung dịch HCl dư thu được 8,96 lít H2. Mặt khác, cho lượng hỗn hợp như trên tác dụng với dung dịch NaOH dư thì thu được 6,72 lít H2. Các thể tích khí đều đo ở đktc.
Tính khối lượng của mỗi kim loại có trong lượng hỗn hợp đã dùng.
Xem chi tiết Lớp 12 Hóa học 1 0 Gửi Hủy
Gửi Hủy  Ngô Quang Sinh
Ngô Quang Sinh  4 tháng 1 2017 lúc 10:23
4 tháng 1 2017 lúc 10:23 Gọi x, y (mol) lần lượt là số mol Mg, Al trong hỗn hợp.
Phương trình phản ứng:
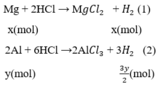
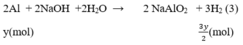
Số mol H2
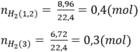
Theo bài ra ta có hệ phương trình:
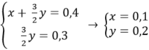
mMg = 24.0,1 = 2,4(g)
mAl = 27.0,2 = 5,4(g)
Đúng 0 Bình luận (0) Gửi Hủy
Gửi Hủy 
- Hiền Hòa
1.Cho 200g dung dịch H 2 SO 4 14,7% tác dụng với Al dư . Tính khối lượng muốiAl 2 (SO4)3 thu được?
2.Cho 10g hỗn hợp gồm Mg và Cu tác dụng với dung dịch HCl dư, thoát ra 3,36 lítkhí H2 ở điều kiện chuẩn. Tính % khối lượng Mg và Cu trong hỗn hợp?
Xem chi tiết Lớp 9 Hóa học Chương I. Các loại hợp chất vô cơ 2 0 Gửi Hủy
Gửi Hủy  Nguyễn Trần Thành Đạt
Nguyễn Trần Thành Đạt  30 tháng 9 2021 lúc 14:58
30 tháng 9 2021 lúc 14:58 Bài 1:
\(n_{H_2SO_4}=\dfrac{200.14,7\%}{98}=0,3\left(mol\right)\\ 2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\\ n_{Al_2\left(SO_4\right)_3}=\dfrac{1}{3}.0,3=0,1\left(mol\right)\\ m_{Al_2\left(SO_4\right)_3}=342.0,1=34,2\left(g\right)\)
Đúng 1 Bình luận (0) Gửi Hủy
Gửi Hủy  Nguyễn Trần Thành Đạt
Nguyễn Trần Thành Đạt  30 tháng 9 2021 lúc 15:00
30 tháng 9 2021 lúc 15:00 Bài 2:
\(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\\ Mg+2HCl\rightarrow MgCl_2+H_2\\ n_{Mg}=n_{H_2}=0,15\left(mol\right)\\ \Rightarrow m_{Mg}=0,15.24=3,6\left(g\right)\\ \%m_{Mg}=\dfrac{3,6}{10}.100=36\%\\ \%m_{Cu}=100\%-36\%=64\%\)
Đúng 1 Bình luận (0) Gửi Hủy
Gửi Hủy 
- Chàng trai cao lãnh
Khử hoàn toàn 28 gam hỗn hợp gồm CuO và một oxit của sắt bằng khí H2 dư ở nhiệt độ cao. Sau phản ứng thu được hỗn hợp ở chất rắn, cho hỗn hợp rắn này tác dụng hoàn toàn với axit H2SO4 loãng thấy thoát ra 3,36 lít khí H2 (ở đkct) và 12,8 gam chất rắn.a. tìm công thức oxit của sắtb. tìm thành phần phần trăm theo khối lượng của mỗi oxit trong hỗn hợp ban đầu.c. hòa tan 28 gam hỗn hợp trên và dung dịch HCl 8%. Tính khối lượng dung dịch HCl cần dùng, biết rằng người ta đã dùng axit dư 15% so với lý thuyết.
Xem chi tiết Lớp 8 Toán Câu hỏi của OLM 0 0 Gửi Hủy
Gửi Hủy Từ khóa » Tính C Phần Trăm Dung Dịch H2so4
-
Tính C% Của Dd H2SO4 đã Dùng
-
Tính C% Dung Dịch H2SO4 đã Dùng - Nguyễn Thị An
-
Tính Nồng độ Phần Trăm Của Dung Dịch H2 SO4 6,95M D= 1,39 Ml
-
Tính Nồng độ Phần Trăm Của Một Dung Dịch H2SO4 Loãng Nếu Biết ...
-
Tính Nồng độ Phần Trăm Của Dung Dịch H2SO4 2M - Blog Của Thư
-
Cho 14g Dung Dịch H2SO4 20% Tác Dụng Với 400g Dung Dịch BaCl2 ...
-
Có 2 Dung Dịch H2SO4 Là A Và B. Nếu 2 Dung Dịch A Và B được Trộn
-
Hoà Tan 1,6g CuO Trong 200g Dd H2SO4 4,9%. Tính Nồng độ Phần ...
-
Tính C% Của 1 Dung Dịch H2SO4 Nếu Biết Rằng Khi Cho Một Lượng ...
-
Công Thức Tính Nồng độ Phần Trăm (C%): Bài Tập + Lời Giải
-
Tính Nồng độ Phần Trăm Của Dung Dịch H2SO4 Sau Khi Pha Loãng
-
Cho 150g Dung Dich H2so4 14% Tính Khối Lượng Của H2so4 - Olm
-
Tính Nồng độ Mol Của Dung Dịch H2SO4 - Vietjack.online
-
Tính Nồng độ Phần Trăm Của Một Dung Dịch H2SO4 Loãng Nếu ...