Tính Chất Hóa Học Của Amin - điều Chế, ứng Dụng, Cách Nhận Biết ...
Có thể bạn quan tâm
Tính chất hóa học, vật lí của Amin | Tính chất hóa học, tính chất vật lí, điều chế, ứng dụng
I. Định nghĩa
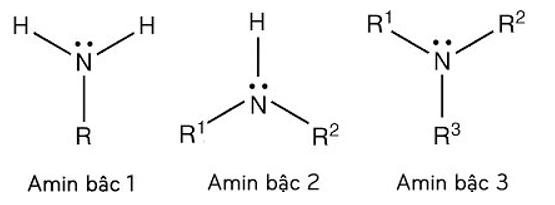
- Định nghĩa: Amin là sản phẩm thu được khi thay thế một hay nhiều nguyên tử hiđro trong phân tử NH3 bằng một hay nhiều gốc hiđrocacbon.
- Công thức tổng quát: CxHyNz hoặc CnH2n+2-2k+tNt
Tên gọi:
+ Tên thay thế: Tên hiđrocacbon + vị trí + amin
Ví dụ: CH3NH2 (Metanamin)
+ Tên gốc chức: Tên gốc hiđrocacbon + amin
Ví dụ: CH3NH2 (Metylamin)
+ Tên thường
II. Tính chất hóa học
1. Tính Bazơ :
Do nguyên tử N trong phân tử amin còn cặp e chưa sử dụng có khả năng nhận proton.
* So sánh tính bazơ của các amin:
+ Nếu nguyên tử N trong phân tử amin được gắn với gốc đẩy e (gốc no: ankyl) thì tính bazơ của amin mạnh hơn so với tính bazơ của NH3. Những amin này làm cho quỳ tím chuyển thành màu xanh.
+ Nếu nguyên tử N trong phân tử amin gắn với các gốc hút e (gốc không no, gốc thơm) thì tính bazơ của amin yếu hơn so với tính bazơ của NH3. Những amin này không làm xanh quỳ tím.
+ Amin có càng nhiều gốc đẩy e thì tính bazơ càng mạnh, amin có càng nhiều gốc hút e thì tính bazơ càng yếu.
⇒ Lực bazơ: CnH2n + 1NH2 > HNH2 > C6H5NH2
2. Phản ứng với axit nitrơ HNO2 :
- Amin bậc một tác dụng với axit nitrơ ở nhiệt độ thường cho ancol hoặc phenol và giải phóng nitơ.
C2H5NH2 + HONO → C2H5OH + N2↑ + H2O
- Anilin và các amin thơm bậc một tác dụng với axit nitrơ ở nhiệt độ thấp (0 - 5°C) cho muối điazoni:
C6H5NH2 + HONO + HCl → C6H5N2+Cl- + 2H2O
3. Phản ứng ankyl hóa :
- Amin bậc một hoặc bậc hai tác dụng với ankyl halogenua (CH3I, …) , nguyên tử H của nhóm amin có thể bị thay thế bởi gốc ankyl:
Ví dụ: C2H5NH2 + CH3I → C2H5NHCH3 + HI
- Phản ứng này dùng để điều chế amin bậc cao từ amin bậc thấp hơn.
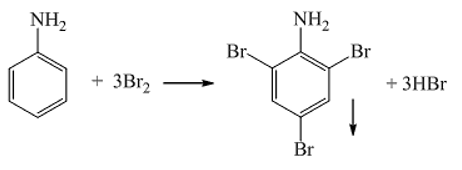
4. Phản ứng thế ở nhân thơm của anilin :
III. Tính chất vật lí và nhận biết
- Metyl–, đimetyl–, trimetyl– và etylamin là những chất khí có mùi khai khó chịu, độc, dễ tan trong nước, các amin đồng đẳng cao hơn là chất lỏng hoặc rắn.
- Anilin là chất lỏng, nhiệt độ sôi là 184°C, không màu, rất độc, ít tan trong nước, tan trong ancol và benzen.
IV. Điều chế
- Thay thế nguyên tử H của phân tử amoniac:
NH3 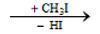
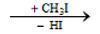
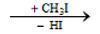
- Khử hợp chất nitro:
C6H5NO2 +6H 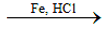
V. Ứng dụng
- Các ankylamin được dùng trong tổng hợp hữu cơ, đặc biệt là các điamin được dùng để tổng hợp polime.
- Anilin là nguyên liệu quan trọng trong công nghiệp phẩm nhuộm (phẩm azo, đen anilin,...), polime (nhựa anilin - fomanđehit,...), dược phẩm (streptoxit, suafaguaniđin,...)
Từ khóa » Diều Chế Amin
-
Amin - Điều Chế, ứng Dụng
-
Lý Thuyết Amin: Tính Chất Hóa Học, Tính Chất Vật Lí, Cấu Tạo, Điều Chế ...
-
[PDF] AMIN III. Điều Chế : 1. Ankyl Hóa NH 3 Và Các Amin
-
Điều Chế Amin - Tieng Wiki
-
Tính Chất Vật Lý Tính Chất Hóa Học điều Chế Amin - Luyện Tập 247
-
Amin: Tính Chất Hóa Học, Tính Chất Vật Lí, Cấu Tạo, Điều Chế, Ứng Dụng
-
Amin – Tính Chất Vật Lý Tính Chất Hóa Học điều Chế Amin - Tự Học 365
-
Lý Thuyết Về Amin - Thầy Dũng Hóa
-
Tính Chất Của Amin, điều Chế Amin, So Sánh Tính Bazo ... - TaiLieu.VN
-
Amin – Wikipedia Tiếng Việt
-
Lý Thuyết Amin: Tính Chất Vật Lí, Tính Chất Hóa Học, điều Chế
-
Tính Chất Của Amin, điều Chế Amin, So Sánh Tính Bazo ... - Tailieunhanh
-
Amin - Điều Chế, ứng Dụng - Trang Giới Thiệu Tốp Hàng Đầu Việt ...