Tính Chất Hoá Học Của Axit Sunfuric H2SO4, Ví Dụ Và Bài Tập
Có thể bạn quan tâm
Vậy axit sunfuric H2SO4 có những tính chất hoá học và tính chất vật lý nào? Axit sunfuric đặc có tính chât hóa học gì khác axit sunfuric loãng? chúng ta hãy cùng tìm hiểu chi tiết qua bài viết dưới đây.
* Trong bài này các em cần nắm vững tính chất hoá học sau của axit sunfuric
- Tác dụng với kim loại (trước Hyđro)
- Tác dụng với oxit bazơ
- Tác dụng với bazơ
- Tác dụng với phi kim
- Tác dụng với chất khử (Fe, FeSO4,...)
Về chi tiết tính chất hoá học của axit sunfuric H2SO4 các em tham khảo bài viết dưới đây
I. Tính chất vật lý của axit sunfuric H2SO4
- Axit sunfuric H2SO4 là chất lỏng, sánh như dầu, nặng gấp 2 lần nước, khó bay hơi và tan vô hạn trong nước.
- Axit sunfuric H2SO4 đặc hút nước mạnh và tỏa nhiều nhiệt nên khi pha loãng phải cho từ từ axit đặc vào nước. Nếu làm ngược lại sẽ làm nước sôi đột ngột bắn ra ngoài kèm theo các giọt axit làm bỏng da hoặc cháy quần áo.
II. Tính chất hoá học của axit sunfuric H2SO4
1. Axit sunfuric loãng (H2SO4 loãng)
* H2SO4 loãng là một axit mạnh, có đầy đủ các tính chất hóa học chung của axit:
a) Axit sunfuric loãng làm quỳ tím chuyển thành màu đỏ.
b) Axit sunfuric lãng tác dụng với kim loại đứng trước H (trừ Pb) → muối sunfat (trong đó kim loại có hóa trị thấp) + H2↑
- PTPƯ: H2SO4 loãng + Kim loại → Muối + H2↑
Ví dụ: Fe + H2SO4 → FeSO4 + H2↑
Mg + H2SO4 → MgSO4 + H2↑
* Lưu ý:
- nH2 = nH2SO4
- mmuối = mkim loại + mH2SO4 - mH2 = mkim loại + 96nH2
c) Axit sunfuric loãng tác dụng với oxit bazơ → muối (trong đó kim loại giữ nguyên hóa trị) + H2O
- PTPƯ: H2SO4 loãng + Oxit bazo → Muối + H2O
Ví dụ: FeO + H2SO4 → FeSO4 + H2O
MgO + H2SO4 → MgSO4 + H2O
* Lưu ý:
- nH2SO4 = nH2O = nO (trong oxit)
- mmuối = moxit + mH2SO4 - mH2O = moxit + 98nH2SO4 - 18nH2O = moxit + 80nH2SO4 = moxit + 80n(O trong oxit)
d) Axit sunfuric loãng tác dụng với bazơ → muối + H2O
- PTPƯ: H2SO4 loãng + Bazo → Muối + H2O
Ví dụ: H2SO4 + NaOH → NaHSO4 + H2O
H2SO4 + 2NaOH → Na2SO4 + 2H2O
- Phản ứng của H2SO4 với Ba(OH)2 hoặc bazơ kết tủa chỉ tạo thành muối sunfat.
Ví dụ: Cu(OH)2 + H2SO4 → CuSO4↓ + 2H2O
Ba(OH)2 + H2SO4 → BaSO4↓ + 2H2O
e) Axit sunfuric loãng tác dụng với muối → muối mới (trong đó kim loại giữ nguyên hóa trị) + axit mới
- PTPƯ: H2SO4 loãng + Muối → Muối mới + Axit mới
Ví dụ: Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2
H2SO4 + 2KHCO3 → K2SO4 + 2H2O + 2CO2
* Lưu ý: Thường dùng phương pháp tăng giảm khối lượng khi giải bài tập về phản ứng của axit sunfuric với muối.
2. Axit sunfuric đặc (H2SO4 đặc)
* Số oxi hóa của mà lưu huỳnh (S) có thể có là: -2 ; 0 ; +4 ; +6. Trong H2SO4 thì S có mức oxi hóa +6 cao nhất nên → H2SO4 đặc có tính axit mạnh, oxi hóa mạnh và có tính háo nước.
a) Axit sunfuric đặc tác dụng với kim loại
- Thí nghiệm: Cho mảnh Cu vào ống nghiệm chứa H2SO4 đặc
- Hiện tượng: dung dịch chuyển sang màu xanh và khí bay ra có mùi sốc.
- Phương trình hóa học:
2H2SO4 + Cu → CuSO4 + SO2↑ + 2H2O
- H2SO4 đặc, nóng tác dụng với các kim loại khác
2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2↑ + 6H2O
5H2SO4 + 4Zn → 4ZnSO4 + H2S↑ + 4H2O
* Lưu ý:
- Trong các bài tập vận dụng, kim loại tác dụng với axit sunfuric đặc thường gặp nhất là tạo khí SO2, khi giải thường vận dụng bảo toàn e và bảo toàn nguyên tố:
- ne = nkim loại.(hóa trị)kim loại = 2nSO2
- nH2SO4 phản ứng = 2nSO2
- mmuối = mkim loại + 96nSO2
- H2SO4 đặc nguội thụ động (không phản ứng) với Al, Fe và Cr.
- H2SO4 đặc phản ứng được với hầu hết các kim loại (trừ Au và Pt) → muối (trong đó kim loại có hóa trị cao) + H2O + SO2↑ (S, H2S).
- Sản phẩm khử của S+6 tùy thuộc vào độ mạnh của kim loại: kim loại có tính khử càng mạnh thì S+6 bị khử xuống mức oxi hóa càng thấp.
b) Axit sunfuric đặc tác dụng với phi kim → oxit phi kim + H2O + SO2↑
- PTPƯ: H2SO4 đặc + Phi kim → Oxit phi kim + H2O + SO2↑
S + 2H2SO4 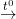 3SO2↑ + 2H2O
3SO2↑ + 2H2O
C + 2H2SO4 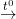 CO2 + 2H2O + 2SO2↑
CO2 + 2H2O + 2SO2↑
2P + 5H2SO4 → 2H3PO4 + 5SO2↑ + 2H2O
c) Axit sunfuric đặc tác dụng với các chất khử khác
- PTPƯ: H2SO4 đặc + chất khử (FeO, FeSO4) → Muối + H2O + SO2↑
2H2SO4 + 2FeSO4 → Fe2(SO4)3 + SO2↑ + 2H2O
2FeO + 4H2SO4 → Fe2(SO4)3 + SO2↑ + 4H2O
d) Tính háo nước của axit sunfuric
- Thí nghiệm: Cho H2SO4 đặc vào cốc đựng đường
- Hiện tượng: Đường chuyển sang màu đen và sôi trào
- Phương trình hóa học:
C12H22O11 + H2SO4 → 12C + H2SO4 .11H2O
• xem thêm: Một số dạng bài tập nâng cao về Axit Sunfuric có lời giải và đáp án
III. Bài tập về Axit sunfuric H2SO4
Bài 1 trang 143 sgk hoá 10: Một hợp chất có thành phần theo khối lượng 35,96% S; 62,92 %O và 1,12 %H. Hợp chất này có công thức hóa học là:
A. H2SO3. B. H2SO4. C. H2S2O7. D. H2S2O8.
* Lời giải bài 1 trang 143 sgk hoá 10:
Ta gọi công thức của hợp chất là: HxSyOz
⇒ M = (x + 32y + 16z)
Theo bài ra ta có:
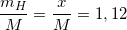 (1)
(1)
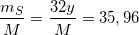 (2)
(2)
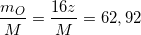 (3)
(3)
Từ (1) và (2) ⇒ x:y = 1:1 = 2:2 (*)
Từ (2) và (3) ⇒ y:z = 2:7 (**)
Vậy từ (*) và (**) ⇒ x:y:z = 2:2:7
⇒ CT: H2S2O7
Kết luận: Đáp án đúng là C
Bài 3 trang 143 SGK Hóa 10: Có 4 lọ, mỗi lọ đựng một dung dịch không màu: NaCl, HCl, Na2SO4, Ba(NO3)2. Hãy nhận biết dung dịch đựng trong mỗi lọ bằng phương pháp hóa học. Viết các phương trình hóa học xảy ra, nếu có.
* Lời giải bài 3 trang 143 SGK Hóa 10:
- Cho dung dịch BaCl2 vào 4 mẫu thử chứa 4 dung dịch trên, dung dịch trong mẫu thửu nào cho kết tủa trắng là Na2SO4
BaCl2 + Na2SO4 → BaSO4 + 2NaCl
- Cho dung dịch AgNO3 vào 3 mẫu thử còn lại, dung dịch trong mẫu không cho kết tủa là Ba(NO3)2, còn 2 mẫu thử còn lại cho kết tủa là HCl và NaCl.
HCl + AgNO3 → AgCl↓ + HNO3
NaCl + AgNO3 → AgCl↓ + NaNO3
- Để phân biệt dung dịch HCl và NaCl, cho quỳ tím vào 2 dung dịch, dung dịch chuyển màu quỳ tím sang đỏ là HCl, dung dịch không làm chuyển màu quỳ tím là NaCl.
Bài 4 trang 143 SGK Hóa 10: a) Axit sunfuric đặc được dùng làm khô những khí ẩm, hãy dẫn ra một thí dụ. Có những khí ẩm không được làm khô bằng axit sunfuric đặc, hãy dẫn ra một thí dụ. Vì sao?
b) Axit sunfric đặc có thể biến nhiều hợp chất hữu cơ thành than được gọi là sự hóa than. Dẫn ra những thí dụ về sự hóa than của glocozơ, saccarozơ.
c) Sự làm khô và sự hóa than khác nhau như thế nào?
* Lời giải Bài 4 trang 143 SGK Hóa 10:
a) Axit sunfuric đặc được dùng làm khô những khí ẩm. Thí dụ làm khô khí CO2, không làm khô được khí H2S, H2, ...(do có tính khử).
H2SO4 đặc + H2 → SO2 + 2H2O
H2SO4 đặc + 3H2S → 4S + 4H2O
b) Axit sunfuric đặc có thể biến nhiều hợp chất hữu cơ thành than:
C6H12O6 → 6C + 6H2O
C12H22O11 → 12C + 11H2O
c) Sự làm khô: chất được làm khô không thay đổi.
- Sự hóa than: chất tiếp xúc với H2SO4 đặc biến thành chất khác trong đó có cacbon.
Bài 5 trang 143 sgk hóa 10: a) Trong hợp nào axit sunfuric có nhưng tính chất hóa học chung của một axit ? Đó là những tính chất nào? Dẫn ra những phương trình phản ứng để minh họa.
b) Trong trường hợp nào axit sunfuric có những tính chất hóa học đặc trưng? Đó là những tính chất nào? Dẫn ra những phương trình phản ứng để minh họa.
* Lời giải bài 5 trang 143 sgk hóa 10:
a) Dung dịch axit sunfuric loãng có những tính chất chung của axit, đó là:
- Đổi màu quỳ tím thành đỏ.
- Tác dụng với kim loại giải phóng hiđro.
Fe + H2SO4 → FeSO4 + H2
- Tác dụng với oxit bazơ và bazơ
Ba(OH)2 + H2SO4 → BaSO4↓ + 2H2O
- Tác dụng với nhiều muối
BaCl2 + H2SO4 → BaSO4 +2HCl
b) Tính chất hóa học đặc trưng của axit sunfuric đặc là tính oxi hóa mạnh và tính háo nước.
- Tính chất oxi hóa mạnh
2H2SO4 + Cu → CuSO4 + SO2 + 2H2O
2H2SO4 + S → 3SO2 + 2H2O
2H2SO4 + 2KBr → Br2 + SO2 + 2H2O + K2SO4
- Tính háo nước và tính chất oxi hóa: Axit sunfuric đặc hấp thụ mạnh nước. Axit sunfuric đặc chiếm các nguyên tử H và O là những nguyên tố thành phần của các hợp chất gluxit giải phóng cacbon và nước.
C12H22O11 → 12C + 11H2O.
- Nếu để H2SO4 đặc tiếp xúc với da sẽ bị bỏng rất nặng, vì vậy khi sử dụng axit sunfuric phải hết sức thận trọng.
Bài 6 trang 143 sgk hoá 10: Có 100ml dung dịch H2SO4 98%, khối lượng riêng là 1,84 g/ml. Người ta muốn pha loãng thể tích H2SO4 trên thành dung dịch H2SO4 20%.
a) Tính thể tích nước cần dung để pha loãng.
b) Khi pha loãng phải tiến hành như thế nào?
Từ khóa » Tính Chất Hóa Của Axit Sunfuric
-
Tính Chất Hóa Học Của Axit Sunfuric H2SO4 Và ứng Dụng - VOH
-
Tính Chất Hóa Học, Tính Chất Vật Lý Của Axit Sunfuric (H2SO4). Ví Dụ ...
-
Axit Sunfuric Loãng: Tính Chất Hóa Học, Công Thức, ứng Dụng
-
#Axit Sunfuric Là Gì? Tính Chất, ứng Dụng Của Axit Sunfuric - GhGroup
-
Tính Chất Hóa Học Của Axit Sunfuric
-
Tính Chất Hóa Học Của Axit Sunfuric (H2SO4) đặc Và Loãng - TopLoigiai
-
Tính Chất Hóa Học Của H2SO4 đặc Như Thế Nào?
-
Tính Chất Hóa Học Của Axit Sunfuric (H2SO4) Và ứng Dụng Trong Thực ...
-
Axit Sunfuric Là Gì? Tính Chất, ứng Dụng Và Lưu ý Khi Sử Dụng H2SO4
-
Axit Sulfuric Là Gì? Ứng Dụng Và Nơi Mua Sulfuric Uy Tín Và Chất Lượng
-
Axit Sunfuric (H2SO4) Là Gì? Tính Chất Vật Lí, Tính Chất Hóa Học
-
Trong Bài Thực Hành Về Tính Chất Hóa Của Axit Sunfuric Có Những
-
Axit Có Những Loại Nào? Tính Chất Vật Lý Và Hóa Học Của Axit
-
Công Thức Hóa Học Của Axit Sunfuric - Luật Hoàng Phi