Tính Chất Hóa Học Của Các Hợp Chất Của Lưu Huỳnh, Hiđro Sunfua H2S
Có thể bạn quan tâm
1.Hiđro sunfua H2S
- Dung dịch H2S trong nước có tính axit yếu (axit sunfuhiđric).
- H2S có tính khử mạnh, khi tham gia phản ứng có thể bị oxi hóa thành \(S^{0}\) hoặc \(S^{+4}\).
Thí dụ
2H2S + SO2 -> 3S + 2H2O
2H2S + 3O2 -> 2H2O + 2SO2
H2S + 4Cl2 + 4H2O -> H2SO4 + 8HCl.
2. Lưu huỳnh đioxit (SO2)
- SO2 là một oxit axit, tác dụng với nước tạo thành axit sunfurơ ( H2SO3).
SO2 + H2O -> H2SO3.
- SO2 có tính oxi hóa khi tác dụng với chất khử mạnh hơn.
- SO2 có tính khử khi tác dụng với chất oxi hóa mạnh hơn.
Thí dụ :
S + O2 -> SO3
3. Lưu huỳnh trioxit và axit sunfuric.
- SO3 là oxit axit, tác dụng với nước tạo thành dung dịch H2SO4
SO3 + H2O -> H2SO4.
Advertisements (Quảng cáo)
- Dung dịch H2SO4 loãng có những tính chất chung của axit : tác dụng với kim loại đứng t rước H, tác dụng với oxit bazơ, bazơ, với dung dịch muối, đổi màu quỳ tím thành đỏ.
- H2SO4 đặc có những tính chất hóa học đặc biệt :
Tính oxi hóa mạnh, oxi hóa được hầu hết các kim loại, nhiều phi kim, nhiều hợp chất vô cơ, hữu cơ.
Thí dụ :
2H2SO4(đặc) + Cu -> CuSO4 + SO2 + 2H2O.
2H2SO4(đặc) + C -> SO2 + CO2 + 2H2O.
H2SO4 (đặc) + 2HI -> I2 + 2H2O + SO2.
C12H22O11\(\overset{H_{2}SO_{4}d}{\rightarrow}\)12C + 11H2O
Da thịt tiếp xúc với H2SO4 đặc sẽ bị bỏng rất nặng, vì vậy sử dụng H2SO4 đặc phải hết sức thận trọng.
- Nhận biết ion SO42- :
Dùng dung dịch muối bari hoặc dung dịch Bari hiđroxit để nhận biết SO42 trong dung dịch H2SO4 hoặc trong dung dich muối sunfat.
Thí dụ :
H2SO4 + BaCl2 -> BaSO4 + 2NaOH.
Muối BaSO4 có kết tủa trắng.
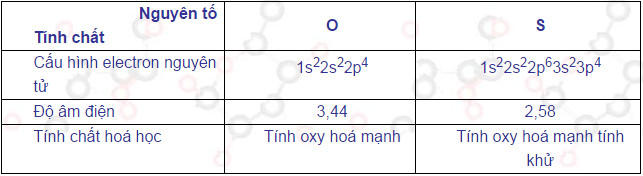
Tính chất của các hợp chất của lưu huỳnh được tóm tắt trong bảng dưới đây :
Từ khóa » Tính Chất Hóa Học Của H2s Lớp 10
-
Tính Chất Của Hiđro Sunfua (H2S): Tính Chất Hóa Học, Vật Lí, Điều Chế ...
-
[CHUẨN NHẤT] Tính Chất Hóa Học Của H2S - TopLoigiai
-
Tính Chất Vật Lý Và Tính Chất Hóa Học Của H2S
-
CẤU TẠO, TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CỦA ...
-
Hidro Sunfua (H2S), Lưu Huỳnh Dioxit (SO2), Lưu Huỳnh Trioxit (SO3 ...
-
Tính Chất Hóa Học Của Hidro Sunfua H2S, Lưu Huỳnh Dioxit SO2 ...
-
Tính Chất Vật Lý, Tính Chất Hóa Học Của Hidro Sunfua H2S ... - KhoiA.Vn
-
Top 9 Tính Chất Hóa Học Của H2s 2022 - Hàng Hiệu
-
Tính Chất Vật Lý Và Tính Chất Hóa Học Của H2S - ThiênBảo Edu
-
Tính Chất Vật Lý, Tính Chất Hóa Học Của Hidro Sunfua H2S, Lưu Huỳnh ...
-
Hiđro Sunfua Có Tính Chất Hóa Học đặc Trưng Là - MarvelVietnam
-
[PDF] HIĐRO SUNFUA – LƯU HUỲNH ĐIOXIT - THPT Nguyễn Hữu Cảnh
-
Giáo án Hóa Học 10 Bài 44: Hidrosunfua
-
Tính Chất Hóa Học Của Dung Dịch H2S Là: