Tính Chất Hóa Học Của Oxit Lớp 9 - CungHocVui
Có thể bạn quan tâm
Tính chất hóa học của Oxit lớp 9
Trong bài viết này Cunghocvui sẽ giới thiệu tới các bạn một nội dung học rất quan trọng và bổ ích về bài trình bày tính chất hóa học của oxit!
I. Lý thuyết
Oxit được cấu tạo nên từ hai nguyên tố hóa học khác nhau, một trong hai nguyên tố bắt buộc phải là oxi, nguyên tố còn lại có thể là kim loại, phi kim và các dòng hợp kim khác.
Công thức tổng quát: MxOy
1. Phân dạng
Oxit bazơ: Được cấu tạo từ nguyên tố oxi và nguyên tố còn lại là kim loại. Xét về mặt hóa học khi cho chúng tác dụng với nước sẽ tạo ra bazo, còn khi phản ứng với axit thường tạo ra sản phẩm là muối và nước.
Ví dụ: \(Na_2O - NaOH, Fe_2O_3 - Fe(OH)_3...\)
Oxit axit: Được cấu tạo từ nguyên tố oxi và nguyên tố còn lại là phi kim. Xét về mặt hóa học khi cho chúng tác dụng với nước sẽ tạo ra axit, còn khi phản ứng với bazơ thường tạo ra sản phẩm là muối và nước.
Ví dụ: \(Mn_2O_7 - HMnO_4, CO_2 - H_2CO_3, P_2O_5 - H_3PO_4..\)
Oxit lưỡng tính: Có tính chất hóa học đồng thời giống như axit và bazo.
Ví dụ: \( Al_2O_3, ZnO\)
Oxit trung tính: không có những đặc tính hóa học như oxit axit và oxit bazo nêu trên, khi cho tác động với nước hay axit và bazo thì không cho hiện tượng gì.
Ví dụ: CO, NO,...
2. Các phản ứng
2.1. Tác dụng với nước
Oxit axit kết hợp với nước ở những điều kiện tiêu chuẩn sẽ tạo thành dung dịch axit (trừ \(SiO_2\)).
Ví dụ: \({\displaystyle {\ {SO_3 +H_2O \to H_2SO_4}}}\)
\({\displaystyle { {P_2O_5 +3H_2O \to2H_3PO_4}}}\)
Một số oxit bazơ phản ứng với nước tạo thành bazơ.
Ví dụ: \({\displaystyle { {CaO +H_2O \to Ca(OH)_2}}}\)
\({\displaystyle { {BaO +H_2O \to Ba(OH)_2}}}\)
2.2. Phản ứng với axit
Khi cho hỗn hợp tác dụng với axit tại trường hợp khi là oxit bazơ thì sản phẩm cho ra bao gồm muối của gốc axit và nước.
Ví dụ: \({\displaystyle { {3CaO +2H_3PO_4 \to Ca_3(PO_4)_2 +3H_2O}}}\)
2.3. Phản ứng với bazơ
Khi cho hỗn hợp tác dụng với bazơ tại trường hợp khi là oxit axit thì sản phẩm cho ra bao gồm muối của gốc bazơ và nước.
Ví dụ:\({\displaystyle { {SO_3 +2NaOH \to Na_2SO_4 +H_2O}}}\)
Đối với các loại oxit lương tính sẽ có những đặc tính chung của cả hai loại nên dễ dàng tham gia phản ứng hóa học.
Ví dụ: \({\displaystyle { {Al_2O_3 +2NaOH \to 2NaAlO_2 +H_2O}}}\)
2.4. Phản ứng với oxit
5 oxit bazơ \(CaO, Na_2O, Li_2O, BaO, K_2O\) có thể tác dụng với oxit axit tạo thành muối
Ví dụ: \({\displaystyle { {CaO +CO_2 \to CaCO_3}}}\)
\({\displaystyle { {BaO +CO_2 \to BaCO_3}}}\)
3. Cách đọc tên của oxit
Cách 1: Gọi tên của nguyên tố liền trước oxit, có thể là kim loại hoặc phi kim + oxit ở cuối
Ví dụ: CaO - Canxi oxit
Cách 2: Với những kim loại đặc biệt ví dụ như Fe hay Zn thường có hai hóa trị nên khi gọi ta nên kèm hóa trị để tránh nhầm lẫn và dễ phân biệt hơn.
Ví dụ: FeO - Sắt(II) oxit
\(Fe_2O_3\) - Sắt(III) oxit
Tương tự như kim loại, sẽ có những phi kim có nhiều hóa trị nên khi gọi tên ta cũng thêm các tiền tố ở phía trước oxit để phân biệt chúng, tham khảo ví dụ dưới đây.
Ví dụ: \(SO_3\) - Lưu huỳnh trioxit.
\(N_2O_5\) - Đinitơ pentaoxit.
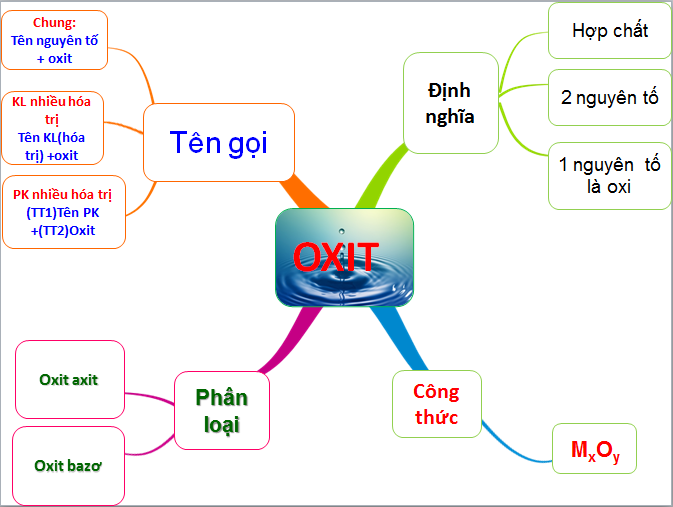
II. Sơ đồ tư duy tính chất hóa học của oxit
III. Bài tập tính chất hóa học của oxit Hóa 9
Câu 1: Nhận định đúng cho phản ứng hóa học giữa \(H_2SO_4, NaOH\)
A. phản ứng trung hoà B. phản ứng phân huỷ C. phản ứng thế D. phản ứng hoá hợp
Câu 2: Dãy nào dưới đây là tổng hợp của oxit bazơ và oxit trung tính có khả năng tác dụng với axit để tổng hợp nên muối.
A. \(CO_2, P_2O_5, CaO\) B. \(FeO, NO_2, SO_2\)
C. \(CO_2, P_2O_5, SO_2 \) D. \(CaO, K_2O, CuO\)
Câu 3: Phản ứng hóa học của chất nào được liệt kê dưới đây tạo ra sản phẩm là chất kết tủa dễ nhận biết khi tác dụng với HCl:
A. Cu B. Fe C. \(Fe_2O_3 \) D. ZnO
Câu 4: TRong dãy các oxit liệt kê dưới đây, nhóm nào có khả năng tác dụng hoàn toàn với nước tạo ra các sản phẩm tương ứng
A. \(CO_2, P_2O_5, CaO\) B. \(FeO, NO_2, SO_2\)
C. \(CO_2, P_2O_5, SO_2 \) D. \(CaO, K_2O, CuO\)
Câu 5: Tìm sự khác biệt về mặt hóa học giúp chúng ta có thể nhận biết hai axit quan trọng đây: HCl và \(H_2SO_4\). Chất thử được sử dụng là gì?
A. CuO B. \(Fe(OH)_2 \) C. Zn D. \(Ba(OH)_2\)
Câu 6. Oxit khi tác dụng với nước tạo ra dung dịch axit sunfuric là:
A. CO2
B. SO3
C. SO2
D. K2O
Câu 7. Oxit được dùng làm chất hút ẩm (chất làm khô) trong phòng thí nghiệm là:
A. CuO
B. ZnO
C. PbO
D. CaO
Câu 8. Sản phẩm của phản ứng phân hủy canxicacbonat bởi nhiệt là:
A. CaO và CO
B. CaO và CO2
C. CaO và SO2
D. CaO và P2O5
Câu 9. Cặp chất tác dụng với nhau sẽ tạo ra khí lưu huỳnh đioxit là :
A. CaCO3 và HCl
B. Na2SO3 và H2SO4
C. CuCl2 và KOH
D. K2CO3 và HNO3
Câu 10. Khí nào sau đây duy trì sự sống và sự cháy?
A. CO
B. O2
C. N2
D. CO2
Câu 11. Chất nào sau đây góp phần nhiều nhất vào sự hình thành mưa axit?
A. CO2
B. SO2
C. N2
D. O3
Câu 12. Chất nào có trong không khí góp phần gây nên hiện tượng vôi sống hóa đá?
A. NO
B. NO2
C. CO2
D. CO
Câu 13. Vối sống có công thức hóa học là:
A. Ca
B. Ca(OH)2
C. CaCO3
D. CaO
Câu 14. Cặp chất tác dụng với nhau tạo ra muối natrisunfit là:
A. NaOH và CO2
B. Na2O và SO3
C. NaOH và SO3
D. NaOH và SO2
Câu 15. Oxit tác dụng với nước tạo ra dung dịch làm xanh quì tím là:
A. CO2
B. P2O5
C. Na2O
D. MgO
Câu 16. Dẫn hỗn hợp khí gồm CO2 ; CO; SO2 lội qua dung dịch nước vôi trong dư , khí thoát ra là:
A. CO
B. CO2
C. SO2
D. CO2 và SO2
Câu 17. Để nhận biết 2 lọ mất nhãn đựng CaO và MgO ta dùng:
A. HCl
B. NaOH
C. HNO3
D. Quì tím ẩm
Câu 18. Chất nào dưới đây có phần trăm khối lượng của oxi lớn nhất?
A. CuO
B. SO2
C. SO3
D. Al2O3
Câu 19. Để loại bỏ khí CO2 có lẫn trong hỗn hợp (O2 và CO2), người ta cho hỗn hợp đi qua dung dịch chứa:
A. HCl
B. Ca(OH)2
C. Na2SO4
D. NaCl
Câu 20. Oxit nào sau đây khi tác dụng với nước tạo ra dung dịch có pH> 7?
A. CO2
B. SO2
C. CaO
D. P2O5
Câu 21. Để nhận biết 3 khí không màu SO2; O2; H2 đựng trong 3 lọ mất nhãn ta dùng:
A. Quì tím ẩm
B. Quì tím ẩm và dùng tàn đóm đỏ
C. Than hồng trên que đóm
D. Dẫn các khí vào nước vôi trong
Câu 22. Khí nào có tỉ khối đối với hiđro bằng 32 là:
A. N2O
B. SO2
C. SO3
D. CO2
Câu 23. Để làm khô khí CO2 cần dẫn khí này đi qua :
A. H2SO4 đặc
B. NaOH rắn
C. CaO
D. KOH rắn
Câu 24. Chất khí nặng gấp 2,2069 lần không khí là:
A. CO2
B. SO2
C. SO3
D. NO
Câu 25. Dãy các chất tác dụng với lưu huỳnh đioxit là:
A. Na2O; CO2; NaOH; Ca(OH)2
B. CaO; K2O; KOH; Ca(OH)2
C. HCl; Na2O; Fe2O3; Fe(OH)3
D. Na2O; CuO; SO3; CO2
ĐÁP ÁN
| 1 | A |
| 2 | D |
| 3 | C |
| 4 | B |
| 5 | D |
| 6B | 7D | 8B | 9B | 10B | 11B | 12C | 13D | 14D | 15C |
| 16A | 17D | 18C | 19B | 20C | 21B | 22B | 23A | 24B | 25B |
Tính chất hóa học của oxit. Khái quát về sự phân loại oxit
Hy vọng rằng với những kiến thức mới về các tính chất hóa học của oxit trên đây, các bạn hoàn toàn có thể nắm chắc một cách dễ dàng và có những giờ học thư giãn!
Tags bài tập tính chất hóa học của oxit hóa 9 trình bày tính chất hóa học của oxit các tính chất hóa học của oxit sơ đồ tư duy tính chất hóa học của oxit tính chất hóa học của oxit lớp 9 tính chất hóa học của oxitTừ khóa » Sơ đồ Tư Duy Canxi Oxit
-
Sơ đồ Tư Duy Về Oxit - Dương Quá - HOC247
-
Sơ đồ Tư Duy Tính Chất Hóa Học Của Oxit - Tutukit
-
Sáng Kiến Kinh Nghiệm Sử Dụng Bản đồ Tư Duy Trong Một Số Bài Môn ...
-
Vẽ Sơ đồ Tư Duy Về Canxi Oxit Và Lưu Huỳnh đioxit, Giúp Em Với Em ...
-
Bài 2. Lý Thuyết Một Số Oxit Quan Trọng | Giải Hóa 9 - TopLoigiai
-
Công Thức Hóa Học Của Canxi Oxit? - TopLoigiai
-
Một Số Oxit Quan Trọng: Canxi Oxit (CaO) Và Lưu Huỳnh đioxit (SO2)
-
Bài 1: Tính Chất Hóa Học Của Oxit Và Khái Quát Về Sự Phân Loại Oxit
-
Top 18 Sơ đồ Tư Duy Tính Chất Hóa Học Của Axit Mới Nhất 2022
-
Đề Tài Sử Dụng Bản đồ Tư Duy Trong Dạy Học Hoá Học 9 - Giáo Án Mẫu
-
Hóa Online || Tính Chất Của Oxit - Hóa Học 9 - YouTube
-
Sơ đồ Tư Duy Tính Chất Hóa Học Của Oxit
-
Bài 2: Một Số Oxit Quan Trọng - Hóa Học Lớp 9 - HocTapHay