TÍNH CHẤT HÓA HỌC, ĐIỀU CHẾ VÀ ỨNG DỤNG CÁC HỢP CHẤT ...
Có thể bạn quan tâm
I. Canxi hidroxit: Ca(OH)2 (còn gọi là vôi tôi)
1. Tính chất vật lí
- Chất rắn màu trắng, ít tan trong nước.
2. Tính chất hóa học
- Dung dịch Ca(OH)2 là bazơ mạnh
Ca(OH)2 → Ca2+ + 2OH –
a. Làm thay đổi chất chỉ thị màu
- Làm quỳ tím hóa xanh.
- Làm dung dịch phenolphtalein hóa hồng.
b. Tác dụng với axit → muối và nước
Ví dụ: Ca(OH)2 + 2HCl → CaCl2 + 2H2O
c. Tác dụng với oxit axit → muối và nước
- Hiện tượng quan sát được: Có kết túa sau đó kết tủa tan.
- Phương trình hóa học
CO2 + Ca(OH)2 → CaCO3 + H2O (1)
2 CO2 + Ca(OH)2 → Ca(HCO3)2 (2)
* Lưu ý:Tùy theo tỉ lệ phản ứng có thể tạo thành các muối khác nhau:
Gọi nOH-/ n CO2 = T thì
+ T < hoặc = 1 → muối HCO3- + T > hoặc = 2 → CO32-
+ 1 < T <2 → 2 muối: HCO3- và CO32-
d. Tác dụng với dung dịch muối
Ca(OH)2 + CuCl2 → Cu(OH)2 + CaCl2
Ca(OH)2 + Mg(HCO3)2 → CaCO3 + MgCO3 + 2 H2O
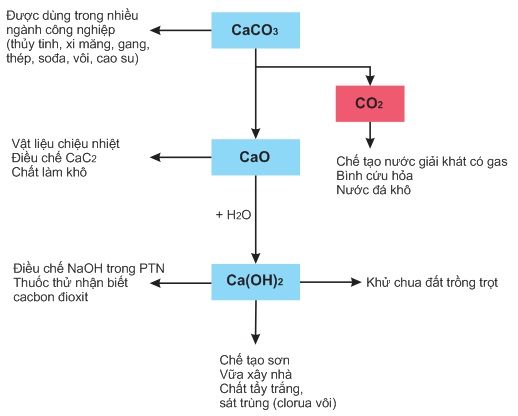
3. Ứng dụng của Ca(OH)2
- Chế tạo vữa xây nhà. Khử chua đất trồng trọt. Chế tạo clorua vôi dùng để tẩy trắng và khử trùng.
- Trong công nghiệp thuộc da để trung hòa lượng axít dư thừa.
- Trong công nghiệp lọc dầu để sản xuất các phụ gia cho dầu thô (alkilsalicatic, sulphatic, fenatic).
- Trong công nghiệp hóa chất để sản xuất stearat canxi (C17H35COO)2Ca
- Trong công nghiệp thực phẩm dùng hóa chất xử lý nước thải (để sản xuất các loại đồ uống như rượu và đồ uống không cồn)
- Để làm sạch nước biển khởi các cacbonat của canxi và magiê trong sản xuất muối dành cho thực phẩm và dược phẩm.
- Để sản xuất các hỗn hợp khô cho nghề sơn và trang trí.
- Trong sản xuất các hỗn hợp cho một số loại thuốc trừ dịch hại.
- Trong sản xuất một loại thuốc gọi là “Polikar” để chống lại sự thối rữa (do nấm) của rau, quả trong khi lưu giữ.
II. Canxi cacbonat: CaCO3
1. Tính chất vật lí
-CaCO3 là chất rắn màu trắng, không tan trong nước.
2. Tính chất hóa học
a. Phản ứng nhiệt phân (khoảng 10000C):
CaCO3 → CaO + CO2
b. Tác dụng với axit
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
c. Tác dụng với CO2 và H2O
CaCO3 + CO2 + H2O → Ca(HCO3)2
- Phản ứng này giải thích sự xâm thực của nước vào núi đá vôi.
Ca(HCO3)2 →CaCO3 + CO2 + H2O
- Phản ứng này giải thích sự tạo thành thạch nhũ trong hang động đá vôi.
3. Ứng dụng
III. Canxi sunfat: CaSO4
1. Trong tự nhiên, CaSO4 tồn tại dưới dạng muối ngậm nước CaSO4.2H2O.
- Thạch cao sống: CaSO4.2H2O
- Thạch cao nung: CaSO4.H2O
CaSO4.2H2O → CaSO4.H2O + H2O
- Thạch cao khan : CaSO4
CaSO4.2H2O → CaSO4 + 2H2O
2. Ứng dụng
- Thạch caonung có thể kết hợp với nước tạo thành thạch cao sống và khi đông cứng thì dãn nở thể tích, do vậy thạch cao rất ăn khuôn. Thạch cao nung thường được đúc tượng, đúc các mẫu chi tiết tinh vi dùng trang trí nội thất, làm phấn viết bảng, bó bột khi gãy xương,...
- Thạch cao dùng sản xuất xi măng.
Trung tâm luyện thi, gia sư - dạy kèm tại nhà NTIC Đà Nẵng
LIÊN HỆ NGAY VỚI CHÚNG TÔI ĐỂ BIẾT THÊM THÔNG TIN CHI TIẾT
ĐÀO TẠO NTIC
Địa chỉ: Đường nguyễn lương bằng, P.Hoà Khánh Bắc, Q.Liêu Chiểu, Tp.Đà Nẵng Hotline: 0905540067 - 0778494857
Email: daotaontic@gmail.com
Từ khóa » Cao ứng Dụng
-
Vôi Sống Là Gì - Canxi Oxit ? Ứng Dụng CaO Bột đá Vôi - VIETCHEM
-
Vôi Sống (Canxi Oxit) Là Gì? Ứng Dụng Của CaO Trong ... - VietChem
-
Vôi Sống Là Gì? CaO Là Gì? Ứng Dụng Của Canxi Oxit - VIETCHEM
-
Ứng Dụng Và Tầm Quan Trọng Vôi Canxi Oxit
-
Ứng Dụng Của Canxi Oxit Như Thế Nào Trong Các Ngành Công Nghiệp
-
Vôi Sống Là Gì? Cao Là Gì? Những điều Xoay Quanh Về Hợp Chất Này
-
Nêu Các ứng Dụng Của Canxi Oxit
-
Những ứng Dụng Của Canxi Oxit ( CaO ) Trong Công Nghiệp, Xây ...
-
Vôi Sống (Canxi Oxit) Là Gì? Ứng Dụng Của CaO Trong đời Sống
-
Vôi Sống Là Gì? Tính Chất Hóa Học Của CaO Và Công Dụng Thực Tế
-
Ứng Dụng Của Canxi Oxit
-
Nêu Phương Pháp điều Chế Và ứng Dụng Của SO2 Và CaO