Tính Chất Hóa Học, Ứng Dụng Của Ozon Trong Đời Sống Như Thế ...
Có thể bạn quan tâm
Ozon (O3) là chất khí có ứng dụng rất nhiều trong thực tế. Đặc biệt có vai trò cực kỳ đối với sự sống con người. Vậy khi ozon có tính chất vật lý, hóa học cũng như ứng dụng như thế nào. Các bạn hãy tham khảo bài viết sau của Công ty Xử Lý Chất Thải để có thể hiểu được toàn bộ vấn đề trên nhé.
Tính chất vật lý của Ôzon
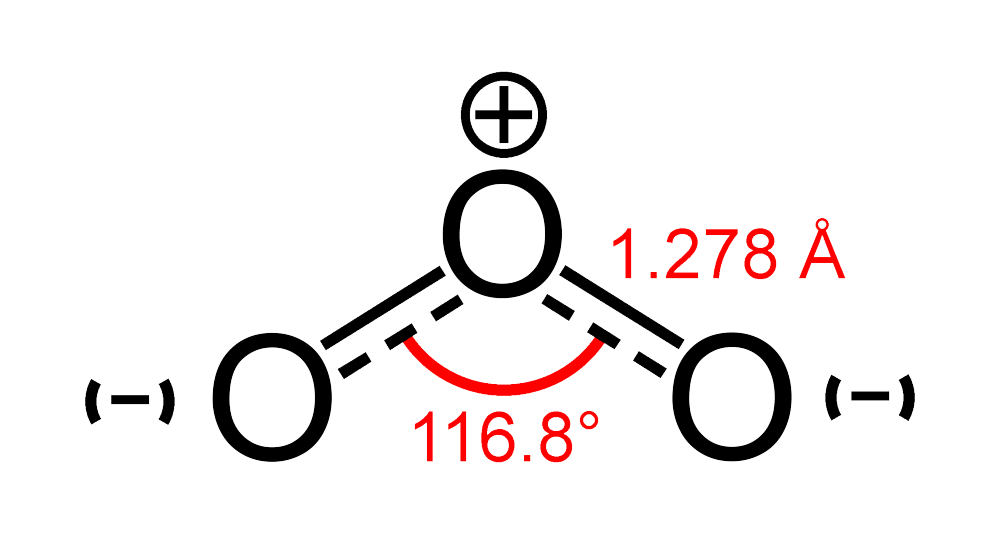
- Ôzon (O3) là chất khí có màu lam nhạt; có mùi hắc đặc trưng và trong suốt;
- Ở nồng độ cao có màu xanh da trời, ở thể lỏng có màu lục thẫm…;
- Nhiệt độ nóng chảy là -193oC, nhiệt độ sôi là -111,9oC;
- Tỷ trọng (so với không khí) d = 1,658;
- Trong môi trường nước có độ pH = 0 có thế Ôxy hoá khử là 2,07 V.
Ôzôn là chất hấp thụ mạnh các tia tử ngoại, tia nhìn thấy và tia hồng ngoại. Ôzôn có khả năng hấp thụ cao nhất ở bước sóng là 254 nm đối với các tia tử ngoại, ở bước sóng là 600 nm đối với các tia nhìn thấy và ở bước sóng là 900 nm đối với tia hồng ngoại. Ôzôn dễ hoà tan trong nước hơn ôxy và sự hoà tan của ôzôn trong nước phụ thuộc vào nhiệt độ và áp suất riêng phần của nó trong không khí, khi nhiệt độ càng tăng khả năng hoà tan Ôzôn trong nước càng giảm.
Tính chất hóa học Ozon
- Ôzôn có hoạt tính Ôxy hoá rất cao, đóng vai trò như một tác nhân Ôxy hoá mạnh trong rất nhiều phản ứng hoá học như: phản ứng với các chất hữu cơ (Phenol, các hợp chất đa vòng, các hợp chất Amin, các hợp chất có liên kết đôi (C = C) và liên kết đơn (C-H)…).
Ngoài ra ôzôn còn có khả năng khử mùi, màu, khử trùng đối với nước và nước thải.
- Ôzôn không bền, dễ dàng bị phân huỷ thành Oxi phân tử và Oxi nguyên tử.
Ví dụ: O3= O2 + O
- Dễ dàng oxi hoá iodua đến iot tự do: O3 + 2KI + H2O = I2 + O2 + 2 KOH
- Giấy tẩm dung dịch Kali iodua và hồ tinh bột ( giấy iot tinh bột ) chuyển ngay thành màu xanh khi có mặt Ôzôn trong không khí.
- Tác dụng với các phân tử thuộc nhóm halogen Flo, Clo, Brom, Iot.
- Khử các chất gây ô nhiễm có trong nước bằng phương pháp hóa học (sắt, asen, hiđrô sulfid, nitơrit, và các chất hữu cơ phức tạp liên kết với nhau tạo ra “màu” của nước)
Sự tạo thành ôzôn trong tự nhiên và trong công nghiệp
Trong tự nhiên ôzôn được tạo ra do các phản ứng quang hóa của oxy,oxit nitơ, đặc biệt ôzôn được tạo ra mạnh tại các tầng cao (bình lưu) của khí quyển, nơi mà cường độ các tia ánh sáng cứng (cực tím, tia X, v.v…) rất lớn.
Ôzon trong bầu khí quyển được tạo thành khi các tia cực tím chạm phải các phân tử oxy ,tạo thành hai nguyên tử oxy đơn ,được gọi là oxy nguyên tử Ôxy nguyên tử kết hợp cùng một phân tử oxy tạo thành phân tủ ozon .
Phân tử ozon có hoạt tính cao,khi bị tia cực tím chạm phải. Lại tách ra thành một phân tủ oxy và một oxy phân tủ . Đây là một quá trình liên tục gọi là chu kỳ ôxy-ôzon O2 + Tia cực tím ’O + O O + O2 ’ O3
Trong công nghiệp, người ta tạo ôzôn bằng cách phóng điện trong ôxy hoặc trong không khí
Ứng dụng của ozon
Do ôzôn là tác nhân ôxy hóa mạnh nên có thể dùng ôzôn để làm chất ôxy hóa, khử trùng bệnh viện, tác nhân khử trùng trong xử lý nước thải, bảo quản hoa quả tươi (nước ôzôn).
Một trong những ứng dụng quan trọng nhất của ôzôn hiện nay là khử trùng nước uống. Khử trùng nước uống bằng ôzôn có ưu điểm hơn hẳn so với khử trùng bằng clo (Cl2). Vì dùng ôzôn sẽ không lo tồn tại trong nước các sản phẩm cloramin. Là chất được cho là có khả năng gây ung thư . Trong y khoa, ozon dùng để chữa răng sâu, một lượng nhỏ ozon dùng để chữa bệnh lao.
Khí Ozon có độc hại không?
- Ôxy là chất khí duy trì sự sống (nếu trong khí thở có ít hơn 15% ôxy thì cơ thể đã có thể chết ngạt). Nhưng ôzôn lại là khí độc hại.
- Ôzôn gây phù phổi nặng, làm co thắt và tê liệt đường hô hấp. Có thể khiến người bệnh không có phản ứng khi có các dị vật lọt vào.
Vì vậy, khi tiếp xúc lâu dài với ôzôn sẽ có nguy cơ bị tích tụ các dị vật trong phế quản và phổi. Là một trong những điều kiện có khả năng dẫn đến ung thư. Ngưỡng cho phép của ôzôn trong khí thở là 0,2 mg/m3 (hay 0,1ppm). Tuy nhiên nếu tiếp xúc lâu dài với ôzôn ngay cả trong điều kiện nồng độ thấp hơn ngưỡng cho phép này cũng sẽ làm con người mỏi mệt, đau đầu, viêm họng và niêm mạc mắt, v.v…Còn nếu nồng độ ôzôn lớn hơn ngưỡng cho phép, người ta có thể bị phù phổi.
- Tại các vùng công nghiệp tập trung có khói mù công nghiệp.Vào mùa hè nồng độ ôzôn trong khói mù có thể đạt 0,3-0,4 mg/m3 và rất nguy hại cho cuộc sống con người. Đó là chưa kể tác động độc hại của các chất khác có trong khói mù.
Nguồn xulychatthai.com.vn
Từ khóa » Khí Ozon được Tao Bởi 3 Nguyên Tử Oxi Liên Kết Với Nhau. Công Thức Hóa Học Của Khí Ozon Là
-
Phân Tử Ozon Gồm Ba Nguyên Tử Oxi.Công Thức Của Ozon Là Gì?
-
Phân Tử Ozon Gồm 3 Nguyên Tử Oxi Liên Kết Với Nhau, Công Thức Hóa ...
-
Khí Ozon Gồm 3 Nguyên Tử Oxi. Công Thức Hóa Học Của Ozon Là
-
Ozon – Wikipedia Tiếng Việt
-
Ozone Là Gì? Ozone Tạo Ra Từ đâu? Và ứng Dụng Như Thế Nào
-
Ozone (O3) Là Gì ?
-
Ozone Là Gì? Tính Chất Và Công Dụng Của Khí Ozone - LINO J.S.C
-
Top 12 Công Thức Hóa Học Của Ozon - Thư Viện Hỏi Đáp
-
Ozone Là Gì?
-
Ứng Dụng Ozone Trong Ngành Công Nghiệp Chế Biến Hóa Chất (CPI)
-
Xử Lý Nước Bằng Ozone Là Gì Và Nó Hoạt động Như Thế Nào? - NION VN
-
Giải Sách Bài Tập Hóa Học 8 - Bài 6: Đơn Chất Và Hợp Chất - Phân Tử
-
Ozone Là Gì? Ứng Dụng Và Những Vấn đề Sức Khỏe Từ Ozone
-
Ứng Dụng Của Khí Ozone - .vn