Tính Chất Vật Lý, Tính Chất Hóa Học Của Phenol, Điều Chế Và Ứng Dụng
Có thể bạn quan tâm
Nội dung bài viết này giúp các em biết khái niệm về loại hợp chất phenol là gì? Công thức cấu tạo, tính chất vật lý, tính chất hóa học của Phenol đơn giản nhất? Cách điều chế và ứng dụng của phenol.
I. Định nghĩa, Phân loại Phenol
1. Định nghĩa phenol
- Phenol là những hợp chất hữu cơ trong phân tử có nhóm -OH liên kết trực tiếp với nguyên tử C của vòng benzen
> Lưu ý: Phenol (nhóm −OH đính trực tiếp vào vòng benzen) còn ancol thơm (nhóm −OH đính vào mạch nhánh của vòng benzen).
- Phenol đơn giản nhất là C6H5-OH, phân tử gồm một nhóm -OH liên kết với gốc phenyl.
2. Phân loại phenol
Dựa vào số nhóm -OH trong phân tử, phenol chia thành 2 loại:
- Phenol đơn chức: Phân tử có một nhóm -OH phenol
- Phenol đa chức: Phân tử có hai hay nhiều nhóm -OH phenol

II. Phenol: Cấu tạo, tính chất vật lý, tính chất hóa học, điều chế và ứng dụng
1. Cấu tạo của phenol
- Công thức phân tử của phenol: C6H6O
- Công thức cấu tạo của phenol: C6H5OH
hoặc 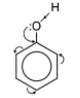
- Mô hình phân tử phenol dạng đặc (a) và dạng rỗng (b)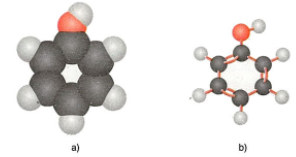
2. Tính chất vật lý của phenol
- Ở điều kiện thường, phenol là chất rắn màu trắng, nóng chảy ở 430C. Để lâu, phenol bị oxi hóa chậm bởi không khí nên chuyển thành màu hồng.
- Phenol rất độc, khi dây vào tay có thể gây bỏng da, do đó khi sử dụng phải hết sức cẩn thận.
- Phenol ít tan trong nước lạnh, nhưng tan nhiều trong nước nóng (tan tốt nhất ở 660C) và etanol.
3. Tính chất hóa học của phenol
- Phenol có phản ứng thế nguyên tử H của nhóm -OH và có tính chất của vòng benzen
a) Phản ứng thế nguyên tử H của nhóm -OH
• Tác dụng với kim loại kiềm tạo muối phenolat:
2C6H5-OH + 2Na 2C6H5-ONa + H2↑
• Tác dụng với dung dịch kiềm (dung dịch bazơ) tạo muối phenolat:
C6H5-OH + NaOH → C6H5-ONa + H2O
→ Phenol có tính axit rõ rệt, nhưng tính axit rất yếu (yếu hơn H2CO3), không làm đổi màu quỳ tím, bị CO2 đẩy ra khỏi muối phenolat.
C6H5-ONa + CO2 + H2O → C6H5-OH + NaHCO3
→ So sánh tính axit: CO2 > phenol > HCO3- > ancol.
b) Phản ứng thế nguyên tử H ở vòng benzen
• Tác dụng với brom:
- Khi cho nước brom vào dung dịch phenol, thấy xuất hiện ngay kết trắng của 2,4,6-tribromphenol:
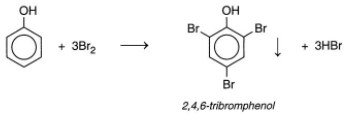 - Dung dịch phenol tác dụng với dung dịch HNO3 cho 2,4,6-trinitrophenol (axit picric) kết tủa màu vàng.
- Dung dịch phenol tác dụng với dung dịch HNO3 cho 2,4,6-trinitrophenol (axit picric) kết tủa màu vàng.
- Tương tự bezen, phenol có thể cộng hiđrô tạo thành xiclohaxenol:
C6H5-OH + 3H2 C6H11-OH
4. Điều chế phenol
- Trong công nghiệp, hiện nay phenol được điều chế bằng cách oxi hoá cumen (isopropylbenzen) nhờ oxi không khí, sau đó thuỷ phân trong dung dịch H2SO4 loãng. Sản phẩm thu được gồm phenol và axeton. Đun nóng cho axeton bay hơi rồi ngưng tụ hơi thu lấy axeton, còn lại là phenol.
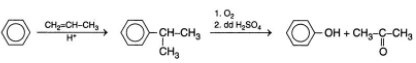 - Phenol cũng có thể được điều chế từ benzen theo sơ đồ sau:
- Phenol cũng có thể được điều chế từ benzen theo sơ đồ sau:
C6H6 → C6H5Br → C6H5ONa → C6H5OH
5. Ứng dụng của phenol
- Phenol là nguyên liệu sản xuất nhựa phenol-fomanđehit hay poli (phenol- fomanđehit) dùng chế tạo các đồ dân dụng; nhựa ure-fomanđehit dùng làm chất kết dính (như keo dán gỗ, dán kim loại, sành, sứ,...).
- Phenol còn được dùng để sản xuất phẩm nhuộm, thuốc nổ (2,4,6-trinitrophenol), chất diệt cỏ 2,4-D; chất diệt nấm mốc (nitrophenol),..
Từ khóa » Các Hợp Chất Phenol Là Gì
-
Phenol Là Gì? Tính Chất, điều Chế, Công Dụng Và Lưu ý Khi Sử Dụng
-
Tính Chất Hóa Học ứng Dụng Và Cách điều Chế Phenol - VietChem
-
Phenol Là Gì? Tính Chất Hóa Học Và Ứng Dụng Của Phenol
-
Phenol Là Gì - Tất Tần Tật Các Thông Tin Về Phenol Hóa 11
-
Phenol (C₆H₅OH): Dung Môi Hoá Học - Nhà Thuốc Long Châu
-
Phenol Là Gì? Tính Chất, điều Chế & ứng Dụng Của Phenol - VietChem
-
Lý Thuyết Phenol - Thầy Phạm Ngọc Dũng Dạy HÓA
-
Phenol Là Gì? Công Thức, Tính Chất, điều Chế, ứng Dụng Của C6H5OH
-
Phenol Là Gì? Phân Loại, Tính Chất Và ứng Dụng Của Phenol
-
Phenol Là Gì, Công Thức Cấu Tạo Của Phenol ? - Đáp Án Chuẩn
-
Tính Chất Hóa Học Và Công Thức Cấu Tạo Của Phenol C6h5OH
-
[CHUẨN NHẤT] Tính Chất Hóa Học Của Phenol - Top Lời Giải
-
Các Hợp Chất Chứa Phenol