Tính Chất Vật Lý Và Hóa Học Của Rượu Etylic – Công Thức Tính độ Rượu
Có thể bạn quan tâm
Chúng ta thường nghe nhắc nhiều đến đến rượu etylic. Khi lên men gạo, ngô, khoai, sắn hoặc một số loại quả chín người ta thu được rượu Etylic. Vậy rượu etylic là gì? Tính chất vật lý và hóa học của rượu etylic như thế nào? Nó có ứng dụng gì trong đời sống và sản xuất? Trong bài viết hôm nay, chúng ta sẽ tìm hiểu về những khía cạnh này. Mời các bạn cùng theo dõi nhé.
Tóm tắt nội dung
- Tính chất vật lý và hóa học của rượu etylic
- I. Tính chất vật lý của rượu etylic
- II. Cấu tạo phân tử của rượu etylic
- III. Tính chất hóa học của rượu etylic
- 1. Phản ứng cháy của rượu etylic
- 2. Tác dụng với natri của rượu etylic
- 3. Tác dụng với axit axetic của rượu etylic
- 4. Một số phản ứng khác của rượu etylic
- IV. Ứng dụng của rượu etylic
- V. Điều chế rượu etylic
- Giải bài tập về rượu etylic
Tính chất vật lý và hóa học của rượu etylic
I. Tính chất vật lý của rượu etylic
Rượu etylic là chất lỏng trong suốt, không màu, nhẹ hơn nước và tan vô hạn trong nước cũng như trong nhiều chất khác như benzen, iot… Nó có nhiệt độ nóng chảy là –114,3 °C, nhiệt độ sôi là 78,4 °C.
Độ rượu là số ml rượu etylic có trong 100 ml hỗn hợp rượu với nước.
Công thức tính độ rượu:
Độ rượu = (số ml rượu nguyên chất) / (số ml dung dịch rượu) x 100
Hay:
Độ rượu = (VC2H5OH / Vdd rượu) x 100
Ví dụ:
Rượu 45 độ chứa 45 ml rượu etylic nguyên chất trong 100 ml hỗn hợp rượu và nước.
II. Cấu tạo phân tử của rượu etylic
Rượu etylic có công thức phân tử là C2H6O, phân tử khối bằng 46 g/mol. Nó có công thức cấu tạo là: CH3–CH2–OH.
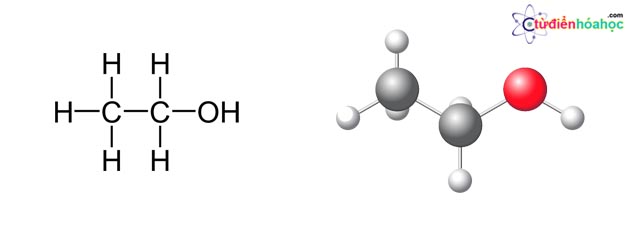
tinh-chat-vat-ly-va-hoa-hoc-cua-ruou-etylic-ethanol-c2h5oh
Trong công thức phân tử rượu etylic có một nguyên tử H không liên kết với nguyên tử C mà liên kết với nguyên tử O tạo ra nhóm –OH (hiđroxyl). Chính nhóm –OH này làm cho etylic có những tính chất đặc trưng riêng.
III. Tính chất hóa học của rượu etylic
Rượu etylic có phản ứng cháy, tác dụng được với natri, axit axetic
1. Phản ứng cháy của rượu etylic
Rượu etylic tác dụng mạnh với oxi khi đốt nóng tạo ra ngọn lửa có màu xanh và tỏa nhiều nhiệt.
C2H6O + 3O2 (t°) → 2CO2 + 3H2O
2. Tác dụng với natri của rượu etylic
Rượu etylic tác dụng được với natri kim loại giải phóng khí hidro.
2CH3–CH2–OH + 2Na → 2CH3–CH2–ONa + H2
3. Tác dụng với axit axetic của rượu etylic
Rượu etylic tác dụng với axit axetic tạo thành etyl axetat trong môi trường H2SO4 đặc, đun nóng. Đây là một este có mùi thơm, ít tan trong nước và thường được ứng dụng làm dung môi trong công nghiệp.
CH3–CH2–OH + CH3–COOH (H2SO4 đặc, t°) ⇔ CH3–COO–CH2–CH3 + H2O
4. Một số phản ứng khác của rượu etylic
– Phản ứng tách nước:
CH3–CH2–OH (H2SO4 đặc, 170 °C) → C2H4 + H2O
– Phản ứng tách nước giữa 2 phân tử rượu etylic:
CH3–CH2–OH + CH3–CH2–OH → CH3–CH2–O–CH2–CH3 + H2O
– Phản ứng oxi hóa:
CH3–CH2–OH + CuO (t°) → CH3–CHO + Cu + H2O
CH3–CH2–OH + O2 (xt, t°) → CH3COOH + H2O
– Phản ứng lên men giấm:
CH3–CH2–OH + O2 (25 °C) → CH3COOH + H2O
IV. Ứng dụng của rượu etylic
Etylic có nhiều ứng dụng trong đời sống và sản xuất như:

ung-dung-cua-ruou-etylic
- Nguyên liệu để sản xuất rượu, bia các loại
- Sản xuất dược phẩm
- Pha nước hoa, vecni
- Ứng dụng trong tổng hợp cao su
- Nguyên liệu để sản xuất nhiều hóa chất quan trọng như axit axetic…
V. Điều chế rượu etylic
Rượu etylic thường được điều chế theo hai cách sau:
– Lên men tinh bột hoặc đường:
Tinh bột hoặc đường → C2H5OH
– Tổng hợp từ etilen và nước:
C2H4 + H2O → C2H5OH
Giải bài tập về rượu etylic
Câu 1. Rượu etylic phản ứng được với natri vì:
A. trong phân tử có nguyên tử oxi.
B. trong phân tử có nguyên tử hidro và nguyên tử oxi.
C. trong phân tử có nguyên tử cacbon, hidro, oxi.
D. trong phân tử có nhóm –OH.
Đáp án đúng là: D
Câu 2. Trong số các chất sau: CH3–CH3, CH3–CH2–OH, C6H6, CH3–O–CH3 chất nào tác dụng được với Natri? Viết PTHH.
Bài làm:
Chất phản ứng được với Na thì trong phân tử phải có nhóm –OH. Do đó, chỉ có CH3-CH2-OH mới có phản ứng với Na.
2CH3–CH2–OH + 2Na → 2CH3–CH2–ONa + H2
Câu 3. Có ba ống nghiệm sau đây:
– Ống 1 đựng rượu etylic
– Ống 2 đựng rượu 96°
– Ống 3 đựng nước
Cho Na dư vào các ống nghiệm trên, viết các PTHH.
Bài làm:
– Ống 1 đựng rượu etylic (chỉ có rượu):
2CH3CH2OH + 2Na → 2CH3CH2ONa + H2 ↑
– Ống 2 đựng rượu 96° (còn lại là nước):
2CH3CH2OH + 2Na → 2CH3CH2ONa + H2 ↑
2H2O + 2Na → 2NaOH + H2 ↑
– Ống 3 đựng nước:
2H2O + 2Na → 2NaOH + H2 ↑
Câu 4. Trên nhãn của chai rượu đều có ghi các số, thí dụ 45°,18°, 12°.
a) Hãy giải thích ý nghĩa của các số trên.
b) Tính số ml rượu etylic có trong 500 ml rượu 45°.
c) Có thể pha chế được bao nhiêu lít rượu 25° từ 500 ml rượu nguyên chất?
Bài làm:
a) Trên nhãn của chai rượu đều có ghi các số 45°, 18°, 12° nghĩa là rượu 45 độ, 18 độ và 12 độ. Tức là, trong 100 ml dung dịch rượu trên thì lần lượt có 45 ml, 18 ml, 12 ml dung dịch rượu nguyên chất.
b) Áp dụng công thức tính độ rượu:
Độ rượu = (VC2H5OH / Vdd rượu) x 100
Số ml rượu etylic có trong 500 ml rượu 45°:
VC2H5OH = (45 x 500) / 100 = 225 ml
c) Số lít rượu 25° được pha chế từ 500 ml rượu nguyên chất:
Độ rượu = (VC2H5OH / Vdd rượu) x 100
⇒ Vdd rượu = (VC2H5OH x 100) / Độ rượu = (500 x 100) / 25 = 2000 ml = 2 lít
Câu 5. Đốt cháy hoàn toàn 9,2 gam rượu etylic.
a) Tính thể tích khí CO2 tạo ra (ở đktc).
b) Tính thể tích không khí (ở đktc) cần dùng cho phản ứng trên, biết O2 chiếm 20% thể tích của không khí.
Bài làm:
a) Phương trình phản ứng cháy của rượu etylic:
C2H6O + 3O2 (t°) → 2CO2 + 3H2O
Ta có:
nC2H5OH = 9,2/46 = 0,2 (mol)
Theo PTHH, ta có: nCO2 = 2nC2H6O = 2 x 0,2 = 0,4 (mol)
⇒ VCO2 = 0,4 x 22,4 = 8,94 (lít)
b) Theo PTHH, ta có: nO2 = 3nC2H6O = 3 x 0,2 = 0,6 (mol)
⇒ VO2 = 0,6 x 22,4 = 13,44 (lít)
Vì O2 chỉ chiếm 20% thể tích không khí nên thể tích không khí cần dùng là:
V không khí = 13,44 x 100 / 20 = 67,2 (lít)
3 / 5 ( 10 bình chọn )Từ khóa » đặc điểm Cấu Tạo Của Etylic
-
Rượu Etylic - Tính Chất, Cấu Tạo Phân Tử, ứng Dụng Và điều Chế
-
Công Thức Cấu Tạo Của Rượu Etylic - Top Lời Giải
-
Lý Thuyết Rượu Etylic | SGK Hóa Lớp 9
-
Nêu Cấu Tạo Phân Tử Của Rượu Etylic
-
Tính Chất Hóa Học Của Rượu Etylic C2H5OH
-
Công Thức Rượu Etylic - Trường THPT Thành Phố Sóc Trăng
-
Ancol Etylic Là Gì? Phương Pháp điều Chế Và ứng Dụng Của Ancol Etylic
-
Rượu Etylic C2H6O Tính Chất Hoá Học, Công Thức Cấu ... - HayHocHoi
-
Ancol Etylic Là Gì? Tính Chất Hóa Học Và Ứng Dụng ... - Marathon
-
Tính Chất Hóa Học Của Rượu Etylic C2H6O. Công Thức Cấu Tạo Rượu ...
-
Bài 44. Rượu Etylic - Hoc24
-
Ancol Etylic Là Gì? Ứng Dụng Ancol Etylic Trong đời Sống
-
Ethanol – Wikipedia Tiếng Việt
-
Top 13 Công Thức Cấu Tạo Của Rượu Etylic - Ôn Thi HSG