Tính Nồng độ Ban đầu Của Dung Dich H2SO4 Và Dung Dịch NaOH ...
Có thể bạn quan tâm
HOC24
Lớp học Học bài Hỏi bài Giải bài tập Đề thi ĐGNL Tin tức Cuộc thi vui Khen thưởng- Tìm kiếm câu trả lời Tìm kiếm câu trả lời cho câu hỏi của bạn
Lớp học
- Lớp 12
- Lớp 11
- Lớp 10
- Lớp 9
- Lớp 8
- Lớp 7
- Lớp 6
- Lớp 5
- Lớp 4
- Lớp 3
- Lớp 2
- Lớp 1
Môn học
- Toán
- Vật lý
- Hóa học
- Sinh học
- Ngữ văn
- Tiếng anh
- Lịch sử
- Địa lý
- Tin học
- Công nghệ
- Giáo dục công dân
- Tiếng anh thí điểm
- Đạo đức
- Tự nhiên và xã hội
- Khoa học
- Lịch sử và Địa lý
- Tiếng việt
- Khoa học tự nhiên
- Hoạt động trải nghiệm
- Hoạt động trải nghiệm, hướng nghiệp
- Giáo dục kinh tế và pháp luật
Chủ đề / Chương
Bài học
HOC24
 Khách vãng lai Đăng nhập Đăng ký Khám phá Hỏi đáp Đề thi Tin tức Cuộc thi vui Khen thưởng
Khách vãng lai Đăng nhập Đăng ký Khám phá Hỏi đáp Đề thi Tin tức Cuộc thi vui Khen thưởng - Tất cả
- Toán
- Vật lý
- Hóa học
- Sinh học
- Ngữ văn
- Tiếng anh
- Lịch sử
- Địa lý
- Tin học
- Công nghệ
- Giáo dục công dân
- Tiếng anh thí điểm
- Hoạt động trải nghiệm, hướng nghiệp
- Giáo dục kinh tế và pháp luật
Câu hỏi
Hủy Xác nhận phù hợp Chọn lớp Tất cả Lớp 12 Lớp 11 Lớp 10 Lớp 9 Lớp 8 Lớp 7 Lớp 6 Lớp 5 Lớp 4 Lớp 3 Lớp 2 Lớp 1 Môn học Toán Vật lý Hóa học Sinh học Ngữ văn Tiếng anh Lịch sử Địa lý Tin học Công nghệ Giáo dục công dân Tiếng anh thí điểm Đạo đức Tự nhiên và xã hội Khoa học Lịch sử và Địa lý Tiếng việt Khoa học tự nhiên Hoạt động trải nghiệm Hoạt động trải nghiệm, hướng nghiệp Giáo dục kinh tế và pháp luật Mới nhất Mới nhất Chưa trả lời Câu hỏi hay
- Đỗ Phương Thảo
help me
Bài 1: Tính nồng độ ban đầu của dung dich H2SO4 và dung dịch NaOH biết rằng:
-Nếu đổ 3 lít dung dịch NaOH vao 2 lít dung dịch H2SO4 thì sau phản ứng dung dich có tính kiềm với nồng độ 0,1M
-nếu đổ 2 lít dung dịch NaOH vào 3 lít dung dịch H2SO4 thì sau phản ứng dung dịch có tính axit với nồng độ 0,2M
Xem chi tiết Lớp 9 Hóa học Bài 56. Ôn tập cuối năm 2 0 Gửi Hủy
Gửi Hủy  Lê Nguyên Hạo
Lê Nguyên Hạo  14 tháng 7 2016 lúc 10:01
14 tháng 7 2016 lúc 10:01 Gọi CM H2SO4 = a là M. CMNaOH = b là M- Nếu đổ 3 lít dung dịch NaOH vào 2 lít dung dịch H2SO4 thì khau khi phản ứng dung dịch có tính kiềm với nồng độ 0,1M=> 3.b - 2.2a = 0,1.(2+3) =0,5- Nếu đổ 2 lít dung dịch NaOH vào 3 lít dung dịch H2SO4 thì khau khi phản ứng dung dịch có tính axit với nồng độ 0,2M=> 3.2.a-2b = 5.0,2 = 1=> a=0,4b = 0,7
Đúng 0 Bình luận (2) Gửi Hủy
Gửi Hủy  Trương Hồng Hạnh
Trương Hồng Hạnh  5 tháng 4 2019 lúc 19:57
5 tháng 4 2019 lúc 19:57 
 Gửi Hủy
Gửi Hủy 
- Trung Vũ
Tính nồng độ ban đầu của dung dich H2SO4 và dung dịch NaOH biết rằng:
-Nếu đổ 3 lít dung dịch NaOH vao 2 lít dung dịch H2SO4 thì sau phản ứng dung dich có tính kiềm với nồng độ 0,1M
-nếu đổ 2 lít dung dịch NaOH vào 3 lít dung dịch H2SO4 thì sau phản ứng dung dịch có tính axit với nồng độ 0,2M
Xem chi tiết Lớp 9 Hóa học Bài 56. Ôn tập cuối năm 1 0 Gửi Hủy
Gửi Hủy  Trương Hồng Hạnh
Trương Hồng Hạnh  5 tháng 4 2019 lúc 19:42
5 tháng 4 2019 lúc 19:42 2NaOH + H2SO4 => Na2SO4 + 2H2O
Gọi a,b (M) lần lượt là nồng độ của dd H2SO4, NaOH
TH1:
Số mol NaOH = 3a (mol)
Số mol H2SO4 = 2b (mol)
Có tính kiềm ===> NaOH dư
Theo đề bài, ta có:
3a - 4b = 0.1x5 = 0.5 (1)
TH2:
Số mol NaOH = 2a (mol)
Số mol H2SO4 = 3b (mol)
Có tính axit => H2SO4 dư
Theo đề bài ta có:
-a + 3b = 0.2 x 5 = 1 (2)
Từ (1) và (2) ta suy ra: a = 1.1, b = 0.7
Đúng 1 Bình luận (0) Gửi Hủy
Gửi Hủy 
- Trung Vũ
Tính nồng độ ban đầu của dung dich H2SO4 và dung dịch NaOH biết rằng:
-Nếu đổ 3 lít dung dịch NaOH vao 2 lít dung dịch H2SO4 thì sau phản ứng dung dich có tính kiềm với nồng độ 0,1M
-nếu đổ 2 lít dung dịch NaOH vào 3 lít dung dịch H2SO4 thì sau phản ứng dung dịch có tính axit với nồng độ 0,2M
Xem chi tiết Lớp 8 Hóa học CHƯƠNG VI: DUNG DỊCH 0 0 Gửi Hủy
Gửi Hủy 
- mai giang
Trộn 120ml dung dịch H2SO4 với 40ml dung dịch NaOH. Dung dịch sau khi trộn chứa 1 muối axit ( NaHSO4) và còn dư axit có nồng độ 0,1M. Mặt khác nếu trộn 60ml dung dịch H2SO4 với 60ml dung dịch NaOH này thì trong dung dịch sau khi trộn còn dư NaOH với nồng độ 0,16M. Tìm nồng độ mol của 2 dung dịch ban đầu.![]()
 Gửi Hủy
Gửi Hủy  Lê Nguyên Hạo
Lê Nguyên Hạo  12 tháng 8 2016 lúc 11:01
12 tháng 8 2016 lúc 11:01 Gọi a, b là CM của H2SO4, NaOH. + TN1: NaOH pứ hết, H2SO4 dư nH2SO4 = 0.12a => nH+ = 0.24a nNaOH = 0.04b => nOH- = 0.04b nH2SO4 dư = 0.1*(0.12 + 0.04) = 0.016 => nH+ dư = 0.032 2H+ ... +.... OH- + SO4(2-) -----> HSO4- + H2O 0.08b.........0.04b nH+ dư = 0.24a - 0.08b = 0.032 (1) + TN2: H2SO4 pứ hết, NaOH dư nH2SO4 = 0.04a => nH+ = 0.08a nNaOH = 0.06b => nOH- = 0.06b nNaOH dư = 0.16*(0.04 + 0.06) = 0.016 => nOH- dư = 0.016 H+ + OH- ------> H2O 0.08a....0.08a => nOH- dư = 0.06b - 0.08a = 0.016 (2) Từ (1) và (2) => a = 0.4, b = 0.8
Đúng 0 Bình luận (0) Gửi Hủy
Gửi Hủy 
- Nguyễn Hoàng Nam
Thêm 25 ml dung dịch NaOH 2M vào 100 ml dung dịch H2SO4. Đem dung dịch thu được cho tác dụng với dung dịch NaHCO3 dư thu được 5,6 lít CO2 (đktc). Nồng độ mol/lít của dung dịch H2SO4 ban đầu là:
A. 1,5M
B. 1,75M
C. 1,25M
D. 1M
Xem chi tiết Lớp 11 Hóa học 1 0 Gửi Hủy
Gửi Hủy  Ngô Quang Sinh
Ngô Quang Sinh  26 tháng 3 2019 lúc 12:15
26 tháng 3 2019 lúc 12:15 Đáp án A
2NaOH + H2SO4 → Na2SO4 + 2H2O
0,05 → 0,025 ( mol)
nCO2 =0,25 mol
H2SO4 + 2NaHCO3 → Na2SO4 + 2H2O + 2CO2
0,125 ← 0,25 (mol)
⇒ nH2SO4 ban đầu = 0,025 + 0,125 =0,15mol
⇒ CM H2SO4 ban đầu = 1,5
Đáp án A.
Đúng 0 Bình luận (0) Gửi Hủy
Gửi Hủy 
- Trần Ngọc Yến Vy
Cho 200 ml dung dịch NaOH phản ứng hoàn toàn với 350 ml dung dịch H2SO4 2M
a) Tính nồng độ mol/lit của dung dịch NaOH ban đầu?
b) Tính nồng độ mol/lit của dung dịch sau phản ứng?
Xem chi tiết Lớp 9 Hóa học 1 1 Gửi Hủy
Gửi Hủy  hnamyuh
hnamyuh  12 tháng 10 2021 lúc 11:44
12 tháng 10 2021 lúc 11:44 a) $n_{H_2SO_4} = 0,35.2 = 0,7(mol)$$2NaOH + H_2SO_4 \to Na_2SO_4 + 2H_2O$
Theo PTHH :
$n_{NaOH} = 2n_{H_2SO_4} = 1,4(mol) \Rightarrow C_{M_{NaOH}} = \dfrac{0,7}{0,2} = 3,5M$
b) $V_{dd\ sau\ pư} = 0,2 + 0,35 = 0,55(lít)$$C_{M_{Na_2SO_4}} = \dfrac{0,7}{0,55} = 1,27M$
Đúng 2 Bình luận (0) Gửi Hủy
Gửi Hủy 
- Ngọc Hân
cho 15.5gam Naoh vào nước. Thu được 0.5 lít dung dịch kiềm
a)tính nồng độ mol của dung dịch kiềm.
B)tính thể tích dung dịch H2So4 20% ( D=1.14gam/ml) để trung hoà dung dịch kiềm nói trên.
Xem chi tiết Lớp 9 Hóa học 1 0 Gửi Hủy
Gửi Hủy  hnamyuh
hnamyuh  13 tháng 8 2021 lúc 8:31
13 tháng 8 2021 lúc 8:31 a) $n_{NaOH} = \dfrac{15,5}{40} = 0,3875(mol)$$C_{M_{NaOH}} = \dfrac{0,3875}{0,5} =0,775M$b)
$2NaOH + H_2SO_4 \to Na_2SO_4 + H_2$
$n_{H_2SO_4} = \dfrac{1}{2}n_{NaOH} = 0,19375(mol)$$m_{dd\ H_2SO_4} =\dfrac{0,19375.98}{20\%} = 94,9375(gam)$$V_{dd\ H_2SO_4} = \dfrac{94,9375}{1,14} = 83,28(ml)$
Đúng 1 Bình luận (0) Gửi Hủy
Gửi Hủy 
- Anh Phan
Để trung hòa 50 ml dung dịch H2SO4 phải dùng hết 150 ml dung dịch NaOH 0,06M.a. Tính nồng độ mol/lít của dd H2SO4 banđầu.b. Tính nồng độ mol/lít của các ion trong dung dịch thu được.
Xem chi tiết Lớp 11 Hóa học Bài 1: Sự điện li 1 0 Gửi Hủy
Gửi Hủy  Hồng Phúc
Hồng Phúc  18 tháng 9 2021 lúc 19:09
18 tháng 9 2021 lúc 19:09 a, \(n_{H^+}=n_{OH^-}=9.10^{-3}\left(mol\right)\Rightarrow C_{M\left(H_2SO_4\right)}=\dfrac{\dfrac{9.10^{-3}}{2}}{0,05}=0,09M\)
b, \(\left[SO_4^{2-}\right]=\dfrac{4,5.10^{-3}}{0,05+0,15}=0,6M\)
\(\left[Na^+\right]=\dfrac{0,15.0,06}{0,05+0,15}=0,045M\)
\(\left[H^+\right]=\left[OH^-\right]=\dfrac{9.10^{-3}}{0,05+0,15}=0,045M\)
Đúng 1 Bình luận (0) Gửi Hủy
Gửi Hủy 
- Trương Minh Nghĩa 6a2
Nhỏ từ từ dung dịch NaOH 1 m vào 50 ml vào dung dịch H2SO4 khi H2SO4 được trung hòa hoàn toàn thì thấy dùng hết 40 ml dung dịch NaOH A viết BTHH của phản ứng Tính nồng độ dung dịch H2SO4 ban đầu Nêu cách nhận biết thời điểm H2SO4 trung hòa hoàn toàn
Xem chi tiết Lớp 9 Hóa học 1 0 Gửi Hủy
Gửi Hủy  乇尺尺のレ
乇尺尺のレ  8 tháng 9 2023 lúc 23:18
8 tháng 9 2023 lúc 23:18 \(A.2NaOH+H_2SO_4\rightarrow Na_2SO_4+H_2O\\ n_{NaOH}=0,04.1=0,04mol\\ n_{H_2SO_4}=0,04:2=0,02mol\\ C_{M\left(H_2SO_4\right)}=\dfrac{0,02}{0,05}=0,4M\)
Cho quỳ tím vào dd \(H_2SO_4\) rồi nhỏ từ từ dd \(NaOH\) vào. Đến khi thấy quỳ tím từ màu đỏ trở về màu tím thì đó là thời điểm \(H_2SO_4\) được trung hoà hoàn toàn.
Đúng 4 Bình luận (2) Gửi Hủy
Gửi Hủy 
- Jess Nguyen
Cho 200g dung dịch Ba(OH)2 10o/o vào 200g dung dịch H2SO4. lọc bỏ kết tủa, trung hòa nước lọc cần dùng 250ml NaOH 25 o/o d = 1,28. Tính nồng độ o/o của dung dịch H2SO4 ban đầu và nồng độ o/o của dung dịch sau phản ứng?
Xem chi tiết Lớp 9 Hóa học 1 1 Gửi Hủy
Gửi Hủy  Vũ Trọng Hiếu
Vũ Trọng Hiếu  11 tháng 3 2022 lúc 20:12
11 tháng 3 2022 lúc 20:12 Em ko có tiền nên mong a , cj tham khảo(đây là 500 g dung dịch nên mong a, cj sửa 1 chút ạ)
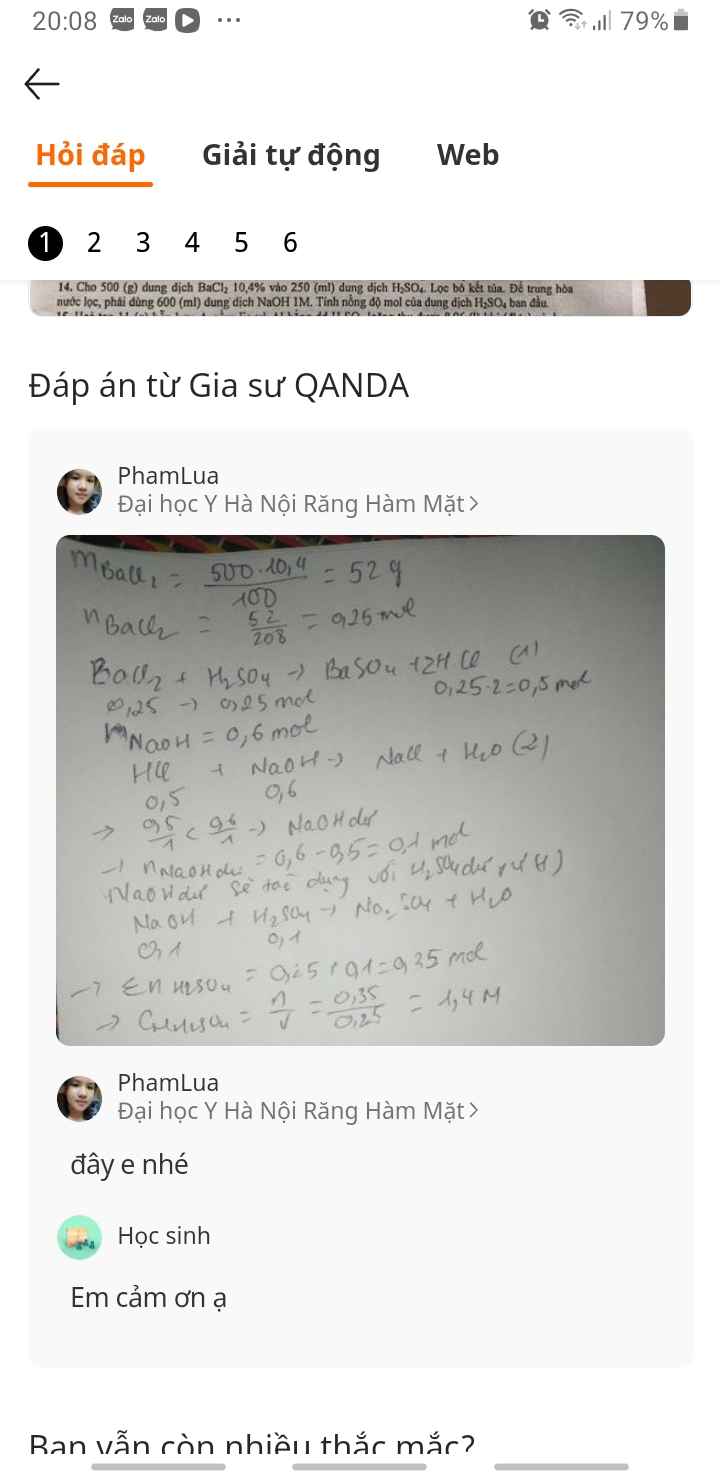
 Gửi Hủy
Gửi Hủy Từ khóa » Tính Nồng độ Mol Của Dung Dịch H2so4 Và Naoh
-
Tính Nồng độ Mol Của Dd NaOH Và Dd H2SO4 Biết Rằng
-
Tính Nồng độ Mol Của Dung Dịch H2SO4 Và Dung Dịch NaOH Biết: +) 3
-
Tính Nồng độ Mol/l Của Dd H2SO4 Và Dd NaOH - Dương Minh Tuấn
-
Tính Nồng độ Mol Của Dd H2SO4 Và NaOH - Nguyễn Bảo Trâm
-
Tính Nồng độ Mol/l Của Dung Dịch H2SO4 Và NaOH Biết Rằng
-
Tính Nồng độ Mol Của Dung Dịch H2SO4 Và NaOH - Thả Rông
-
Tính Nồng độ Mol Của Dd H2SO4 Và NaOH Dùng Trong Phòng Thí ...
-
Tính Nồng độ Mol Của Dung Dịch H2SO4 Và Dung Dịch NaOH
-
Tính Nồng độ Mol Của Dung Dịch H2SO4 Và Dung Dịch NaOH Biết
-
A, Tính Nồng độ Mol Của Dung Dịch NaOH 20% (D = 1,2 G ...
-
Tính Nồng độ Mol Ban đầu Của Dung Dịch H2SO4 (A ...
-
Tính Nồng độ Mol Của Dung Dịch H2SO4 Và Dung Dịch NaOH Biết: +) ...
-
Tính Nồng độ Mol/l Của Dung Dịch H2SO4 Và ...
-
Tính Nồng độ Mol Của Dung Dịch H2SO4 Và Dung Dịch NaOH Biết