Tổng Hợp Các Phương Trình Hóa Hữu Cơ 11 Đầy Đủ Nhất
Có thể bạn quan tâm
Hóa hữu cơ 11 là một trong những phần kiến thức trọng tâm trong chương trình Hóa học cấp 3. Lý thuyết xoay quanh chủ đề này có tính ứng dụng cao, là nền tảng để học tốt mảng Hóa hữu cơ lớp 12. Các em hãy cùng Marathon Education đọc ngay bài viết bên dưới đây để ôn tập về lý thuyết cơ bản và các phương trình Hóa hữu cơ 11 thường gặp.
>>> Xem thêm: Tổng Hợp Lý Thuyết Đại Cương Về Hóa Hữu Cơ
Khái quát về Hóa hữu cơ 11
Khái niệm
Hợp chất hữu cơ được định nghĩa là các hợp chất của cacbon (trừ oxit của cacbon, muối cacbua, muối cacbonat, muối xianua).
Phân loại các hợp chất hữu cơ
Trong chương trình Hóa hữu cơ 11, hợp chất hữu cơ sẽ được phân loại thành 2 nhóm, đó chính là hiđrocacbon và dẫn xuất của hidrocacbon.
Hidrocacbon là loại hợp chất hữu cơ đơn giản nhất. Trong thành phần phân tử chỉ chứa hai nguyên tố là cacbon và hidro.
- Hidrocacbon mạch hở:
- Hidrocacbon no: Ankan
- Hidrocacbon không no có một nối đôi: Anken
- Hidrcacbon không no có hai nối đôi: Ankadien
- Hidrocacbon mạch vòng:
- Hidrocacbon no: Xicloankan
- Hidrocacbon mạch vòng: Aren
Dẫn xuất của hidrocacbon là các hợp chất mà trong phân tử của chất này ngoài C, H ra còn có một số hay nhiều nguyên tố khác như O, N, S, halogen…
- Dẫn xuất halogen: R – X (R là gốc hidrocacbon)
- Hợp chất chứa nhóm chức: – OH – : ancol; – O – : ete; – COOH: axit…
>>> Xem thêm:
Bảng Tuần Hoàn Các Nguyên Tố Hóa Học Lớp 8, 9, 10 Cách Đọc Và Mẹo Nhớ Nhanh
Các công thức tính thể tích hóa học bạn cần nắm rõBảng Hóa Trị Lớp 8 Về Các Nguyên Tố Hóa Học Thường Gặp Và Bài Ca Hóa Trị
Đặc điểm chung
- Hợp chất hữu cơ nhất thiết phải có sự góp mặt của 2 nguyên tố chính là C và H. Ngoài ra, hợp chất hữu cơ có thể chứa các nguyên tố khác như O, N, P, halogen…
- Liên kết chủ yếu có trong hợp chất hữu cơ là liên kết cộng hóa trị.
- Các hợp chất hữu cơ hầu hết đều dễ bay hơi, dễ cháy cũng như kém bền với nhiệt.
- Các phản ứng trong hoá học hữu cơ thường chậm và không hoàn toàn. Những phản ứng này thường xảy ra trong điều kiện phải đun nóng và có các chất xúc tác.
>>> Xem thêm: Dãy Hoạt Động Hóa Học Của Kim Loại Là Gì? Ý Nghĩa Và Mẹo Nhớ Nhanh

Các phương trình trong chương trình Hóa hữu cơ 11
Dưới đây là một số phương trình hóa học trong chương trình Hóa hữu cơ 11 mà các em cần thuộc nằm lòng.
Ankan
- Phản ứng thế của ankan
- Phản ứng tách và oxi hóa của ankan
- Phản ứng điều chế ankan
Anken
- Phản ứng cộng vào liên kết đôi
- Phản ứng điều chế anken
Ankin
- Phản ứng cộng của ankin
- Phản ứng trùng hợp của ankin
- Phản ứng thế của ankin
Ankin + AgNO3: Dẫn khí axetilen vào dung dịch hỗn hợp AgNO3/NH3 thu được kết tủa màu vàng.
CH\equiv CH+2AgNO_3+2NH_3\to CAg\equiv CAg+2NH_4NO_3- Phản ứng điều chế ankin
Ankađien
- Phản ứng cộng của ankađien
- Phản ứng điều chế ankađien
Benzen
- Phản ứng thế của benzen
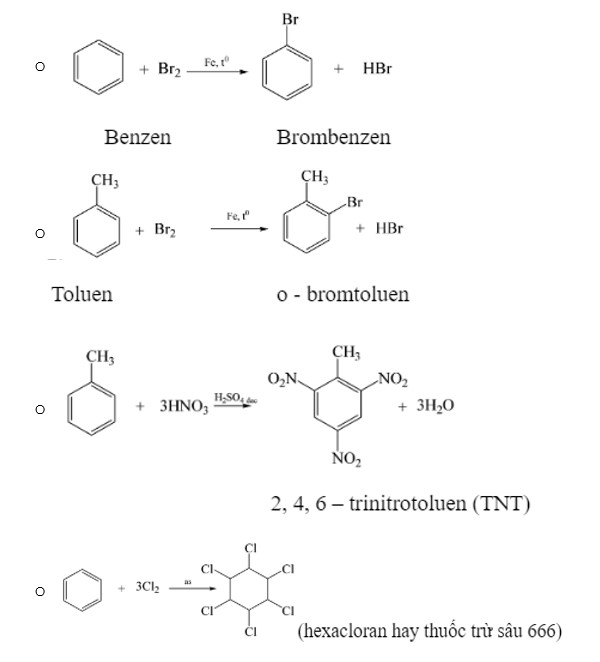
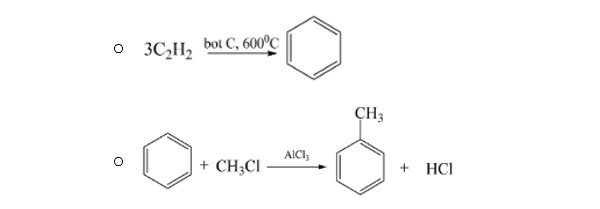
- Phản ứng điều chế benzen
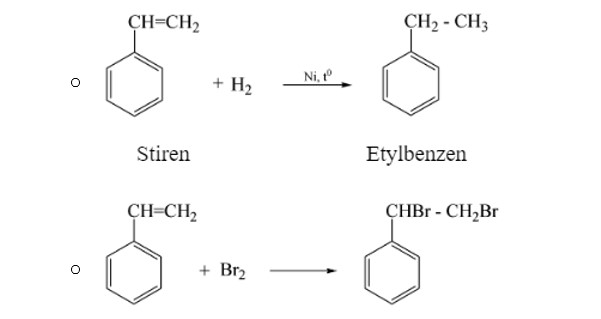
Stiren
Sitren vừa có tính chất giống anken (nối đôi ở nhánh), vừa có tính chất giống benzen (có vòng thơm).
- Phản ứng cộng của stiren
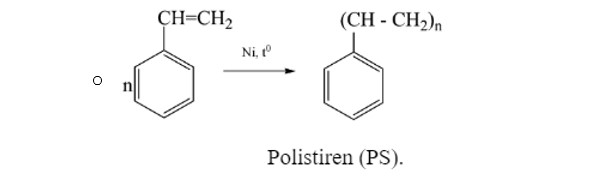
- Phản trùng hợp của stiren
Ancol
- Phản ứng đặc trưng của ancol
- Phản ứng điều chế ancol
Phenol
- Phản ứng đặc trưng của phenol
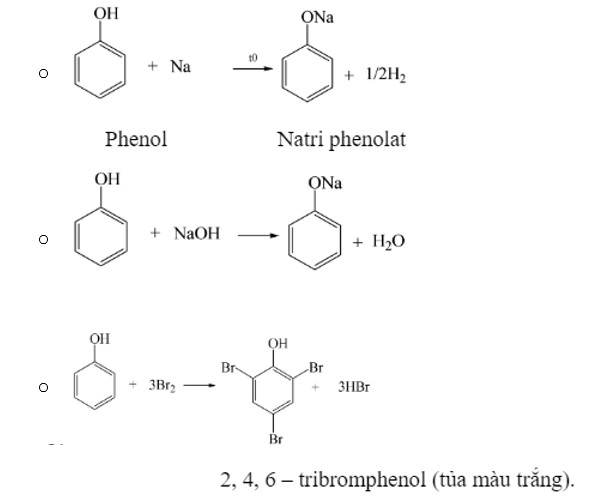
- Phản ứng điều chế phenol
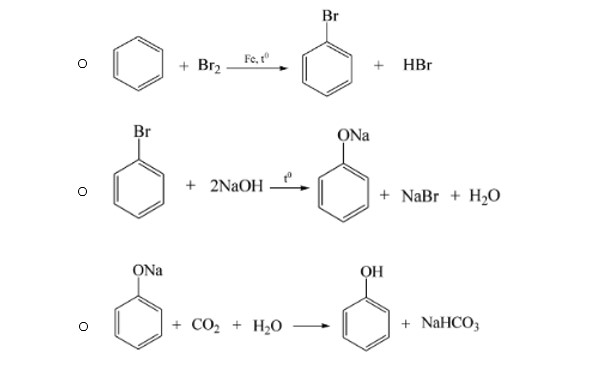
Anđehit
- Phản ứng đặc trưng của anđehit
- Phản ứng điều chế anđehit
Xeton
- Phản ứng đặc trưng của xeton
- Phản ứng điều chế xeton
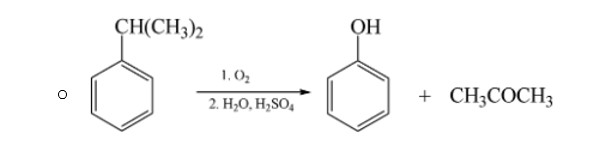
Axit hữu cơ
Axit hữu cơ thường là axit yếu. Tuy nhiên, những axit này vẫn có đầy đủ các tính chất hóa học của một axit và một số tính chất khác.
\begin{aligned} &\bull CH_3COOH+Na\to CH_3COONa+12H_2\\ &\bull CH_3COOH+NaOH\to CH_3COONa+H_2O\\ &\bull 2CH_3COOH+CaCO_3\to (CH_3COO)_2Ca+CO_2+H_2O\\ &\bull 2CH_3COOH+MgO\to (CH_3COO)_2Mg+H_2O\\ &\bull CH_3COOH+C_2H_5OH \xrightarrow[H^+]{t^o}CH_3COOC_2H_5+H_2O\\ &\bull CH_3OH+CO \xrightarrow{t^o}CH_3COOH\\ &\bull C_2H_5OH+O_2 \xrightarrow{men\ giấm}CH_3COOH+H_2O\\ &\bull 2CH_3CHO+O_2 \xrightarrow[xt]{t^o}2CH_3COOH\\ &\bull 2CH_3CH_2CH_3CH_2+5O_2\xrightarrow[xt]{t^o}4CH_3COOH+2H_2O \end{aligned}Gia sư Online Ứng dụng, điều chế và tính chất hóa học của Lưu huỳnh Học Online Toán 12 Học Online Hóa 10 Học Online Toán 11 Học Online Toán 6 Học Online Toán 10 Học Online Toán 7 Học Online Lý 10 Học Online Lý 9 Học Online Toán 8 Học Online Toán 9 Học Tiếng Anh 6 Học Tiếng Anh 7Tham khảo ngay các khoá học online của Marathon Education
Hóa hữu cơ 11 đóng vai trò nền tảng và là phần kiến thức quan trọng trong chương trình cấp 3. Hy vọng sau khi đọc xong bài viết, các em sẽ hệ thống lại kiến thức đã học một cách tốt hơn.
Hãy liên hệ ngay với Marathon để được tư vấn nếu các em có nhu cầu học online nâng cao kiến thức nhé! Marathon Education chúc các em được điểm cao trong các bài kiểm tra và kỳ thi sắp tới!
Từ khóa » Bài Tập Viết Phương Trình Hóa Học Hữu Cơ 11
-
Chuỗi Phản ứng Hóa Học Hữu Cơ Lớp 11 Hay Có đáp án
-
Hướng Dẫn Giải Bài Tập Chuỗi Phản Ứng Hóa Hữu Cơ ... - Kiến Guru
-
Tổng Hợp Phương Trình Hoá Học Lớp 11 Hoá Hữu Cơ Đầy Đủ Nhất
-
Bài Tập Chuỗi Phản ứng Hóa Hữu Cơ 11 - 123doc
-
Chỉ Một Sơ đồ – Nhớ được 38 Phương Trình Hóa Hữu Cơ ôn Thi HK II
-
Chuỗi Phản ứng Hóa Học Hữu Cơ Lớp 11
-
Hướng Dẫn Giải Bài Tập Chuỗi Phản Ứng Hóa Hữu ... - ThiênBảo Edu
-
Chuỗi Phương Trình Hóa Học Lớp 11
-
Bài Tập Chuỗi Phản ứng Hóa Học Hữu Cơ ( Hóa Lớp 11) - YouTube
-
Chuỗi Phản ứng Hóa Học Hữu Cơ Lớp 11
-
Bài Tập Về Chuỗi Phản ứng Hóa Học Hữu Cơ Và Cách Giải Hay, Chi Tiết
-
Cách Viết Phương Trình Hóa Học Hữu Cơ, Chỉ Một Sơ Đồ
-
Bài Tập 9.36 Trang 70 SBT Hóa 11: Viết Phương Trình Hóa Thưc Hiện ...