Tổng Hợp Kiến Thức Hóa Vô Cơ ôn Thi Tốt Nghiệp THPT
Có thể bạn quan tâm

Bên cạnh các chuyên đề về hóa hữu cơ thì hóa vô cơ cũng là phần kiến thức rất quan trọng trong quá trình ôn thi tốt nghiệp THPT môn Hóa. Đây là phần kiến thức mang tính hệ thông xuyên suốt cả quá trình học tại bậc THPT. Chính vì vậy, việc nắm vững kiến thức của chuyên đề này sẽ giúp các bạn có sự logic giúp ích rất nhiều trong việc ghi nhớ cũng như tiếp nhận những kiến thức tham khảo, nâng cao. Luyenthidgnl xin được chia sẻ về toàn bộ kiến thức hóa vô cơ ôn thi tốt nghiệp THPT để các bạn có thể nắm được!
TỔNG HỢP KIẾN THỨC HÓA VÔ CƠ ÔN THI THPT QUỐC GIA
I. KIẾN THỨC VỀ CHẤT LƯỠNG TÍNH
1. Các chất/Ion lưỡng tính
- Chất hoặc Ion lưỡng tính là tập hợp những chất/ion vừa có khả năng co đi vừa có khả năng nhận lại các proton ( H+)
- Từ đó, ta có thể suy ra được Chất/ ion lưỡng tính vừa có khả năng tác dụng với các dung dịch axit (như H2SO4 loãng, HCl,…), vừa khả năng tác dụng với các dung dịch có tính bazơ (như NaOH, KOH hay Ba(OH)2…)
Lưu ý: Các chất/ion lưỡng tính có vừa tác dụng được với axit và bazo nhưng các chất vừa tác dụng được với dung dịch axit, vừa tác dụng được với các dung dịch bazo lại chưa chắc là chất lưỡng tính. Ví dụ: Al, Pb, Zn, Sn, Be
2. Các chất lưỡng tính thường gặp trong đề thi tốt nghiệp THPT
- Các loại Oxit như:Al2O3, PbO, ZnO, BeO, SnO, Cr2O3
- Các loại Hidroxit như: Al(OH)3, Zn(OH)2, Be(OH)2, Pb(OH)2, Cr(OH)3…
- Các loại muối chứa ion lưỡng tính như: Muối HS-, HCO3-, HSO3-,…
- Các loại muối amoni của các axit yếu như: (NH4)2CO3, (NH4)2SO3, (NH4)2S, CH3COONH4…
3. Các phản ứng hóa học của chất lưỡng tính với các dd HCl, NaOH-
a. Các Oxit
* Phản ứng với HCl
X2O3 + 6HCl → 2MCl3 + 3X2O3
YO + 2HCl → YCl2 + H2O
* Phản ứng với NaOH
X2O3 + NaOH → NaXO2 + 2H2O
YO + 2NaOH → Na2YO2 + H2O
b. Các hidroxit lưỡng tính
* Phản ứng với HCl
X(OH)3 + 3HCl →XCl3 + 3H2O
X(OH)2+ 2HCl → YCl2 + 2H2O
* Phản ứng với NaOH
X(OH)3 + NaOH → NaXO2 + 2H2O
Y(OH)2 + 2NaOH → Na2YO2 + 2H2O
c. Muối chứa ion lưỡng tính
* Phản ứng với HCl
HCO3– + H+ → H2O +CO2
HSO3– + H+ → H2O +SO2
HS- + H+ → H2S
* Phản ứng với NaOH
HCO3– + OH- → CO32-+ H2O
HSO3– + OH- → SO32- + H2O
HS- + OH- → S2- + H2O
d. Muối của nhóm NH4+ tác dụng với các loại axit yếu
* Phản ứng với HCl
(NH4)2RO3 + 2HCl → 2NH4Cl + H2O + RO2 ( trong đó R là S hoặc C)
(NH4)2S + 2HCl → 2NH4Cl + H2S
* Phản ứng với NaOH
NH4+ + OH- → NH3 + H2O
Lưu ý: Đối với các kim loại như Al, Zn, Be, Sn, Pb mặc dù không phải là các chất lưỡng tính nhưng cũng có phản ứng hóa học với cả axit và dung dịch bazo. Phương trình phản ứng hóa học có dạng:
M + nHCl → (n/2)MCln + H2
M + (4 – n)NaOH + (n – 2) H2O → Na4-nMO2+ (n/2)H2
Trong đó:
- M là các kim loại: Al, Zn, Be, Sn, Pb
- n là khóa trị của kim loại
II. MÔI TRƯỜNG CỦA CÁC DUNG DỊCH MUỐI
1. Các loại muối trung hòa
Muối trung hòa được tạo ra từ cation của các loại bazo mạnh kết hợp với các anion của các gốc axit mạnh không bị thủy phân.
Dung dịch thu được từ sự kết hợp này có tính trung hòa (tức là có độ pH = 7)
Một số loại muối trung hòa có thể kể đến:NaNO3, Na2SO4 hay KCL,…
- Muối trung hòa tạo bởi cation của bazo mạnh và anion của gốc axit yếu bị thủy phân => Dung dịch thu được sẽ có môi trường bazơ (có độ pH > 7) VD: NaNO3, K2S…
- Muối trung hòa tạo bởi cation của bazo yếu và anion gốc axit mạnh bị thủy phân => Dung dịch thu được sẽ có môi trường axit (có độ pH < 7) VD:NH4Cl, CuSO4 và AlCl3
- Muối trung hòa tạo bởi cation của bazơ yếu và anion của gốc axit yếu bị thủy phân (cả hai đều bị thủy phân) => Trong trường hợp này tùy thuộc vào độ thủy phân của hai ion mà ta có dung dịch có độ pH = 7, pH > 7 hoặc pH < 7
2. Muối axit
Các loại muối có gốc axit SO4– đều có môi trường axit (độ pH < 7)
Ví dụ: muối NaHSO4…
Muối HCO3-, HSO3-, HS- với cation bazơ mạnh có môi trường bazơ
Ví dụ: muối NaHCO3,…
III. NHỮNG CHẤT PHẢN ỨNG HÓA VÔ CƠ VỚI NƯỚC Ở NHIỆT ĐỘ THƯỜNG
1. Các chất phản ứng với H2O ở nhiệt độ thường.
- Các kim loại Kiềm+ như Ca, Sr, Ba có khả năng tác dụng với H2O ngay ở nhiệt độ thường tạo bazơ + Hidro
- Oxit của các kim loại kiềm và CaO, SrO, BaO tác dụng với H2O ở nhiệt độ thông thường thường tạo bazo
- Các loại oxit như: CO2, SO2, SO3, P2O5, N2O5, NO2 tác dụng với H2O ở nhiệt độ bình thường cho ra sản phẩm là các axit
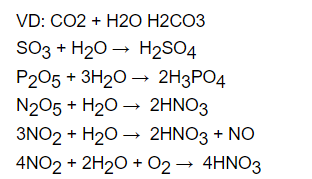
- Các chất khí như HCl, HBr, HI, H2S là những chất không có tính axit. Tuy nhiên khi hòa tan với nước trong điều kiện nhiệt độ thường lại ra các axit với các gốc tương ứng.
- Khí NH3 tác dụng với H2O rất yếu: NH3 + H2O -> NH4 + OH-.
- Một hợp chất muối của các cation Al3+, Zn2+, Fe3+ với các anion gốc axit yếu như CO32-, HCO3-, SO32-, HSO3, S2-, HS- bị thủy phân tạo bazơ + axit tương ứng.
2. Tác dụng với H2O ở nhiệt độ cao.
Trong điều kiện nhiệt độ cao, khả năng phản ứng của các chất vơi nước cũng tăng lên, tuy nhiên, các bạn cần chú ý phản ứng sau trong quá trình làm bài để tránh nhầm lẫn hoặc sai:
IV. NƯỚC CỨNG
1. Khái niệm
- Nước cứng là các dung dịch có nhiều chứa nhiều cation Ca2+ và Mg2+
- Trái ngược với nước cứng, nước mềm là các dung dịch chứa ít hoặc không có cation Ca2+ và Mg2+
2. Phân loại
Dựa vào đặc anion trong nước cứng người ta chia nước cứng là 3 loại chính:
- Nước cứng tạm thời là nước cứng có chứa các ion HCO3- (dạng muối Ca(HCO3)2 hay Mg(HCO3)2) +Nước cứng tạm thời khi bị đun nóng sẽ làm mất tính cứng của nước
- Nước cứng vĩnh cửu là nước cứng có chứa các ion Cl-, SO42- (dạng muối CaCl2, MgCl2, CaSO4 hay MgSO4) +Khi bị đun nóng, nước cứng vĩnh cửu không bị mất tính cứng
- Nước cứng toàn phần chứa cả các anion HCO3- lẫn Cl-, SO42-. +Khi bị đun nóng, nước cứng toán phần sẽ bị giảm tính cứng
3. Những tác động của nước cứng
- Nước cứng có thể làm hỏng các loại ống dẫn nước, nồi hơi
- Nếu nấu ăn bằng nước cứng có thể gây giảm mùi vị của thức năm
- Nước cứng làm giảm hiệu quả của xà phòng
4. Phương pháp làm mềm nước cứng
Thông thường, người ta sẽ sử dụng phương pháp tạo kết tủa để làm giảm nồng độ CO32-, PO43- Đó chính là phương pháp làm mềm nước cứng
Đối với mọi loại nước cứng ta dùng Na2CO3 và Na3PO4 để làm mềm nước. Phản ứng hóa học trong quá trình làm mềm nước như sau:
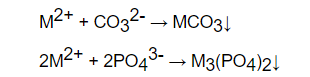
Đối với loại nước cứng tạm thời, bên cạnh phương pháp sử dụng Na2CO3 và Na3PO4 ta có thể dùng thêm NaOH hoặc Ca(OH)2 vừa đủ hoặc đung nóng
+ Dùng NaOH vừa đủ.
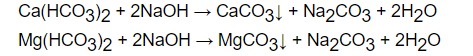
+ Dùng Ca(OH)2 vừa đủ
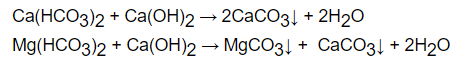
+ Đun sôi nước để phân hủy Ca(CaHCO3)2 và Mg(CaHCO3)2 tạo thành muối cacbonat kết tủa để giảm độ cứng của nước.
VI. ĂN MÒN CÁC CHẤT KIM LOẠI
- Ăn mòn kim loại: là sự phá hủy kim loại do tác dụng của các chất trong môi trường – Ăn mòn kim loại có 2 dạng chính: ăn mòn hóa học và ăn mòn điện hóa.
- Ăn mòn hóa học: là quá trình oxi hóa khử, trong đó các electron của kim loại được chuyển trực tiếp đến các chất trong môi trường. – Ăn mòn hóa học thường xảy ra ở những bộ phận của thiết bị lò đốt hoặc những thiết bị thường xuyên phải tiếp xúc vớ hơi nước và khí oxi… Kinh nghiệm: nhận biết ăn mòn hóa học, ta thấy ăn mòn kim loại mà không thấy xuất hiện cặp kim loại hay cặp KL-C thì đó là ăn mòn kim loại.
- Ăn mòn điện hóa: là quá trình oxi hóa khử, trong đó kim loại bị ăn mòn do tác dụng của dung dịch chất điện li và tạo nên đong electron chuyển dời từ cực âm đến cực dương.
– Điều kiện để xảy ra ăn mòn điện hóa: phải thỏa mãn đồng thời 3 điều sau + Các điện cực phải khác nhau về bản chất + Các định cực phải tiếp xúc trực tiếp hoặc gián tiếp với nhau qua dây dẫn + Các điện cực cùng tiếp xúc với dung dịch chất điện li
– Ăn mòn điện hóa thường xảy ra khi cặp kim loại ( hoặc hợp kim) để ngoài không khí ẩm, hoặc nhúng trong dung dịch axit, dung dịch muối, trong nước không nguyên chất… 4. Các biện pháp chống ăn mòn kim loại.
a. Phương pháp bảo vệ bề mặt
– Phủ lên bề mặt kim loại một lớp sơn, dầu mỡ, chất dẻo… – Lau chùi, để nơi khô dáo thoáng
b. Phương pháp điện hóa dùng một kim loại là “ vật hi sinh” để bảo vệ vật liệu kim loại.
VII. PHẢN ỨNG NHIỆT PHÂN HÓA HỌC VÔ CƠ
1. Nhiệt phân các hợp chất muối nitrat
Tất cả các muối nitrat đều bị nhiệt phân tạo sản phẩm X + O2
a. Nhiệt phân muối nitrat của các kim loại K, Ba, Ca, Na…(các loại kim loại tan) thì sản phẩm X là muối có gốc nitrit ( NO2-)
b. Nhiệt phân muối nitrat của kim loại từ Mg → Cu thì sản phẩm X là oxit + NO2
2. Nhiệt phân các hợp chất muối cacbonat
- Muối cacbonat của kim loại kiềm không bị phân hủy
- Muối cacbonat của kim loại khác đứng trước Cu bị nhiệt phân thành hợp chất oxit + CO2
- Muối cacbonat của kim loại đứng đằng sau Cu bị nhiệt phân thành KL + O2 + CO2
- Muối (NH4)2CO32NH3 + CO2 + H2O
3. Nhiệt phân muối hidrocacbonat ( HCO3-)
Tất cả các muối hidrocacbonat đều có khả năng bị nhiệt phân. Sau khi đun nóng dung dịch ta có thành phần là các hợp chất muối hidrocacbonat.
4. Nhiệt phân muối amoni
- Muối amoni của gốc axit không có tính oxi hóa Axit + NH3
- Muối amoni của gốc axit có tính oxi hóa N2 hoặc N2O + H2O
5. Nhiệt phân các bazo
Các Bazo có khả năng tan như NaOH, KOH, Ba(OH)2, Ca(OH)2 …đều không bị nhiệt phân hủy.
Khi nhiệt phân các bazo không có khả năng tan cho ra thành phẩm là các oxit và nước
VII. PHẢN ỨNG ĐIỆN PHÂN
1. Điện phân nóng chảy
Phản ứng điện phân thường được sử dụng cho các hợp chất muối clorua của các kim loại mạnh, bazơ của kim loại kiềm hay các oxit nhôm n (muối Halogen, Bazo, Oxit nhôm)
2. Điện phân dung dịch
Hợp chất muối của kim loại tan
- Điện phân có màng ngăn các dung dịch muối halogenua ( gốc –Cl, -Br …), tạo bazơ + halogen + Hidro.
- Điện phân không có màng ngăng các dung dịch muối halogen, Cl2 tạo ra phản ứng với dung dịch kiềm tạo thành nước giaven (đây là phản ứng được ứng dụng trong thực tế để sản xuất ra nước javen)
Muối của các kim loại trung bình yếu: sản phẩm sau điện phân cho ra kim loại
- Nếu muối chứa gốc halogenua ( gốc –Cl, -Br …): Sản phẩm sinh ra là KL + phi kim
- Nếu muối chứa gốc có Oxi: Sản phẩm là KL + Axit + Oxi
VIII. PHẢN ỨNG NHIỆT LUYỆN
Phản ứng nhiệt luyện là phản ứng điều chế kim loại bằng phương pháp khử các oxit kim loại trong điều kiện nhiệt độ cao bằng Hidro, Cacbon, Cacbonoxit và Nhôm.
IX.TỔNG HỢP CÁC PHẢN ỨNG, TÍNH CHẤT HÓA HỌC CỦA CÁC HỢP CHẤT VÔ CƠ
Phản ứng tạo phức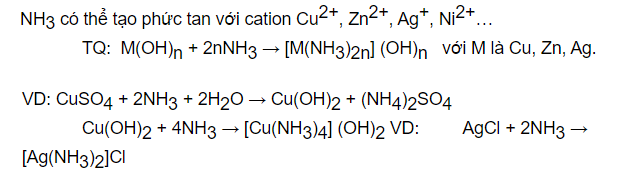 Phản ứng của muối Axit
Phản ứng của muối Axit Phản ứng của muối HSO4–
Phản ứng của muối HSO4–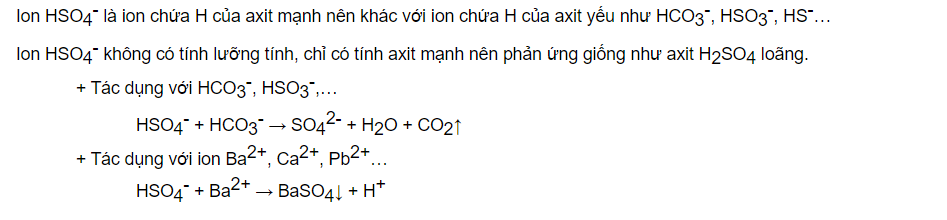 Phản ứng hóa học với HCL
Phản ứng hóa học với HCL Phản ứng với NaOH
Phản ứng với NaOH

X. DÃY ĐIỆN HÓA
1. Các cặp Oxi hóa – Chất khử, phản ứng oxi hóa khử
- Nguyên tử kim loại có khả năng dễ nhường các electron và trở thành các ion kim loại. Bên cạnh đó, các ion kim loại có thể nhận thêm các electron để trở thành nguyên tử kim loại.
- Các nguyên tử kim loại (như Ag, Cu, Fe,…) có vai trò như chất khử và các ion kim loại (như Ag+, Cu2+, Fe2+…) lại có vai trò như chất oxi hoá.
- Chất khử và chất oxi hóa của cùng cùng một nguyên tố kim loại sẽ tạo nên một cặp oxi hoá – khử. Ví dụ một vài cặp oxi hóa – khử: Ag – Ag+, Fe – Fe2+,…
Kết luận: Nói cặp oxi hóa – khử là tên gọi để nói dạng oxi hóa trước dạng khử sau. Chính vì vậy, chúng ta có thể ghi dạng oxi hóa trên dạng khử.
2. So sánh tính chất của các cặp oxi hoá – khử
Để hiểu rõ hơn về phần này, ta có thể lấy ví dụ cụ thể so sánh tính chất cặp oxi – hóa khử của Cu/ Cu2+ và Ag/Ag2+. Ta có thể thấy được Cu có thể tác dụng với hợp chất muối của Ag với phương trình hóa học rút gọn được viết với dạng sau:
Cu + 2Ag+ -> Cu2+ + 2Ag
Kết luận : Ion Cu2+ không có khả năng oxi hoá được Ag. Tuy nhiên Cu lại có thể khử được ion Ag+ -> Ion Cu2+ có tính oxi hóa yếu hơn Ag+ nhưng Cu lại có tính khử mạnh hơn Ag
3. Dãy điện hoá của kim loại
Sau khi thực nghiệm, người ta đã sắp xếp các kim loại theo thứ tự nhất định đc gọi là dãy điện hóa của kim loại. Trong đó:
- Tính oxi hóa của ion kim loại tăng dần
- Tính khử của kim loại giảm dần
4. Ý nghĩa của dãy điện hoá của kim loại
Ứng dụng 1: Xác định được thứ tự ưu tiên trong phản ứng hóa học
Ứng dụng 2: Quy tắc α
Nội dung quy tắc α: Phản ứng giữa 2 cặp oxi hoá – khử sẽ xảy ra theo một chiều nhất định. Trong đó, chất oxi hoá mạnh nhất sẽ thực hiện oxi hoá chất có tính khử mạnh nhất, sinh ra sản phẩm là chất oxi hoá yếu hơn và chất khử yếu hơn.
XI. CÂN BẰNG PHẢN ỨNG OXI HÓA KHỬ
1.Phương pháp cân bằng Electron
Để hoàn thành phương trình hóa, trước hết, các bạn cần phải nhuần nhuyễn phương pháp cân bằng Electron, điều này là rất quan trọng vì sẽ ảnh hưởng tới toàn bộ kết quả trong các bài tập. Để cân Electron, các bạn cần làm theo các bước sau:
Bước 1: Xác định số oxi hoá của các nguyên tố tham gia phản ứng. Tìm ra nguyên tố có số oxi hoá thay đổi .
Bước 2: Viết phương trình thay đổi số oxi hóa
Chất có oxi hoá tăng : Chất khử – nesố oxi hoá tăng
Chất có số oxi hoá giảm: Chất oxi hoá + mesố oxi hoá giảm
Bước 3: Xác định hệ số cân bằng của phương trình để đảm bảo số election trước và sau phản ứng không đổi
Bước 4: Đưa hệ số cân bằng vào phương trình, đảm bảo hệ số phải đúng với từng chất và kiểm tra lại phương trình đã làm theo trật tự : kim loại – phi kim – hidro – oxi
2. Phản ứng Oxi hoán – khử
Để có thể viết được các phản ứng oxi hóa khử, chúng ta cần xác định rõ các chất oxi hóa và chất khử thường gặp trong quá trình học cũng như ôn thi tốt nghiệp THPT môn Hóa. Sau khi bị khử, chất oxi hóa sẽ chuyển thành chất khử liên hợp (hay có thể gọi là chất khử tương ứng). Tương tự đối với chất khử, sau khi bị oxi hóa thì tạo thành chất oxi hóa liên hợp (chất oxi hóa tương ứng).
3. Một số chất Oxi hóa thường gặp

 4. Một số chất khử thường gặp
4. Một số chất khử thường gặp 

 Trên đây là toàn bộ kiến thức hóa học vô cơ ôn thi tốt nghiệp THPT mà các bạn học sinh cần nắm được. Hy vọng bài viết trên sẽ cung cấp những kiến thức bổ ích cho kỳ thi sắp tới. Chúc các bạn đạt điểm số cao! Một số bài viết có thể tham khảo thêm: Kiến thức về Amin và Amino Axit hóa 12 Tổng hợp kiến thức về Polime hóa 12 Sơ đồ tư duy hóa 12
Trên đây là toàn bộ kiến thức hóa học vô cơ ôn thi tốt nghiệp THPT mà các bạn học sinh cần nắm được. Hy vọng bài viết trên sẽ cung cấp những kiến thức bổ ích cho kỳ thi sắp tới. Chúc các bạn đạt điểm số cao! Một số bài viết có thể tham khảo thêm: Kiến thức về Amin và Amino Axit hóa 12 Tổng hợp kiến thức về Polime hóa 12 Sơ đồ tư duy hóa 12 Từ khóa » Tổng Hợp Hóa Vô Cơ 11
-
Tóm Tắt Công Thức Hóa Học Vô Cơ Lớp 11 Hay, Chi Tiết
-
Tổng Hợp Lý Thuyết Hóa Học THPT: Hóa Vô Cơ - Hocmai
-
Từ Điển Phương Trình Hóa Học Hóa Vô Cơ 11 Đầy Đủ - Kiến Guru
-
Hóa Học 11 Tổng Hợp Lý Thuyết Phần Vô Cơ - Gia Sư Thành Được
-
Tổng Hợp Lí Thuyết Hoá Vô Cơ Lớp 11 ôn Thi Thpt Quốc Gia Môn Hoá
-
Từ Điển Phương Trình Hóa Học Vô Cơ 11 Và Hóa Hữu Cơ Đầy Đủ ...
-
Tổng Hợp Lý Thuyết Hóa Học Lớp 10 - 11 - 12 Phần Hóa Học Vô Cơ
-
Hóa Học 11 Tổng Hợp Lý Thuyết Phần Vô Cơ - Gia Sư Dạy Kèm
-
Hóa Học | Số 2: Bài Tập Hóa Vô Cơ Lớp 11 | Chinh Phục Kỳ Thi | VTV7
-
Hóa Vô Cơ Lớp 11
-
Tổng Hợp Kiến Thức Hóa Vô Cơ Lớp 11 - 123doc - MarvelVietnam
-
[PDF] Hóa Học 11 Tổng Hợp Lý Thuyết Phần Vô Cơ
-
[PDF] Tổng Hợp Kiến Thức Hóa Vô Cơ 11 - 5pdf
-
Bài Tập Vô Cơ Hay Môn Hóa Học Lớp 11 - Ôn Luyện