Bảo Toàn Khối Lượng Là Gì?công Thức Và Cách Tính Hóa Lớp 9,12
Có thể bạn quan tâm
Định Luật bảo toàn khối lượng cho phép giải nhanh được nhiều bài toán khi biết về khối lượng của các chất trước và sau phản ứng.Khi chưa biết rõ phản ứng xảy ra hoàn toàn hay không hoàn toàn thì việc sử dụng phương pháp này càng giúp đơn giản hóa bài toán hơn.
Thế nào là Định Luật bảo toàn khối lượng :
1. Định luật bảo toàn khối lượng:
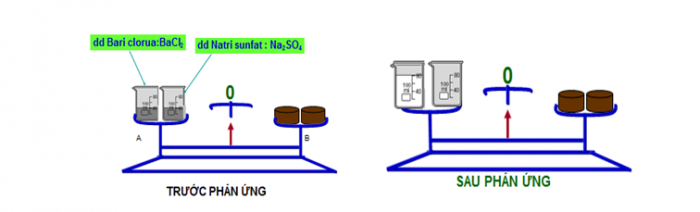
“ Trong một phản ứng hóa học, tổng khối lượng của các sản phẩm bằng tổng khối lượng của các chất phản ứng”
2. Kinh nghiệm khi áp dụng định luật
- Áp dụng định luật bảo toàn khối lượng khi một phản ứng hoá học có n chất mà ta biết được khối lượng của (n – 1) chất (kể cả chất phản ứng và sản phẩm).
- Khi áp dụng định luật bảo toàn khối lượng cho một phản ứng thì phản ứng đó không cần cân bằng mà chỉ cần quan tâm chất tham gia phản ứng và sản phẩm thu được.
3. Công thức của định luật:
Xét phản ứng: A + B → C + D (1)
Áp dụng định luật bảo toàn khối lượng cho pứ (1) có:
mA + mB = mC + mD
Trong đó: mA, mB lần lượt là phần khối lượng tham gia phản ứng của chất A, B mC, mD lần lượt là khối lượng được tạo thành của chất C, D.
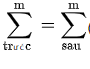
Hệ quả 1: Biết tổng khối lượng chất ban đầu « khối lượng chất sản phẩm.
Phương pháp giải: m(đầu) = m(sau) (không phụ thuộc hiệu suất phản ứng)
Hệ quả 2: Trong phản ứng có n chất tham gia, nếu biết khối lượng của (n – 1) chất thì ta dễ dàng tính khối lượng của chất còn lại.
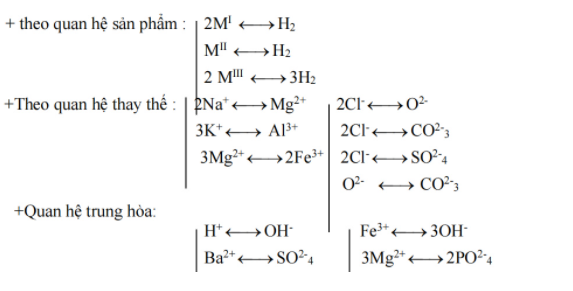
Hệ quả 3: Bài toán: Kim loại + axit → muối + khí
– Biết khối lượng kim loại, khối lượng anion tạo muối (tính qua sản phẩm khí) → khối lượng muối
– Biết khối lượng muối và khối lượng anion tạo muối → khối lượng kim loại
– Khối lượng anion tạo muối thường được tính theo số mol khí thoát ra:
– Với axit HCl và H2SO4 loãng
+ 2HCl → H2 nên 2Cl- ↔H2
+ H2SO4 → H2 nên SO42- ↔ H2
– Với axit H2SO4đặc, nóng và HNO3: Sử dụng phương pháp ion – electron (xem thêm phương pháp bảo toàn electron hoặc phương pháp bảo toàn nguyên tố)
Hệ quả 3: Bài toán khử hỗn hợp oxit kim loại bởi các chất khí (H2, CO)
Sơ đồ: Oxit kim loại + (CO, H2) → rắn + hỗn hợp khí (CO2, H2O, H2, CO)
4.Các bước giải.
Lập sơ đồ biến đổi các chất trước và sau phản ứng.
Từ giả thiết của bài toán tìm
 không cần biết phản ứng là hoàn toàn hay không hoàn toàn)
không cần biết phản ứng là hoàn toàn hay không hoàn toàn)
– Vận dụng định luật bảo toàn khối lượng để lập phương trình toán học, kết hợp dữ kiện khác để lập hệ phương trình toán.
– Giải hệ phương trình.
5.Lưu ý: Ta lập các sơ đồ liên hệ:
Một số bài toán thường gặp của phương pháp bảo toàn khối lượng
6.Bài tập thực hành:
1.X là một α-amonoaxit, phân tử chứa một nhóm –NH2 và một nhóm –COOH. Cho 0,89g X phản ứng vừa đủ với HCl thu được 1,255g muối. Công thức cấu tạo của X là:
A. CH2 = C(NH2) – COOH
B. H2N-CH = CH – COOH
C. CH3 – CH(NH2) – COOH
D. H2N – CH2 – CH2 – COOH
Giải:
HOOC – R – NH2 + HCl → HOOC – R – NH3Cl
Áp dụng định luật bảo toàn khối lượng: mHCl = mmuối – maminoaxit = 0,365g
⇒ nHCl = naminoaxit = 0,01 mol
⇒ Maminoaxit = 0,89 : 0,01 = 89
X là α-amonoaxit ⇒ X là: CHm3 – CH(NH2) – COOH ⇒ Đáp án C
Với bài toán này nếu không sử dụng định luật bảo toàn khối lượng quy ra số mol axit mà việc tính toán dựa trên tỉ lệ giữa muối và aminoaxit để tìm ra khối lượng phân tử của aminoaxit thì việc tính toán rất phức tạp.
2.Cho 23,4 gam hỗn hợp hai ancol đơn chức, kế tiếp nhau trong dãy đồng đẳng tác dụng hết với 13,8 gam Na, thu được 36,75 gam chất rắn. Hai ancol đó là
A. C2H5OH và C3H7OH
B. C3H7OH và C4H9OH
C. C3H5OH và C4H7OH
D. CH3OH và C2H5OH
Giải:
Áp dụng định luật bảo toàn khối lượng, ta có:
mhh acol + mNa = mc/rắn + mH2
⇒ mH2 = mhh acol + mNa – mc/rắn = 23,4 + 13,8 – 36,75 = 0,45g
⇒ nH2 = 0,45/2 = 0,225 mol
⇒ nhỗn hợp ancol = 2 nH2= 2.0,225 = 0,45(mol)
M−ancol = 23,4/0,45 = 52 ⇒ 2 ancol là: C2H5OH và C3H7OH
⇒ Đáp án A
Chú ý: Với bài toán trên thường mắc các lỗi sai:
+ Ngộ nhận Na tham gia phản ứng hết từ nNa ⇒ nH2 ⇒M−ancol ⇒ Đáp án D
+ Ngộ nhận chất rắn chỉ gồm muối RONa, không tính Na dư và sử dụng phương pháp tăng giảm khối lượng giữa ancol và muối ⇒ Đáp án D
Tại Đây : Bảng nguyên tử khối của các nguyên tố hóa học
Bảng hóa trị lớp 8,cách học thuộc bằng bài ca hóa trị hóa học
Hàm số bậc nhất là gì, ý nghĩa, tính chất của hàm số
Từ khóa » Công Thức Phương Pháp Bảo Toàn Khối Lượng
-
Công Thức Bảo Toàn Khối Lượng - Gia Sư Tâm Tài Đức
-
Giải Bài Tập Hóa Bằng Phương Pháp Bảo Toàn Khối Lượng
-
Phương Pháp Bảo Toàn Khối Lượng: Lý Thuyết Và Bài Tập
-
Công Thức định Luật Bảo Toàn Khối Lượng Và Bài Tập Có Lời Giải Từ A - Z
-
Phương Pháp Bảo Toàn Khối Lượng - O₂ Education
-
Định Luật Bảo Toàn Khối Lượng (Đầy đủ - Có Bài Tập Vận Dụng Cực Hay)
-
Phương Pháp Bảo Toàn Khối Lượng Trong Hóa Học Cực Hay, Có Lời Giải
-
Phương Pháp Bảo Toàn Khối Lượng Là Gì ? Công Thức Và Cách Giải ...
-
Định Luật Bảo Toàn Khối Lượng Là Gì? Công Thức Tính Và ý Nghĩa
-
Định Luật Bảo Toàn Khối Lượng - Phương Pháp áp Dụng
-
Định Luật Bảo Toàn Khối Lượng, Công Thức Tính Và Bài Tập Vận Dụng
-
Định Luật Bảo Toàn Khối Lượng Lớp 8 - Dạng Bài Tập Hay Gặp
-
4 Dạng đề áp Dụng Phương Pháp Bảo Toàn Khối Lượng Hóa 12
-
Phương Pháp Bảo Toàn Khối Lượng: Lý Thuyết Và Các Dạng Bài Tập