Phương Pháp Bảo Toàn Khối Lượng Là Gì ? Công Thức Và Cách Giải ...
Có thể bạn quan tâm
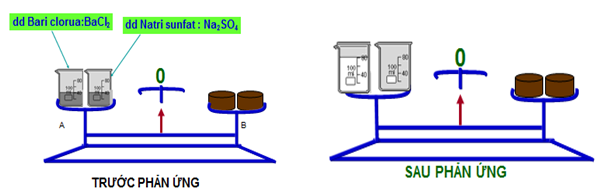
Phương pháp bảo toàn khối lượng là phương pháp thường xuyên được xử dung trong quá trình giải quyết những bài toán hóa học. Vậy phương pháp này được hiểu như thế nào ? Xem ngay bài viết này !
Tham khảo bài viết khác:
- Phương pháp bảo toàn điện tích là gì
- Nồng độ dung dịch là gì
Phương pháp bảo toàn khối lượng là gì ?
Tóm tắt nội dung
- 1 Phương pháp bảo toàn khối lượng là gì ?
- 1.1 1. Phát biểu bằng lời
- 1.2 2. Công thức phương pháp bảo toàn khối lượng
- 2 Phạm vi sử dụng phương pháp
- 3 Cách giải phương pháp bảo toàn khối lượng
- 4 Một số bài toán thường gặp của phương pháp bảo toàn khối lượng
- 4.1 Dạng 2:
- 4.2 Dạng 3:
1. Phát biểu bằng lời
– Trong một phản ứng hóa học, tổng khối lượng của các sản phẩm bằng tổng khối lượng của các chất phản ứng
2. Công thức phương pháp bảo toàn khối lượng
==> Xét phản ứng: A + B → C + D (1)
– Áp dụng định luật bảo toàn khối lượng cho pứ (1) có:
mA + mB = mC + mD
– Trong đó:
- mA, mB lần lượt là phần khối lượng tham gia phản ứng của chất A, B
- mC, mD lần lượt là khối lượng được tạo thành của chất C, D

Phạm vi sử dụng phương pháp
– Thường sử dụng phương pháp bảo toàn khối lượng trong các bài toán sau:
+ Biết tổng khối lượng chất ban đầu ( tham gia) tính khối lượng chất tạo thành sản phẩm hoặc ngược lại
+ Trong bài toán có n chất mà chúng ta biết khối lượng của (n-1) chất ta sẽ tính được khối lượng chất còn lại
+ Những bài toán ta không thể xác định được số mol do không biết được phân tử khối của các chất
Cách giải phương pháp bảo toàn khối lượng
– Lập sơ đồ biến đổi các chất trước và sau phản ứng.
Từ giả thiết của bài toán tìm Tổng m trước = Tổng m sau (không cần biết phản ứng là hoàn toàn hay không hoàn toàn)
– Vận dụng định luật bảo toàn khối lượng để lập phương trình toán học, kết hợp dữ kiện khác để lập hệ phương trình toán.
– Giải hệ phương trình.
Chú ý: Sơ đồ liên hệ
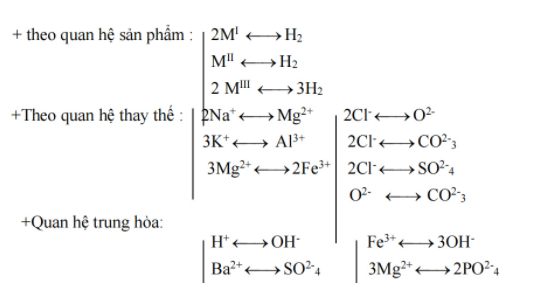

Một số bài toán thường gặp của phương pháp bảo toàn khối lượng
Bài tập 1: Cho m gam FexOy tác dụng với dd H2SO4 đặc nóng vừa đủ, có chứa 0,075 mol H2SO4 , thu được dung dịch X và 0,672 lít SO2 (đktc) duy nhất thoát ra. Cô cạn dung dịch X thu được 9 gam muối khan. Tính m
– Hướng Dẫn Giải:
FexOy + H2SO4 → Fe2(SO4)3 + SO2 + H2O (1)
Áp dụng định luật bảo toàn khối lượng cho phản ứng (1) ta được:
mFexOy + mHSO = mFe(SO) + mSO + mHO
→ m + 0,075.98 = 9 + 0,03. 64 + 0,075.18
→ m = 4,92g
Dạng 2:
Bài tập 2: Cho 23,4 gam hỗn hợp hai ancol đơn chức, kế tiếp nhau trong dãy đồng đẳng tác dụng hết với 13,8 gam Na, thu được 36,75 gam chất rắn. Hai ancol đó là
- A. C2H5OH và C3H7OH
- B. C3H7OH và C4H9OH
- C. C3H5OH và C4H7OH
- D. CH3OH và C2H5OH
– Hướng Dẫn Giải:
Áp dụng định luật bảo toàn khối lượng, ta có:
mhh acol + mNa = mc/rắn + mH2
⇒ mH2 = mhh acol + mNa – mc/rắn = 23,4 + 13,8 – 36,75 = 0,45g
⇒ nH2 = 0,45/2 = 0,225 mol
⇒ nhỗn hợp ancol = 2 nH2= 2.0,225 = 0,45(mol)
M−ancol = 23,4/0,45 = 52 ⇒ 2 ancol là: C2H5OH và C3H7OH
⇒ Đáp án A
– Chú ý: Với bài toán trên thường mắc các lỗi sai:
+ Ngộ nhận Na tham gia phản ứng hết từ nNa ⇒ nH2 ⇒M−ancol ⇒ Đáp án D
+ Ngộ nhận chất rắn chỉ gồm muối RONa, không tính Na dư và sử dụng phương pháp tăng giảm khối lượng giữa ancol và muối ⇒ Đáp án D
Dạng 3:
Bài tập 3: Hỗn hợp X gồm Fe, FeO và Fe2O3. Cho một luồng CO đi qua ống sứ đựng m gam hỗn hợp X nung nóng. Sau khi kết thúc thí nghiệm thu được 64 gam chất rắn A trong ống sứ và 11,2 lít khí B (đktc) có tỉ khối so với H2 là 20,4. Tính giá trị m.
- A. 105,6 gam.
- B. 35,2 gam.
- C. 70,4 gam.
- D. 140,8 gam.
– Hướng Dẫn Giải:
Khí B gồm: COdư ( x mol) và CO2 (y mol)
nB = x + y = 0,5 mol (1)
MB = 20,4.2 = 40,8g ⇒ mB = 40,8.0,5 = 20,4g
⇒ 28x + 44y = 20,4g (2)
Từ (1)(2) ⇒ x = 0,1 mol; y = 0,4 mol
Ta có: nCO pư = nCO2 = 0,4 mol
Áp dụng định luật bảo toàn khối lượng:
mX + mCO = mA + mCO2
⇒ mCOX = mCOA + mCOCO2 – mCO2 = 64 + 0,4.44 – 0,4.28 = 70,4g
⇒ Đáp án C
Cám ơn bạn đã theo dõi nội dung bài viết này của chúng tôi, hy vọng qua bài viết này bạn sẽ nắm bắt thêm được nhiều kiến thức hữu ích nữa !
Người xem: 1.196Từ khóa » Công Thức Phương Pháp Bảo Toàn Khối Lượng
-
Công Thức Bảo Toàn Khối Lượng - Gia Sư Tâm Tài Đức
-
Giải Bài Tập Hóa Bằng Phương Pháp Bảo Toàn Khối Lượng
-
Phương Pháp Bảo Toàn Khối Lượng: Lý Thuyết Và Bài Tập
-
Công Thức định Luật Bảo Toàn Khối Lượng Và Bài Tập Có Lời Giải Từ A - Z
-
Phương Pháp Bảo Toàn Khối Lượng - O₂ Education
-
Định Luật Bảo Toàn Khối Lượng (Đầy đủ - Có Bài Tập Vận Dụng Cực Hay)
-
Phương Pháp Bảo Toàn Khối Lượng Trong Hóa Học Cực Hay, Có Lời Giải
-
Định Luật Bảo Toàn Khối Lượng Là Gì? Công Thức Tính Và ý Nghĩa
-
Định Luật Bảo Toàn Khối Lượng - Phương Pháp áp Dụng
-
Định Luật Bảo Toàn Khối Lượng, Công Thức Tính Và Bài Tập Vận Dụng
-
Định Luật Bảo Toàn Khối Lượng Lớp 8 - Dạng Bài Tập Hay Gặp
-
Bảo Toàn Khối Lượng Là Gì?công Thức Và Cách Tính Hóa Lớp 9,12
-
4 Dạng đề áp Dụng Phương Pháp Bảo Toàn Khối Lượng Hóa 12
-
Phương Pháp Bảo Toàn Khối Lượng: Lý Thuyết Và Các Dạng Bài Tập