Các Nhóm Thuốc điều Trị Rối Loạn Lipid Máu: Cơ Chế Và Phân Loại
Có thể bạn quan tâm
Những biện pháp luyện tập và tiết chế ăn uống là một phần không thể thiếu được khi điều trị rối loạn lipid máu. Tuy nhiên, không phải ai khi áp dụng những biện pháp này cũng đạt được hiệu quả điều trị như mong muốn. Nhằm kiểm soát nồng độ cholesterol tốt hơn thì việc sử dụng các thuốc điều trị rối loạn lipid máu là rất cần thiết. Vậy rối loạn lipid là gì? Lựa chọn thuốc điều trị rối loạn lipid như thế nào cho hợp lý? Hãy cùng Nhà Thuốc Ngọc Anh tìm hiểu những thông tin về Các nhóm thuốc điều trị rối loạn lipid máu ngay trong bài viết sau đây nhé.
Tổng quanVai trò của lipid trong cơ thể
Lipid là nguồn năng lượng trực tiếp cho cơ thể. Với các khẩu phần ăn hợp lý lipid cung cấp 25-30% năng lượng cho cơ thể. Lipid là nguyên liệu tạo năng lượng tại các tế bào cơ thể dưới dạng các acetyl coenzyme A từ sự thoái biến các acid béo. Riêng tại gan, một lượng nhỏ acetyl coenzyme A được chuyển thành các thể ketone (acetoacetate, β-hydroxybutyrate và acetone). Các thể ketone một phần được các tế bào não, thận và cơ tim chuyển hoá, phần còn lại được đào thải qua phổi (aceton) và ra nước tiểu.
Lipid ngoài ra còn là nguồn năng lượng dự trữ lớn nhất trong cơ thể. Dạng dự trữ là triglyceride (hay còn gọi là mỡ trung tính) tại mô mỡ chiếm khoảng 15 – 20% trọng lượng cơ thể ở người trưởng thành.
Lipid tham gia cấu trúc cơ thể như mô mỡ đệm dưới da và bọc quanh các phủ tạng. Lipid là thành phần màng tế bào (phospholipid) và một số hoạt chất sinh học quan trọng như prostaglandin và leucotrien. Cholesterol cần cho sự tổng hợp acid mật, các hormon steroid của tuyến thượng thận và sinh dục.
Quá trình chuyển hóa lipid trong cơ thể
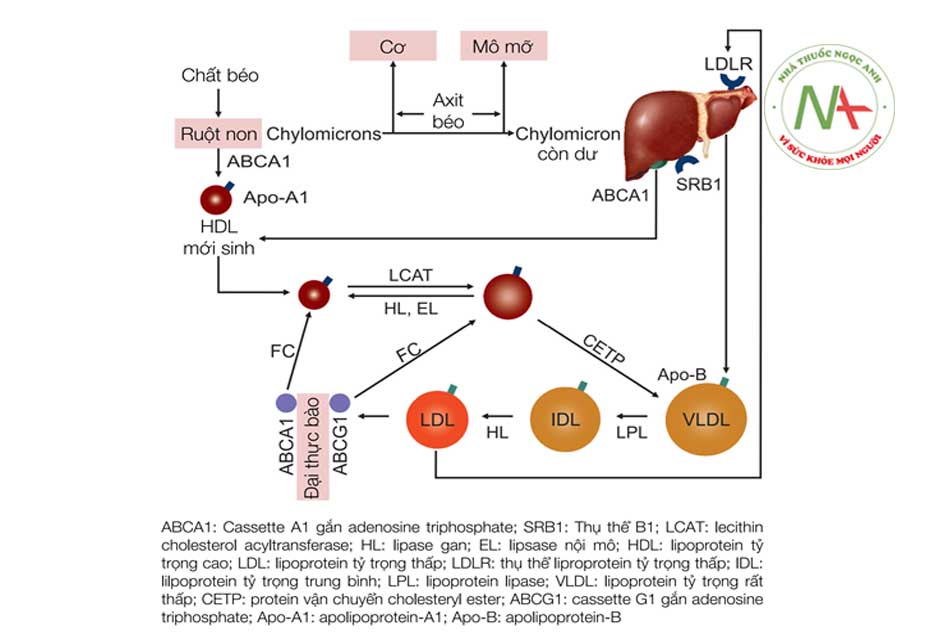
Mỡ trong thực phẩm hằng ngày chủ yếu là dạng triglyceride. Dưới tác dụng của acid mật và lipase dịch tụy, triglycerid bị thủy phân thành acid béo và monoglycerid. Tại tế bào niêm mạc ruột non, hầu hết các acid béo và monoglyceride được tái tổng hợp thành triglycerid rồi kết hợp với apo – B48, phospholipid và cholesterol để tạo thành các hạt dưỡng chấp (chylomicron).
Hạt dưỡng chấp được hấp thu vào mạch bạch huyết rồi qua ống ngực đổ vào tuần hoàn chung. Hạt dưỡng chấp chứa nhiều triglycerid, khi vào máu thì nhận thêm apo-CII từ HDL (lipoprotein tỷ trọng cao). Apo-CII là cofactor của lipoprotein lipase thủy phân triglycerid đưa acid béo đến các tế bào ngoại vi để tiêu thụ. Sau đó hạt dưỡng chấp được bổ sung apo-E rồi được gan thu nhận (qua trung gian thụ thể của LDL và thụ thể của apo-E trên bề mặt tế bào gan với apo-E trên hạt dưỡng chấp).
Tế bào gan thu nhận acid béo từ hạt dưỡng chấp và mô mỡ, tổng hợp thêm acid béo từ các mẫu acetyl coenzyme A, kết hợp acid béo với glycerolphosphat để tạo triglyceride. Sau đó tế bào gan kết hợp triglycerid với apo-B100, phospholipid và cholesterol đưa vào máu dưới dạng VLDL (lipoprotein tỷ trọng rất thấp). VLDL cũng chứa nhiều triglycerid, được HDL chuyển apo-CII qua để kích hoạt lipoprotein lipase nhằm thủy phân triglycerid đưa acid béo đến các tế bào ngoại vi tiêu thụ. Sau đó, VLDL do giảm tỷ lệ triglycerid chuyển thành IDL (lipoprotein tỷ trọng trung gian). IDL chịu hai khả năng chuyển hóa: (1) chuyển trở lại tế bào gan (qua trung gian thụ thể của LDL và thụ thể của apo-E trên bề mặt tế bào gan với apo-B100 và apo-E trên IDL), (2) chuyển thành LDL (lipoprotein tỷ trọng thấp) nhờ tác dụng của HTGL (hepatic triglyceride lipase) thủy phân bớt triglycerid trên IDL.
HDL do gan và ruột tạo. Vai trò của HDL là thu nhận cholesterol thừa từ các tế bào ngoại vi (vai trò của HDL3). Khi cholesterol được hấp phụ vào bề mặt HDL3 thì được chuyển thành este cholesterol nhờ tác dụng của LCAT (lecithin cholesterol acyltransferase). Khi este cholesterol di chuyển vào bên trong lõi HDL thì HDL3 trở thành HDL2. Sau đó HDL2 được thu nhận trở lại vào gan hoặc chuyển este cholesterol qua VLDL để trở thành HDL3. Sự chuyển este cholesterol từ HDL2 qua VLDL cần tác dụng của CETP (cholesterol ester transfer protein).
Apo-A do gan tạo, kết hợp với apo-B100 trên LDL hình thành lipoprotein-A. Vai trò của lipoprotein-A chưa rõ nhưng khi tăng thì dễ gây nguy cơ xơ vữa động mạch. Mỗi loại lipoprotein máu cấu tạo bởi một lõi kỵ nước gồm triglyceride và este cholesterol, một vỏ bọc ái nước gồm phospholipid, cholesterol tự do và apolipoprotein (gọi tắt là apo). Triglyceride và cholesterol không hòa tan trong nước, do vậy chúng phải được vận chuyển trong các hạt lipoprotein, nói cách khác lipoprotein là dạng vận chuyển triglycerid và cholesterol trong máu. LDL chứa tỷ lệ cholesterol cao nhất (45%) so với các loại lipoprotein khác, tải 70% lượng cholesterol máu.
Định nghĩa rối loạn lipid máu
Nhiễm mỡ máu là tình trạng rối loạn lipid chuyển hóa trong máu. Khi đó, nồng độ các chất mỡ( gồm có cholesterol, triglycerid và một số chất khác) trong máu tăng cao.
Lipid trong máu hay còn gọi là mỡ máu gồm rất nhiều thành phần khác nhau, trong đó gồm có: Cholesterol, Triglycerid, HDL-Cholesterol (cholesterol lipoprotein tỷ trọng cao hay còn gọi là ‘mỡ tốt ‘) và LDL-Cholesterol (cholesterol lipoprotein tỷ trọng thấp hay còn gọi là ‘mỡ tốt’).
Rối loạn lipid máu là tình trạng cholesterol, triglycerid, LDL-Cholesterol tăng một cách bất thường và HDL-Cholesterol bị giảm đi.
Nguyên nhân của rối loạn lipid huyết
Có nhiều nguyên nhân gây ra rối loạn lipid huyết:
Nguyên nhân nguyên phát: Do yếu tố di truyền (gen), thường xảy ra sớm ở trẻ em và người trẻ tuổi, ít khi kèm thể trạng béo phì, gồm các trường hợp sau:
- Tăng triglycerid tiên phát
- Tăng lipid máu hỗn hợp
Nguyên nhân thứ phát:
- Do nghiện rượu, hút thuốc lá hay ăn nhiều thực phẩm có nhiều chất béo, dầu mỡ, thực phẩm giàu calo. Đây là nguyên nhân quan trọng nhất gây ra rối loạn lipid máu.
- Do bệnh tật: một số bệnh gây ra rối loạn chuyển hóa như đái tháo đường, thiểu năng tuyến giáp, hội chứng thận hư,… làm tăng cường sử dụng lipid dự trữ trong cơ thể dẫn đến việc rối loạn chuyển hóa lipid
- Do sử dụng một số thuốc (thuốc tránh thai, thuốc chẹn β, thuốc lợi tiểu thiazid…..)
- Hoặc do căn thẳng trong công việc, cuộc sống, stress.
Phân loại rối loạn lipid máu
Vào năm 1965, Fredrickson phân loại rối loạn lipid huyết thành 5 typ lần lượt là I, II, III, IV, V, sau này type II lại được tách thành Type IIa và IIb.
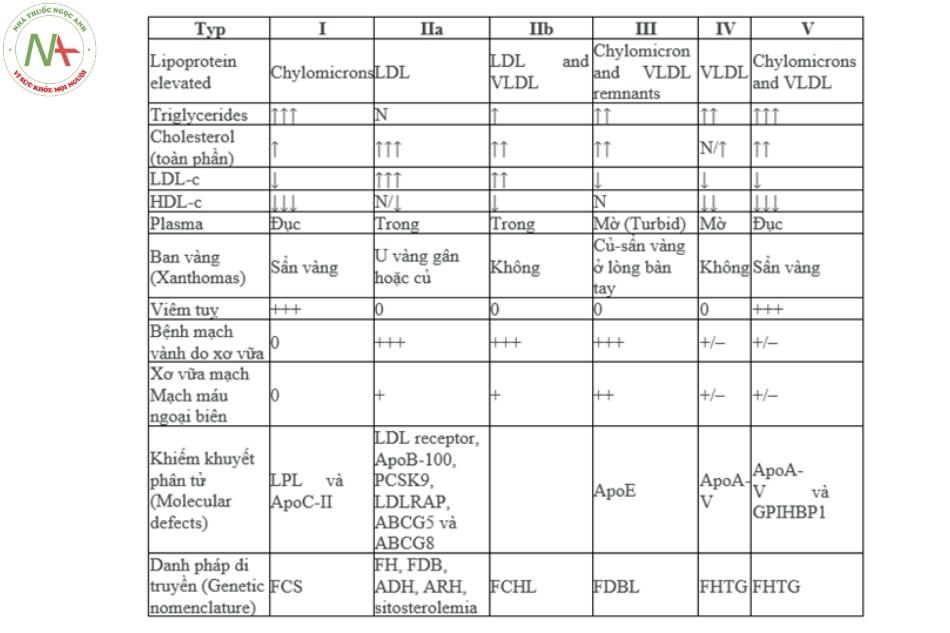
Và theo Turpin, các trường hợp rối loạn lipoprotein xảy ra chủ yếu ở 3 typ: IIa, IIb, IV và 99% các type IIa, IIb, III và IV gây vữa xơ động mạch.
Các triệu chứng rối loạn lipid huyết
Rối loạn lipid máu là bệnh lý sinh học, xảy ra sau một thời gian dài mà không thể nhận biết được, vì RLLPM không có triệu chứng đặc trưng. hần lớn triệu chứng lâm sàng của rối loạn lipid máu chỉ được phát hiện khi nồng độ các thành phần lipid máu cao kéo dài hoặc gây ra các biến chứng ở các cơ quan như xơ vữa động mạch, nhồi máu cơ tim, tai biến mạch não
Rối loạn lipid huyết thường không gây triệu chứng nhưng có thể dẫn đến các triệu chứng của bệnh khác như bệnh mạch máu, bệnh động mạch vành (CAD), đột quỵ….
Nồng độ triglyceride cao trên 500mg/dL (5,65 mmol/L) có thể gây viêm tụy cấp, nếu nồng độ rất cao cũng có thể gây gan to, khó thở, lú lẫn.
Và khi nồng độ triglyceride tăng trên 2000mg/dL(22,6 mmol/L) có thể làm cho động mạch và tĩnh mạch xuất hiện màu trắng kem (lipemia vòng mạc).
Nồng độ lipid cực cao cũng có thể tạo thành rối loạn cảm giác, khó thở và lơ mơ.
Mức độ LDL cao có thể gây ra vòng giác mạc và xanthomas ở khủy tay, gân Achilles, khủy tay, khớp gối và trên các khớp nối cổ bàn chân.
Mặc dù rối loạn lipid máu thường diễn biến âm thầm, tuy nhiên đã ghi nhận các dấu hiệu bất thường trong cơ thể như: mệt mỏi, buồn nôn, hoa mắt chóng mặt, vã mồ hôi, thở ngắn, dốc, xuất hiện các nốt ban dưới da nhưng không đau hay ngứa.
Xuất hiện một số biến cố bất thường trên tim mạch như: đau thắt ngực, nặng ngực, cảm giác đau tức, cảm giác bị bóp nghẹt, đau lan ra 2 cánh tay và sau lưng. Một số trường hợp, người bệnh có biểu hiện của các bệnh mạch máu ngoại vi như đầu ngón tay, ngón chân hay tê bì, đau buốt.
Ngoài ra, còn xuất hiện một số triệu chứng trên đường tiêu hóa như ăn uống khó tiêu,..
Chẩn đoán rối loạn lipid máu
Chẩn đoán hàm lượng lipid máu xác định mức cholesterol toàn phần, Triglycerid và HDL-cholesterol , LDL-cholesterol và VLDL cholesterol)
Rối loạn lipid do di truyền được nghi ngờ khi bệnh nhân có các dấu hiệu của rối loạn lipid máu.
Khởi phát sớm bệnh lý xơ vữa động mạch (ở bệnh nhân < 60 tuổi)
Có tiền sử người thân trong gia đình bị bệnh xơ vữa động mạch.
Xác định nồng độ Cholesterol huyết thanh > 240 mg/dL (> 6,2 mmol/L).
Rối loạn lipid máu được chẩn đoán bằng cách định lượng lipid trong huyết thanh. Các xét nghiệm thường quy gồm nồng độ cholesterol toàn phần, Triglycerid, HDL-cholesterol và LDL-cholesterol.
Điều trị rối loạn lipid máu
Nguyên tắc điều trị
- Đánh giá các nguy cơ theo các tiêu chí rõ ràng.
- Ưu tiên điều trị thay đổi lối sống thường xuyên tập thể dục, thay đổi chế độ ăn uống khoa học, hạn chế dầu mỡ, hạn chế bia rượu.
- Điều trị dùng thuốc trong các trường hợp LDL-cholesterol tăng cao: các nhóm thuốc statins, thuốc gắn acid mật (resin), ezetimibe, niacin.
- Đối với trường hợp Triglycerid tăng cao, điều trị dùng thuốc như niacin, các thuốc nhóm fibrate, omega-3….
Điều trị không dùng thuốc
Thay đổi lối sống là biện pháp được sử dụng trước khi dùng thuốc hoặc phối hợp với dùng thuốc. Bao gồm:
Thay đổi chế độ ăn
- Dùng các thực phẩm có hàm lượng chất béo thấp
- Giảm mỡ động vật có chứa nhiều acid béo no, thay bằng dầu thực vật. Giảm các thức ăn chứa nhiều cholesterol (óc, tim, gan, lòng đỏ trứng…). Hạn chế đường và thịt đỏ.
- Ăn cá có chứa nhiều acid béo không no nhóm omega-3, các acid béo này làm giảm C máu.
- Ăn nhiều rau xanh, rau tươi, ăn trái cây tươi.
- Cai rượu, thuốc lá
Tăng cường hoạt động thể lực
Thường xuyên tham gia các hoạt động thể thao vừa sức, đi bộ. Hoạt động thể lực, giúp làm tăng hàm lượng HDL-Cholesterol. Phải tập ít nhất 30 phút mỗi ngày và tập đều đặn hàng tháng hoặc ít nhất cũng phải 3 lần 1 tuần để đảm bảo, nếu thấy đã đạt kết quả tốt mà ngừng tập thì kết quả sẽ mất ngay.
Kiểm soát cân nặng
Để đánh giá mức độ béo phì , người ta thường dựa vào chỉ số khối của cơ thể (BMI). Kiểm soát được trọng lượng của cơ thể góp phần làm giảm lượng cholesterol trong máu.
Điều trị dùng thuốc
Cho tới hiện tại thuốc điều trị rối loạn lipid máu nhóm statin và fibrate vẫn là các nhóm thuốc chính điều trị tăng cholesterol và triglyceride. Tuy nhiên, những nhóm thuốc này đều có các tác dụng không mong muốn trên gan và cho gan, cơ,… nên có những chỉ định cũng như chống chỉ định, thận trọng rất chặt chẽ trong thực hành lâm sàng. Ngoài ra, các nhóm thuốc khác như thuốc gắn acid mật, nhóm niacin, ezetimibe cũng có vai trò rất lớn và được sử dụng rộng rãi trên lâm sàng. Có thể chia thành 2 nhóm chính như sau:
Các nhóm thuốc có tác dụng làm giảm tổng hợp Lipoprotein
- Các thuốc thuộc nhóm Statin ( ức chế men khử HMG-CoA)
- Các thuốc Fibrat ( dẫn xuất của acid fibric)
- Các thuốc Acid nicotinic
Các nhóm thuốc có tác dụng làm giảm hấp thu và tăng thải trừ Lipoprotein
- Các thuốc thuộc nhóm resin – nhóm gắn với acid mật
- Các thuốc Ezetimibe có cơ chế ức chế sự hấp thu cholesterol.
Một số các thuốc điều trị rối loạn lipid máu thế hệ mới như: thuốc ức chế enzyme CETP (cholesteryl ester transfer protein): Torcetrapib, Dalcetrapib; thuốc ức chế trực tiếp apoB: Mipomersen; thuốc ức chế MTP (microsomal triglyceride transfer protein): Lomitapide; thuốc dạng kháng thể đơn dòng ức chế enzyme PCSK9 (Proprotein convertase subtilisin/kexin type 9): Alirocumab (Praluent), Evolocumab (Repatha); Các acid béo n-3 (omega-3): acid Eicosapentaenoic (EPA) và acid Docosahexaenoic (DHA) cũng hứa hẹn mang tới những liệu pháp mới trong việc tối ưu hóa điều trị rối loạn lipid máu.
Bảng 6.1: Các nhóm thuốc điều trị rối loạn lipid máu thường dùng với đặc tính trên các thành phần lipid máu và khả năng dung nạp điều trị
| Nhóm thuốc | TC | LDL-C | HDL-C | TG | Tính dung nạp |
| Statin | ↓19-37% | ↓25-50% | ↑4-12% | ↓14-29% | Tốt |
| Thuốc ức chế hấp thu cholesterol (Ezetimibe) | ↓13% | ↓18% | ↑1% | ↓9% | Tốt |
| Thuốc gắn acid mật | ↓7-10% | ↓10-18% | ↑3% | Trung tính | Kém |
| Niacin | ↓10-20% | ↓10-20% | ↑14-35% | ↓30-70% | Được – Kém |
| Fibrate | ↓19% | ↓4-8% | ↑11-13% | ↓30% | Tốt |
STATIN
Lịch sử
Thuốc ức chế HMG-CoA reductase, hay còn gọi với cái tên quen thuộc là statin, là một loại thuốc chính dùng để điều trị rối loạn lipid máu và dự phòng các biến cố tim mạch.
Lý thuyết đầu tiên về việc cholesterol có liên quan đến vữa xơ động mạch bắt đầu từ đầu thế kỷ XX, tuy nhiên khi đó cholesterol chưa được chú ý nhiều. Đầu những năm 1950, John Gofman, đại học Berkeley – California đã thực hiện những nghiên cứu dịch tễ học và thấy rằng những cơn đau tim liên quan đến tăng LDL (lipoprotein tỷ trọng thấp), trong khi HDL (lipoprotein tỷ trọng cao) tăng, các cơn đau tim ít xảy ra hơn.
Nghiên cứu tim mạch Framingham lần đầu tiên chứng minh những người có mức cholesterol cao hơn có nhiều khả năng bị nhồi máu cơ tim trong những năm sau đó. Các đặc tính hạ cholesterol máu của niacin được phát hiện vào năm 1955 bởi nhà nghiên cứu bệnh học người Canada: Rudolf Altschul. Vào những năm 1960, nhiều dẫn xuất của clofibrate mạnh hơn và an toàn hơn đã được phát triển. Ở hầu hết bệnh nhân, tác dụng hạ cholesterol của fibrate là từ nhẹ đến trung bình.
HMG-CoA reductase là enzyme kiểm soát tốc độ tổng hợp cholesterol tại gan. Các nhà khoa học nhanh chóng nhận ra sự tương đồng về cấu trúc giữa compactin và HMG-CoA (cơ chất của enzyme). Do đó, cơ chế hoạt động compactin được đề xuất là ức chế cạnh tranh với enzyme. Tuy nhiên, compactin gây ung thư hạch ở chó nên không được sử dụng. Cuối những năm 1970, những phát hiện về compactin đã truyền cảm hứng cho nhiều công ty dược phẩm bắt đầu tìm kiếm một statin khác. Dưới sự chỉ đạo của Alfred Albert, Merck đã tìm ra statin của riêng họ vào tháng 2/1979, cấu trúc tương tự compactin, có tên gọi là mevinolin, được phân lập từ Aspergillus terreus. Tháng 2/1979, Akira Endo đã phân lập được một statin khác, lấy tên là monacolin K từ môi trường nuôi cấy Monascus ruber. Vào mùa thu cùng năm, người ta đã xác nhận monacolin K và mevinolin thực chất là một (sau này được đổi tên thành lovastatin).
Đầu năm 1981, Brown và Goldstein đã báo cáo lovastatin có thể làm tăng thụ thể LDL ở gan chó và dẫn đến giảm mạnh LDL huyết tương. Lovastatin sau đó đã được thử nghiệm trên người, và được chứng minh làm giảm mạnh LDL huyết tương. Hai người đã được trao giải thưởng Nobel về Sinh lý và Y khoa năm 1985.
Tháng 7/1982, Merck bắt đầu các thử nghiệm lâm sàng quy mô lớn về lovastatin trên những bệnh nhân có nguy cơ cao và nghiên cứu độc tính lâu dài trên chó năm 1984. Thuốc cho thấy tác dụng hạ cholesterol máu đáng kể và được dung nạp tốt, đồng thời không quan sát thấy khối u nào trên chó. Năm 1987, FDA đã cấp phép lưu hành lovastatin. Sau đó, có thêm 6 statin được thương mại hóa, bao gồm hai statin bán tổng hợp (simvastatin và pravastatin), 4 statin tổng hợp (fluvastatin, atorvastatin, rosuvastatin và pitavastatin).
Có nhiều thử nghiệm lâm sàng quy mô lớn đã được thực hiện với statin và chúng đều cho kết quả tương tự: điều trị bằng statin làm giảm LDL huyết tương 25-35% và giảm tần suất các cơn đau ngực do tim 25-30%. Statin hiện nay là nhóm thuốc bán chạy nhất trên toàn cầu. Doanh thu cho riêng nhóm thuốc này năm 2005 đã lên tới 25 tỷ USD.
Nhóm thuốc này hiện nay có 7 loại đã được phê duyệt, viết tắt của các chữ cái đầu tiên thành “ RASLFPrPi” gồm: Rosuvastatin, Pravastatin, Fluvastatin, Simvastatin, Atorvastatin, Lovastatin, Pitavastatin thuộc 3 thế hệ:
Thế hệ 1: lovastatin, simvastatin, pravastatin.
Thế hệ 2: fluvastatin.
Thế hệ 3: cerivastatin ( tuy nhiên đã bị ngừng lưu hành), atovastatin, rosuvastatin và pitavastatin.
Dược lý học
Statin là thuốc điều trị rối loạn lipid máu được khuyến cáo đầu tay trong việc kiểm soát lipid máu và giảm các nguy cơ tim mạch. Đây là nhóm thuốc được chỉ định hàng đầu trong điều trị rối loạn lipid máu vì các bằng chứng từ các nghiên cứu lâm sàng cho thấy hiệu quả rất rõ ràng.
Các statin mạnh vẫn là ưu tiên lựa chọn hàng đầu trong điều trị các rối loạn lipid máu, đặc biệt trên những bệnh nhân tăng lipid máu có tính chất gia đình, bệnh nhân nguy cơ tim mạch rất cao, nguy cơ cao, trung bình.
Statin là chất ức chế cạnh tranh của enzyme khử 3-hydroxy-3-methylglutaryl coenzyme A (HMG-CoA) chịu trách nhiệm cho chuyển đổi HMG-CoA thành mevalonate, tiền chất của sterol, bao gồm cholesterol. Sự ức chế sinh tổng hợp cholesterol trong các tế bào gan kích thích hơn nữa sự tổng hợp các thụ thể LDL, do đó làm tăng sự hấp thu LDL, làm giảm LDL-C trong máu.
Tất cả các statin được hấp thụ nhanh, tối đa trong vòng 4h. Tuy nhiên, thời gian bán hủy của các thuốc thay đổi đáng kể. Atorvastatin và rosuvastatin có thời gian bán hủy dài hơn nên hiệu quả giảm cholesterol kéo dài cả ngày.
Trong điều trị các chỉ số lipid giữa các statin cho thấy rằng khả năng làm giảm LDL cholesterol của rosuvastatin và atorvastatin là mạnh nhất trong 7 thành viên thuộc nhóm này. Sự khác biệt trong khả năng làm tăng HDL cholesterol hoặc làm giảm triglyceride của các statin thì ít rõ ràng hơn.
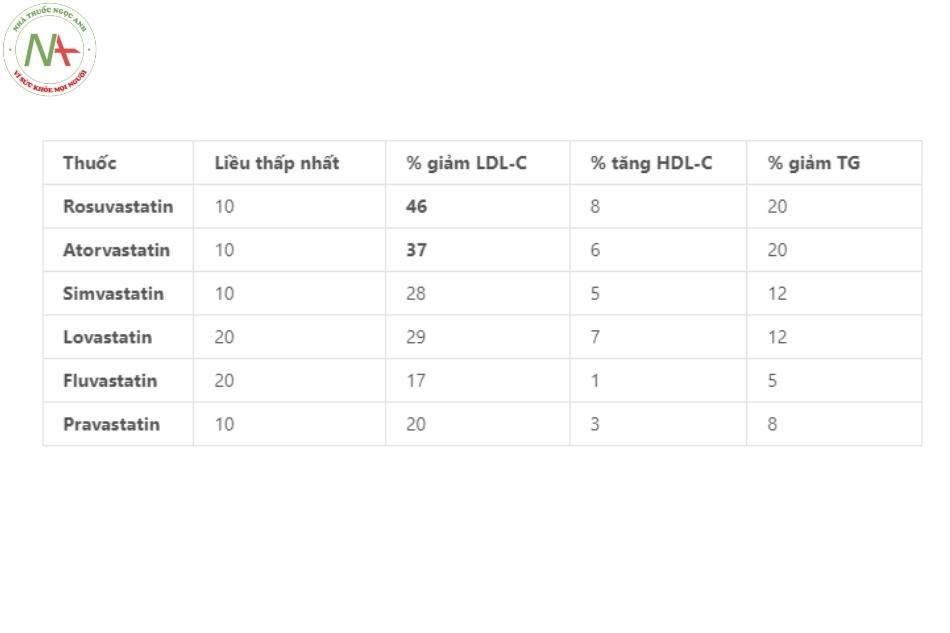
Khi tăng gấp đôi liều dùng của các statin chỉ làm giảm thêm khoảng 5% lượng cholesterol toàn phần và giảm được 7% LDL cholesterol, do đó cần đổi sang statin mạnh hơn trong trường hợp không đáp ứng điều trị.
Tất cả các statin, ngoại trừ pravastatin, đều có tỷ lệ gắn protein huyết tương cao và các statin này có khả năng thay thế các thuốc liên kết với albumin, như warfarin. Ví dụ, dùng chung rosuvastatin hoặc simvastatin có thể dẫn đến tăng thời gian prothrombin.
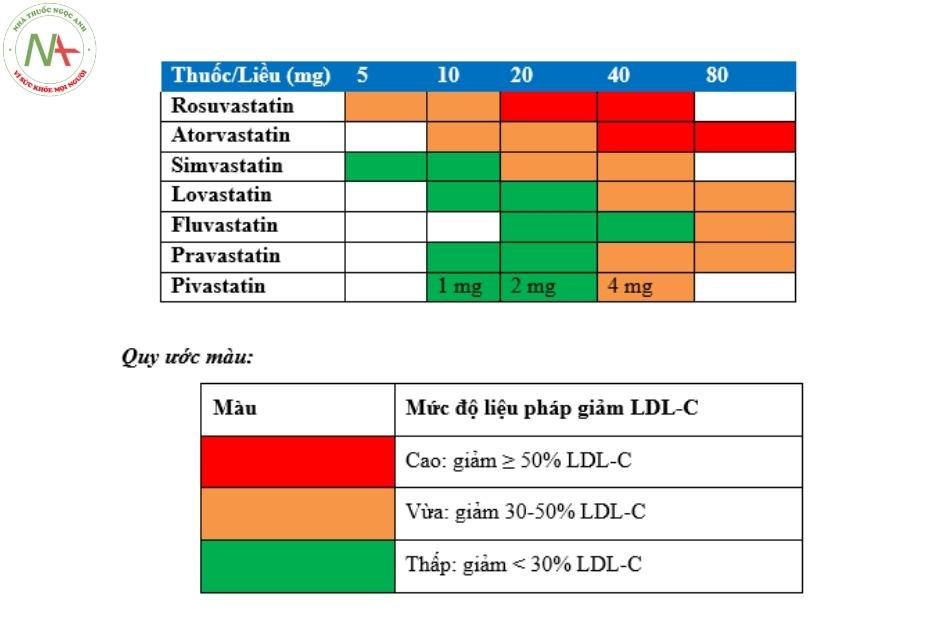
Bảng 6.2: Bảng phân loại các statins theo mức độ giảm LDL-C
| Statin cường độ cao (giảm 50% LDL-C) | Statin cường độ trung bình(giảm 30% đến <50% LDL-C) | Statins cường độ thấp (giảm 30% LDL-C) |
| Rosuvastatin, 20-40 mg | Rosuvastatin, 5-10 mg | |
| Atorvastatin, 40-80 mg | Atorvastatin, 10-20 mg | |
| Simvastatin, 20-40 mg | Simvastatin, 10 mg | |
| Pravastatin, 40-80 mg | Pravastatin, 10-20 mg | |
| Lovastatin, 40 mg | Lovastatin, 20 mg | |
| Pitavastatin, 2-4 mg | Pitavastatin, 1 mg | |
| Fluvastatin, 80 mg | Fluvastatin, 20-40 mg |
Statin chuyển hóa tại gan thông qua các enzyme cytochrome P450 (CYP). Tương tác giữa statin và các thuốc khác xảy ra do sự tác động qua lại với các isoenzyme CYP do kích thích hoặc ức chế.
Các thuốc nhóm này không nên dùng quá gần bữa ăn và có thể dùng 1 lần trong ngày trước khi đi ngủ. Các statin khác nhau có hiệu lực giảm nồng độ LDL-C khác nhau. Thực tế, liều dùng của statin được tính dựa trên hoạt lực và đích điều trị cần đạt (LDL-C).
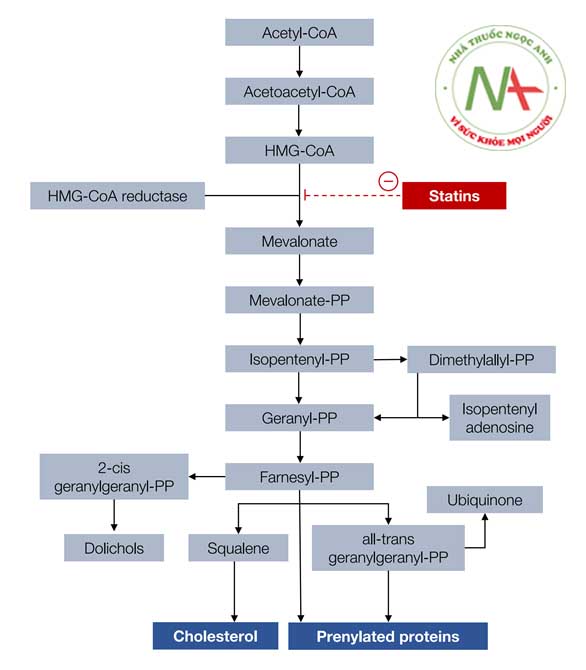
Chỉ định
Statin được chỉ định chính trong điều trị rối loạn lipid máu để phòng ngừa các biến cố tim mạch tiên phát và thứ phát.
Mục tiêu điều trị dựa trên phân tầng nguy cơ và nồng độ các thành phần lipid máu. Tùy theo tầng nguy cơ mà có một đích điều trị khác nhau. Những thành phần lipid máu được khuyến cáo là chỉ số xác định đích điều trị như sau:
- LDL-C là đích điều trị chính.
- Cholesterol toàn phần (TC) có thể coi là đích điều trị nếu không có các xét nghiệm khác.
- Nên đánh giá trong quá trình điều trị để có kế hoạch can thiệp khi bệnh nhân rối loạn lipid máu có tăng triglyceride nhiều.
- Non-HDL-C hoặc Apo B là đích điều trị thứ hai ở bệnh nhân rối loạn lipid máu thể hỗn hợp, đái tháo đường, hội chứng chuyển hóa hoặc bệnh thận mạn.
- Tỷ lệ apoB/apoA1 và non-HDL-C/HDL-C không còn được khuyến cáo là đích điều trị thường quy.
Mục tiêu điều trị rối loạn lipid máu (theo ESC 2019):
Dự phòng tiên phát:
- Nhóm nguy cơ rất cao: Mục tiêu giảm LDL-C ≥ 50% so với mức nền (khi bệnh nhân chưa được điều trị bằng bất kỳ thuốc hạ lipid máu nào) và đích LDL-C < 1,4 mmol/L (< 55 mg/dL).
- Nhóm nguy cơ cao: Mục tiêu giảm LDL-C ≥ 50% so với mức nền (khi bệnh nhân chưa được điều trị bằng bất kỳ thuốc hạ lipid máu nào) và đích LDL-C dưới 1,8 mmol/L (< 100 mg/dL).
- Nhóm nguy cơ vừa: Mức LDL-C tốt nhất dưới 2,6 mmol/L (< 115 mg/dL).
- Nhóm nguy cơ thấp: Mức LDL-C tốt nhất dưới 3,0 mmol/L (< 116 mg/dL).
- Mục tiêu phụ bao gồm: Non – HDL; apo-B. Trong đó mục tiêu của non-HDL tương ứng với mục tiêu LDL-C + 0,8 mmol/L cho từng nhóm nguy cơ nói trên. Mục tiêu của apo-B cho các nhóm bệnh nhân nguy cơ rất cao, cao và trung bình lần lượt là 65,80 và 100 mg/dL.
Dự phòng thứ phát:
- Nguy cơ rất cao: Mục tiêu giảm LDL-C ≥ 50% so với mức nền (khi bệnh nhân chưa được điều trị bằng bất kỳ thuốc hạ lipid máu nào) và đích LDL-C < 1,4 mmol/L (< 55 mg/dL).
- Nếu bệnh nhân đang điều trị liều statin tối đa dung nạp được xảy ra biến cố tim mạch lần 2 (không nhất thiết phải cùng một loại biến cố tim mạch lần đầu) trong vòng 2 năm, có thể cân nhắc thay đổi mục tiêu LDL-C thành 1,0 mmol/L.
Bốn nhóm bệnh nhân sử dụng Statin sẽ mang lại hiệu qủa điều trị cao nhất
- Bệnh nhân có bệnh tim mạch do xơ vữa (ASCVD)
- Tăng tiên phát LDL-cholesterol ≥ 190 mg/dL
- Đái tháo đường có tuổi từ 40-75 kèm LDL-cholesterol 70-189 mg/dL và không kèm ASCVD
- Nguy cơ 10 năm ASCVD ≥ 7.5%, không kèm bệnh ASCVD hoặc đái tháo đường kèm LDL-C 70-189 mg/dL
Chống chỉ định
- Phụ nữ đang mang thai và cho con bú do ảnh hưởng tới thai nhi.
- Bệnh nhân mắc bệnh gan giai đoạn hoạt động hoặc tăng men gan kéo dài không giải thích được.
- Bệnh nhân quá mẫn cảm với bất kỳ thành phần nào của thuốc.
Simvastatin và lovastatin bị chống chỉ định khi sử dụng đồng thời với các chất ức chế CYP3A4 mạnh (ví dụ: itraconazole, ketoconazole, posaconazole, voriconazole, ức chế HIV protease, boceprevir, telaprevir, kháng sinh macrolid erythromycin và clarithromycin, kháng sinh ketolid telithromycin, thuốc chống trầm cảm nefazodone sản phẩm chứa cobicistat). Simvastatin chống chỉ định ở những bệnh nhân sử dụng gemfibrozil, cyclosporin hoặc danazol. Pitavastatin chống chỉ định trong khi dùng đồng thời cyclosporine.
Tác dụng không mong muốn
- Tổn thương cơ là một tác dụng không mong muốn phổ biến khi sử dụng statin. Tổn thương cơ có thể ở dạng tiêu cơ vân có hoặc không có tổn thương thận cấp. Sử dụng statin với các chất ức chế CYP làm tăng nguy cơ tổn thương cơ và nên ngừng sử dụng nếu nồng độ CK tăng cao rõ rệt hoặc bệnh cơ được chẩn đoán hoặc nghi ngờ.
- Chỉnh liều statin được khuyến cáo khi sử dụng cùng gemfibrozil, cyclosporin hoặc thuốc ức chế CYP3A4. Cần thận trọng ở những bệnh nhân có yếu tố dễ gây tổn thương cơ: Trên 65 tuổi, nữ, suy giáp chưa được điều trị hoặc suy thận. Các triệu chứng tại cơ thường hết trong vòng 2 tháng sau khi ngừng thuốc.
- Nếu các triệu chứng từ nhẹ đến trung bình, có thể tạm ngừng statin cho đến khi các triệu chứng được đánh giá lại. Nếu các triệu chứng đau cơ hết và nếu không còn chống chỉ định, bệnh nhân có thể được sử dụng liều ban đầu hoặc liều thấp hơn để tìm mối liên quan giữa các triệu chứng tại cơ và liệu pháp statin. Nếu đau cơ xuất hiện trở lại nên ngừng sử dụng statin cho đến khi các triệu chứng đau cơ hết, bắt đầu dùng liều lại và đổi sang statin khác.
- Các thuốc điều trị rối loạn lipid khác (như ezetimibe, chất cô lập acid mật (BAS) và niacin) là thuốc thay thế ở bệnh nhân không dung nạp statin.
- Tổn thương gan: Với mức tăng alanine aminotransferase (ALT) nhỏ hơn 1,2% và tăng lên 2,3% với liều cao. Tăng men gan thường xảy ra trong 3 tháng đầu điều trị (có thể liên quan đến thay đổi thành phần lipid của màng tế bào gan, dẫn đến tăng tính thấm). Nên kiểm tra nồng độ AST và ALT trước khi bắt đầu điều trị. Tổn thương gan nặng do statin là rất hiếm. Tuy nhiên, nếu có tổn thương gan và không tìm thấy nguyên nhân khác, cần giảm liều hoặc đổi sang thuốc điều trị rối loạn lipid máu khác.
- Giảm trí nhớ và nhầm lẫn cũng đã được báo cáo khi sử dụng statin; tuy nhiên, những triệu chứng này rất hiếm gặp, thường không nghiêm trọng, không dẫn đến suy giảm nhận thức và thường phục hồi sau khi ngừng sử dụng statin. Thời gian khởi phát rất thay đổi, từ một ngày đến nhiều năm sau khi sử dụng thuốc.
- Tăng nguy cơ mắc bệnh đái tháo đường: Điều trị bằng statin có liên quan đến tăng tỷ lệ đái tháo đường mới xuất hiện. Trong một phân tích tổng hợp trên 13 nghiên cứu trên 91.140 bệnh nhân, nhóm sử dụng statin tăng 9% nguy cơ đái tháo đường type 2 có ý nghĩa thống kê. Nguy cơ này cao hơn ở nhóm người cao tuổi. Phân tích kết quả của nghiên cứu JUPITER cho thấy nguy cơ đái tháo đường cao hơn ở những nhóm bệnh nhân có một hoặc nhiều hơn các yếu tố nguy cơ đái tháo đường. Các bằng chứng khác cũng ủng hộ quan điểm này liên quan đến nhiều thuốc thuộc nhóm statin như rosuvastatin, atorvastatin, pravastatin. Cơ chế của hiện tượng này có thể liên quan đến tình trạng giảm tiết insulin ở tụy và giảm nhạy cảm của insulin ở ngoại biên. Tuy nhiên, Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) cho rằng lợi ích dự phòng và giảm biến cố tim mạch của statin vượt xa nguy cơ rất thấp liên quan đến sự gia tăng nồng độ glucose.
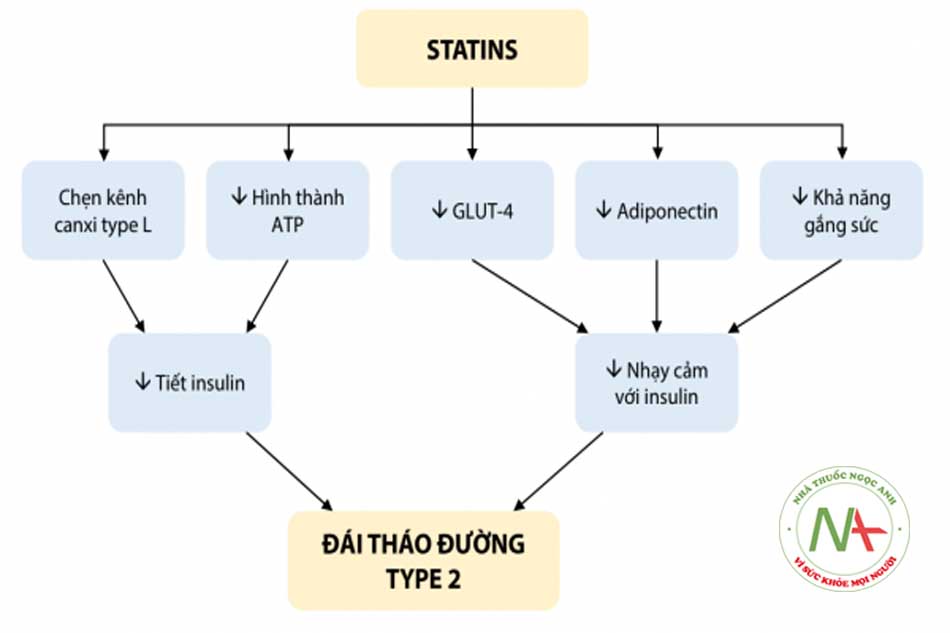
GLUT-4 (Glucose transporter type 4): Kênh vận chuyển glucose type 4.
So sánh các chỉ số dược động học của các thuốc Statins
Hấp thu
Khi dùng chung với thực phẩm sẽ làm tăng sự hấp thu của lovastatin và làm giảm hấp thu của fluvastatin, atorvastatin và pravastatin. Simvastatin và rosuvastatin thì không bị ảnh hưởng khi dùng chung với thực phẩm.
Phân bố
Atorvastatin, simvastatin, lovastatin thuộc nhóm thân dầu.
Pravastatin, fluvastatin, rosuvastatin thuộc nhóm thân nước.
Các statin thân dầu thì có khả năng vượt qua được hàng rào máu não nên có thể gây ra một số tác dụng không mong muốn hiếm gặp trên hệ TKTW.
Các statin thân nước thì lại có tính chọn lọc ở gan cao hơn và cũng ít ảnh hưởng đến sự phát triển của cơ trơn.
Tất cả các statin đều có khả năng liên kết tốt với protein huyết tương ( trừ pravastatin chỉ khoảng 50%) nên dễ dàng tranh chấp được với các thuốc có khả năng liên kết mạnh với albumin khác, ví dụ như warfarin.
Chuyển hóa
Lovastatin và simvastatin là tiền dược nên cần phải được thủy phân tạo thành dạng acid hydroxy để có hoạt tính.
Các statin khác được sử dụng ngay dưới dạng acid hydroxy đã có hoạt tính.
Các statin đều bị chuyển hoá qua gan, trừ pravastatin.
Atorvastatin, simvastatin, lovastatin đều được chuyển hóa qua CYP 3A4
Rosuvastatin và fluvastatin được chuyển hóa bởi CYP 2C9.
Thải trừ
Rosuvastatin, simvastatin, fluvastatin, pravastatin được bài tiết chủ yếu qua phân, Atorvastatin và lovastatin thì lại được thải trừ chủ yếu ở mật.
Một số statin trên lâm sàng
a. Atorvastatin
Liều khởi đầu được khuyến cáo là 10 – 20mg (tối đa 80mg) ngày một lần. Atorvastatin có thể được dùng như một liều duy nhất vào bất cứ lúc nào trong ngày, không phân biệt thời gian bữa ăn. Nồng độ lipid nên được xét nghiệm lại sau vòng 2-4 tuần và nên điều chỉnh liều theo mục tiêu điều trị. Suy thận không ảnh hưởng đến nồng độ atorvastatin trong huyết tương, do đó không cần điều chỉnh liều ở bệnh nhân suy giảm chức năng thận.
Một số lưu ý:
- Atorvastatin nên tránh ở những bệnh nhân dùng cyclosporine, thuốc ức chế protease của virus gây suy giảm miễn dịch ở người (HIV), tipranavir phối hợp với ritonavir hoặc thuốc ức chế protease của virus viêm gan C, telaprevir.
- Cần thận trọng (và sử dụng liều thấp nhất cần thiết) khi kê đơn atorvastatin kết hợp với phối hợp thuốc ức chế protease HIV, lopinavir phối hợp với ritonavir.
- Liều atorvastatin nên được giới hạn ở mức 20 mg/24h khi sử dụng với clarithromycin, itraconazole hoặc ở những bệnh nhân nhiễm HIV sử dụng kết hợp saquinavir cộng với ritonavir, darunavir cộng với ritonavir, fosamprenavir hoặc fosamprenavir với ritonavir.
- Ở những bệnh nhân HIV dùng nelfinavir hoặc thuốc ức chế protease của viêm gan C, boceprevir, liều atorvastatin không được vượt quá 40mg/24h.
b. Rosuvastatin
Liều khởi đầu được khuyến cáo của rosuvastatin là 10-20 mg (liều tối đa 40 mg) mỗi ngày một lần vào bất cứ lúc nào trong ngày.
Đối với bệnh nhân bị tăng LDL-C (> 190 mg/dL) ở mức cao hoặc cần kiểm soát chặt chẽ nồng độ LDL-C có thể cân nhắc dùng liều khởi đầu 20 mg. Sau khi bắt đầu hoặc sau khi chỉnh liều rosuvastatin, cần xét nghiệm nồng độ lipid sau 2 – 4 tuần và chỉnh liều theo mục tiêu điều trị. Liều 40 mg chỉ nên sử dụng cho những bệnh nhân chưa đạt được mục tiêu LDL-C khi sử dụng liều 20 mg. Bắt đầu điều trị bằng rosuvastatin với liều 5 – 10 mg mỗi ngày tùy theo mức LDL-C ban đầu và LDL-C mục tiêu.
Một số lưu ý:
- Rosuvastatin được chuyển hóa qua men CYP450-2C9, không chuyển hóa qua men CYP450-3A4 nên ít gặp tương tác thuốc hơn. Tuy nhiên nên tránh sử dụng rosuvastatin với gemfibrozil và liều giới hạn ở mức 10 mg/24h nếu phải sử dụng. Liều rosuvastatin không được vượt quá 5 mg/24h khi sử dụng với cyclosporine. Cần thận trọng khi dùng phối hợp rosuvastatin với thuốc ức chế protease kết hợp với ritonavir. Liều rosuvastatin nên giới hạn ở mức 10 mg/24h khi được điều trị kết hợp với ritonavir cộng với lopinavir hoặc ritonavir cộng với atazanavir. Thận trọng khi dùng cùng niacin, fenofibrate, colchicine hoặc coumarin.
- Ở những bệnh nhân bị suy thận nặng (GFR <30 mL/phút/1,73m2) và chưa phải chạy thận nhân tạo nên bắt đầu liều 5 mg/24h và không vượt quá 10 mg/24h. Ở bệnh nhân chạy thận nhân tạo, nồng độ thuốc trong huyết tương cao hơn khoảng 50% người bình thường. Nên giảm liều rosuvastatin ở bệnh nhân có protein niệu hoặc tiểu máu chưa rõ nguyên nhân.
c. Simvastatin
Liều khởi đầu thông thường được khuyến cáo là 10 – 20 mg/24h (liều tối đa 40 mg). Tuy nhiên, đối với bệnh nhân có nguy cơ tim mạch cao, liều khởi đầu là 40mg/24h. Do tăng nguy cơ tiêu cơ vân, đặc biệt trong năm đầu điều trị nên nếu không đạt mục tiêu LDL-C khi sử dụng liều 40 mg cần kết hợp thêm nhóm thuốc khác hoặc chuyển sang statin cường độ cao thay vì tăng liều lên 80 mg.
Sử dụng kết hợp simvastatin với các chất ức chế CYP3A4 mạnh, gemfibrozil, cyclosporin hoặc danazol là chống chỉ định (Xem phần “Chống chỉ định”). Khi dùng thuốc cùng verapamil, diltiazem hoặc dronedarone thì liều hằng ngày không được vượt quá 10 mg/24h và không vượt quá 20 mg/24h khi dùng cùng với amiodarone, amlodipine hoặc ranolazine.
d. Pitavastatin
Liều khởi đầu được khuyến cáo là 2 mg/24h (liều tối đa 4 mg/24h). Cần xét nghiệm nồng độ lipid sau 2 – 4 tuần để chỉnh liều. Bệnh nhân suy thận vừa và nặng (GFR 30 – 59 mL/phút/1,73m2 và 15 – 29 mL/phút/1,73 m2, tương ứng) cũng như bệnh thận giai đoạn cuối chạy thận nhân tạo, liều khởi đầu là 1 mg/24h và liều tối đa 2 mg/24h.
Chống chỉ định dùng pitavastatin đồng thời với cyclosporin. Liều không vượt quá 1 mg/24h ở bệnh nhân dùng erythromycin và 2 mg/24h ở bệnh nhân dùng rifampicin. Nên tránh dùng pitavastatin với gemfibrozil và thận trọng khi dùng cùng với nhóm fibrate. Việc giảm liều nên được xem xét ở những bệnh nhân dùng niacin. Nên thận trọng khi dùng cùng colchicine do nguy cơ tăng nguy cơ bệnh về cơ.
e. Fluvastatin
Phạm vi liều khuyến cáo là 20-80 mg/24h. Khởi đầu liều 20 mg khi cần giảm LDL-C dưới 25%. Khi cần giảm LDL-C hơn 50%, liều khởi đầu là 40 mg, uống vào buổi tối. Có thể dùng đến liều 80mg (dạng phóng thích kéo dài (XR) dùng một lần duy nhất hoặc 80 mg chia 2 lần/24h). Các viên dạng XR không nên bị nghiền nát hoặc bị nhai khi uống.
Liều fluvastatin nên giới hạn ở 20 mg x 2 lần/24h nếu đang dùng cyclosporin hoặc fluconazole. Sử dụng thận trọng fluvastatin khi bệnh nhân đang dùng fibrate, niacin, glibenclamide, phenytoin hoặc coumarin.
Fluvastatin chưa được nghiên cứu ở liều lớn hơn 40 mg ở bệnh nhân suy thận nặng, do đó nên thận trọng khi điều trị cho những đối tượng này ở liều cao hơn. Fluvastatin có thể dùng mà không liên quan đến bữa ăn. Giảm tối đa mức LDL-C có thể đạt được trong vòng 4 tuần.
f. Pravastatin
Liều khởi đầu khuyến cáo cho pravastatin là 40 mg x 1 lần/24h. Nếu liều này không đạt được mức cholesterol mong muốn, liều 80 mg/24h có thể được sử dụng. Ở bệnh nhân bị suy thận đáng kể nên bắt đầu từ liều 10 mg/24h.
Pravastatin có thể được dùng liều duy nhất vào bất kỳ thời điểm nào trong ngày. Vì tác dụng tối đa đạt được trong vòng 4 tuần nên cần xét nghiệm lipid máu để chỉnh liều trong khoảng thời gian này.
Bắt đầu pravastatin ở liều 10 mg và không vượt quá 20 mg/24h khi dùng cùng với cyclosporine. Liều không vượt quá 40 mg/24h khi dùng cùng với clarithromycin. Nên tránh pravastatin ở những bệnh nhân dùng gemfibrozil và thận trọng khi dùng cùng fibrate khác hoặc colchicine. Nên giảm liều ở bệnh nhân dùng niacin.
g. Lovastatin
Liều khởi đầu thông thường được khuyến cáo là 20 mg x 1 lần/24h với bữa ăn tối. Phạm vi liều là 10 – 80 mg/24h trong một lần hoặc chia hai lần. Có thể cân nhắc khởi đầu liều 10 mg khi cần giảm LDL-C dưới 20%. Cần điều chỉnh liều trong khoảng thời gian 4 tuần trở lên. Ở bệnh nhân suy thận nặng, cân nhắc khi cho liều trên 20 mg/24h.
Việc sử dụng lovastatin với các chất ức chế mạnh CYP3A4 là chống chỉ định. Nên tránh dùng cùng gemfibrozil hoặc cyclosporine. Liều lovastatin không vượt quá 20 mg/24h khi dùng cùng với danazol, diltiazem, dronedarone hoặc verapamil và không vượt quá 40 mg/24h khi dùng cùng với amiodarone. Cần thận trọng khi dùng chung với colchicine hoặc ranolazine vì nguy cơ bệnh cơ, bao gồm cả tiêu cơ vân.
FIBRATE
Fibrate được coi là liệu pháp đầu tiên cho bệnh nhân tăng triglyceride máu nặng. Các thuốc nhóm fibrate làm giảm nồng độ triglyceride 20- 50% làm tăng HDL-C khoảng 10-20%, LDL-C có thể giảm 5 – 20% nhưng LDL-C có thể tăng nếu nồng độ chất béo trung tính cao.
Sơ lược về nhóm thuốc fibrate
Nhóm thuốc chủ vận receptor có nhân PPAR-α hay còn gọi là fibrates. Đây là các thuốc có tác dụng điều trị rối loạn lipoprotein trong máu như các statin tuy nhiên cơ chế tác dụng thì lại khác nhau.
Vào giữa những năm 1950, Fibrate đầu tiên được tổng hợp.
Đến năm 1953, Fibrate mới được phát triển lâm sàng đến từ những nhà nghiên cứu người Pháp.
Năm 1962, clofibrate là một hợp chất hiệu quả nhất với độc tính tối thiểu, được phát hiện bởi Thorp và Waring. Mặc dù là hợp chất này trước đây được mô tả vào năm 1947 bởi 2 nhà hóa học người Ý Galimberti và Defranceschi, và được đề cập đến vào năm 1956 bởi các nhà nghiên cứu người Pháp. Clofibrate cho tác dụng làm hạ lipid trên động vật.
Vào năm 1967, Clofibrate đã được FDA Hoa Kỳ chấp thuận trong điều trị tăng lipid máu.
Vào cuối những năm 1970, đầu những năm 1980, gemfibrozil được giới thiệu ở Hoa Kỳ và bezafibrate, ciprofibrate được giới thiệu ở Châu u.
Một số thuốc thuộc nhóm này có thể kể đến là: bezafibrate, clofibrate, ciprofibrate, fenofibrate, gemfibrozil…
Cơ chế tác dụng
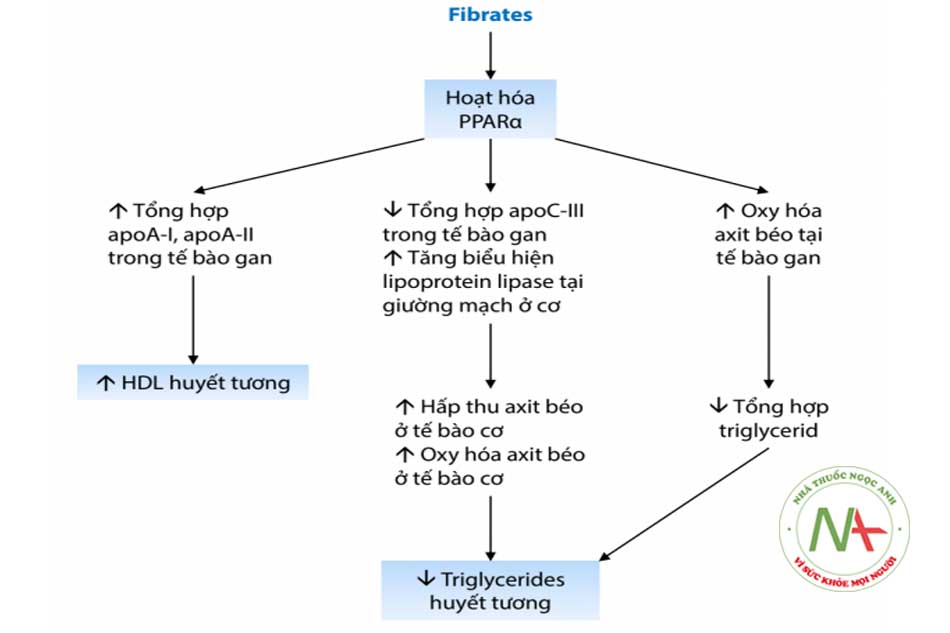
Có nhiều cơ chế giúp fibrate giảm nồng độ triglyceride trong huyết tương:
- Ức chế tổng hợp acid béo.
- Tăng sự dị hóa acid béo bằng cách kích thích sự hấp thu của ty thể và oxy hóa các acid béo.
- Giảm sản xuất triglyceride bằng cách ức chế diacylglycerol acyltransferase 2 (DGAT2), một loại enzyme xúc tác sự hình thành triglyceride từ diglyceride.
- Tăng khả năng thủy phân chất béo trung tính của VLDL (và chylomicrons) bằng cách kích thích biểu hiện lipoprotein lipase (LPL). Hoạt động của LPL cũng được tăng cường bởi sự giảm biểu hiện của apolipoprotein gan-C3, một lipoprotein làm suy giảm hoạt động LPL.
- Liệu pháp fibrate dường như có tác dụng hiệp đồng với niacin trên HDL-C, vì cơ chế hoạt động của chúng bổ sung cho nhau. Fibrate kích thích sản xuất apo-A1 ở gan trong khi niacin ức chế quá trình dị hóa này.
Dược động học của thuốc
- Gemfibrozil được hấp thụ hoàn toàn sau khi uống, đạt nồng độ đỉnh trong huyết tương 1-2h sau khi dùng thuốc. Cả tốc độ và mức độ hấp thu của thuốc đều tăng khi dùng trước bữa ăn nửa giờ, vì vậy nên dùng thuốc trước bữa ăn. Phần lớn thuốc được đào thải qua thận với thời gian bán thải là khoảng 1,1h.
- Fenofibrate là một tiền chất của hợp chất hoạt động, acid fenofibric. Fenofibrate được chuyển đổi bằng cách thủy phân este thành acid fenofibric. Liên kết protein là khoảng 99%. Acid fenofibric được chuyển hóa bằng cách kết hợp với acid glucuronic và bài tiết chủ yếu qua nước tiểu (60%) dưới dạng acid fenofibric và acid furofibric glucuronide. Khoảng 25% được bài tiết qua phân. Cả acid fenofibrate và fenofibric đều không trải qua quá trình chuyển hóa oxy hóa bởi CYP P450 ở mức độ đáng kể. Thời gian bán hủy khoảng 20h.
- Bezafibrate có thời gian bán hủy là 1-2h và gắn với protein là 94-96%. Bài tiết gần như hoàn toàn qua thận, với 95% được phục hồi qua nước tiểu.
Chống chỉ định và thận trọng
- Chống chỉ định bao gồm phản ứng quá mẫn với thuốc hoặc tiền sử bệnh gan đang hoạt động (bao gồm cả những người bị xơ gan mật nguyên phát) và bất thường chức năng gan dai dẳng không giải thích được, rối loạn chức năng thận nặng (bao gồm cả bệnh nhân được lọc máu) hoặc bệnh túi mật.
- Sự kết hợp của gemfibrozil với thuốc hạ đường huyết là chống chỉ định vì nguy cơ hạ đường huyết nặng.
- Fibrate là thuốc loại C khi mang thai và chỉ nên sử dụng trong thai kỳ nếu lợi ích vượt qua được nguy cơ tiềm ẩn cho thai nhi. Fibrate chống chỉ định ở các bà mẹ cho con bú vì tính chất tạo u được thấy trong các nghiên cứu trên động vật.
Liều dùng
a. Fenofibrate
- Liều khuyến cáo của fenofibrate sẽ khác nhau tùy sản phẩm được sử dụng. Liều ban đầu được đề nghị của acid fenofibric là 135 mg mỗi ngày một lần.
- Đối với bệnh nhân suy chức năng thận nên giảm liều ban đầu của fenofibrate hoặc acid fenofibric. Nên dùng liều thấp khi mức lọc cầu thận (GFR) dưới 60 mL/phút và có thể được dùng mà không liên quan đến bữa ăn. Fenofibrate và acid fenofibric không nên sử dụng nếu suy thận vừa hoặc nặng (ví dụ, nếu GFR <30 mL/phút). Chức năng thận nên được đánh giá trước khi bắt đầu sử dụng fibrate. Nếu trong quá trình theo dõi, GFR giảm liên tục xuống mức ≤ 30 mL/phút nên ngừng sử dụng fibrate.
- Cần thận trọng khi dùng kết hợp colchicine vì các trường hợp bị bệnh cơ, bao gồm cả tiêu cơ vân đã được báo cáo.
b. Gemfibrozil
- Liều khuyến cáo của gemfibrozil là 600 mg hai lần một ngày, dùng 30 phút trước bữa ăn sáng và tối. Cần chỉnh liều theo GFR với liều giảm xuống 600 mg mỗi ngày một lần khi GFR dưới 60 mL/phút. Không khuyến cáo sử dụng fibrate ở những bệnh nhân chạy thận nhân tạo lâu dài, cửa sổ điều trị hẹp. Đã có báo cáo về việc làm suy giảm chức năng thận ở bệnh nhân có creatinin nền lớn hơn 2,0 mg/dL và cần xem xét dùng liều thấp hơn so với điều trị thay thế.
- Khi kết hợp gemfibrozil với thuốc chống đông máu, cần thận trọng và giảm liều thuốc chống đông máu nhằm ngăn ngừa biến chứng chảy máu.
c. Bezafibrate
- Liều lượng khuyến cáo của bezafibrate là 200 mg hai lần hoặc ba lần một ngày (hoặc 400mg hằng ngày dạng giải phóng chậm), với sự điều chỉnh liều theo mức lọc cầu thận.
- Dạng giải phóng chậm không sử dụng ở bệnh nhân có GFR < 60 mL/phút.
Tác dụng không mong muốn
- Tổn thương cơ đã được báo cáo khi sử dụng fibrate và nguy cơ tăng lên khi fibrate được dùng cùng với statin, đặc biệt ở bệnh nhân cao tuổi và ở bệnh nhân đái tháo đường, suy thận hoặc suy giáp. Tỷ lệ bệnh cơ xảy ra với gemfibrozil và statin ước tính cao hơn 33 lần so với statin kết hợp với fenofibrate. Nên tránh kết hợp trừ khi lợi ích của việc thay đổi nồng độ lipid có thể cao hơn nguy cơ tăng thêm khi phối hợp thuốc này.
- Sử dụng fenofibrate với liều 96 – 145 mg/24h có liên quan đến sự gia tăng transaminase gan trong huyết thanh. Trong một phân tích tổng hợp của 10 thử nghiệm đối chứng giả dược, tăng ULN gấp 3 lần xảy ra ở 5,3% bệnh nhân dùng fenofibrate (so với 1,1% trên giả dược). Tỷ lệ tăng ALT liên quan đến điều trị bằng fenofibrate xuất hiện liên quan đến liều dùng. Các xét nghiệm chức năng gan, bao gồm ALT nên được theo dõi định kỳ trong khi điều trị và ngừng điều trị nếu nồng độ enzyme tăng kéo dài hơn 3 lần so với ULN.
- Fenofibrate có thể làm tăng nồng độ creatinin 10 – 20%, vì vậy cần theo dõi chức năng thận định kỳ ở bệnh nhân suy thận. Nguyên nhân của tình trạng tăng còn chưa rõ ràng mặc dù các fibrate có thể làm tăng sản xuất creatinine mà không làm suy giảm GFR. Fenofibrate và bezafibrate có nguy cơ gây tăng creatinine nhiều hơn so với gemfibrozil.
- Fibrate làm thay đổi thành phần đường mật, giảm hàm lượng acid mật và tăng hàm lượng cholesterol. Tăng tiết mật có thể là một cơ chế chính để loại bỏ cholesterol ra khỏi cơ thể nhưng làm tăng sản xuất mật.
- Viêm tụy đã được báo cáo ở những bệnh nhân dùng fenofibrate hoặc gemfibrozil.
- Thuyên tắc phổi xảy ra ở 1% nhóm dùng fenofibrate, so với 0,7% ở nhóm giả dược (p = 0,022) trong thử nghiệm FIELD. Đặc biệt, điều trị bằng fibrate và fenofibrate được biết là làm tăng mức homocysteine.
Vị trí của các thuốc Fibrate trong khuyến cáo điều trị rối loạn lipid của Hội tim mạch Việt Nam
- Hạ triglyceride ở mức khuyến cáo I
- Có khả năng làm tăng HDL – cholesterol
- Giảm 13% biến cố tim mạch chính, chủ yếu biến cố mạch vành.
- Có vai trò trong rối loạn lipid hỗn hợp.
- Phối hợp statin + fenofibrate: hiệu quả và an toàn
- Giảm nguy cơ tim mạch cho bệnh nhân đái tháo đường có rối loạn lipid làm sinh xơ vữa khi dùng đơn trị hoặc phối hợp statin.
- Có vai trò trong hội chứng chuyển hóa.
EZETIMIBE
Ezetimibe nằm trong nhóm các hợp chất làm giảm nồng độ lipid, thuốc có tác dụng ức chế chọn lọc sự hấp thụ cholesterol của ruột non. Ezetimibe làm giảm LDL-C, triglyceride và tăng HDL ở bệnh nhân tăng lipid máu kết hợp. Đáp ứng tối đa thường đạt được trong vòng 2 tuần và được duy trì trong suốt quá trình trị liệu. Việc bổ sung ezetimibe vào statin hoặc fenofibrate có hiệu quả trong việc hạ lipid hơn so với chỉ dùng một trong hai thuốc. Tuy nhiên, tác dụng của ezetimibe như là một đơn trị liệu hoặc bổ sung cho statin hoặc fenofibrate lên tỷ lệ mắc bệnh và tử vong do tim mạch chưa được biết đến.
Sơ lược về nhóm thuốc Ezetimibe
Ezetimibe là thuốc dùng để điều trị tăng cholesterol trong máu và một số thay đổi bất thường về lipid trong máu khác. Khi dùng đơn độc, nó ít được ưa thích hơn là nhóm thuốc statin. Để tăng hiệu quả điều trị trong một số trường hợp, có thể kết hợp ezetimibe với các thuốc nhóm statin (simvastatin) .
Vào năm 2002, Ezetimibe đã được chấp thuận cho sử dụng trong điều trị tại Hoa Kỳ.
Năm 2016, Ezetimibe được sử dụng ngày ngày càng phổ biến, đây là loại thuốc được kê đơn xếp loại 144 các thuốc bán nhiều nhất tại Hoa Kỳ với hơn 4 triệu đơn thuốc.
Một số đại diện của nhóm: Ezetrol, Atozet.
Cơ chế tác dụng
Ezetimibe ức chế chất vận chuyển sterol là protein NPC1L1 ở các tế bào diềm bàn chải ở thành ruột. Việc giảm cholesterol cung cấp cho gan làm giảm lượng dự trữ cholesterol ở gan và tăng bù cho các thụ thể LDL và do đó làm giảm cholesterol máu.
Dược động học
Ezetimibe được chuyển hóa chủ yếu ở ruột non và gan thông qua liên hợp glucuronide với bài tiết qua đường mật và thận sau đó. Cả ezetimibe và chất chuyển hóa glucuronide có thời gian bán hủy là 22h. Bài tiết của thuốc là 78% trong phân và 11% trong nước tiểu. Ezetimibe liên kết cao (> 90%) với protein huyết tương. Ezetimibe không phải là chất ức chế cũng không phải là chất cảm ứng của các isoenzyme CYP P450.
Chỉ định
Ezetimibe được chỉ định là đơn trị liệu hoặc kết hợp với liệu pháp statin để giảm tình trạng tăng LDL-C ở những bệnh nhân bị tăng lipid máu nguyên phát. Thuốc cũng được chỉ định sử dụng kết hợp với fenofibrate để giảm LDL-C và cholesterol không HDL ở những bệnh nhân bị tăng lipid máu hỗn hợp.
Chống chỉ định
- Suy gan trung bình hoặc nặng (Child-Pugh > 7).
- Chống chỉ định kết hợp của ezetimibe với statin ở những bệnh nhân mắc bệnh gan đang hoạt động hoặc transaminase tăng cao kéo dài không giải thích được.
- Ezetimibe là một thuốc loại C với phụ nữ mang thai. Hiện tại không có nghiên cứu đầy đủ và kiểm soát tốt về ezetimibe ở phụ nữ mang thai.
Liều dùng
Liều khuyến cáo của ezetimibe là 10mg mỗi ngày một lần. Không cần điều chỉnh liều ở bệnh nhân suy gan hoặc thận nhẹ hoặc ở bệnh nhân lớn tuổi. Cần thận trọng khi sử dụng đồng thời ezetimibe và cyclosporine.
Tác dụng không mong muốn
Các phản ứng bất lợi thường được báo cáo nhất trong các thử nghiệm ezetimibe kết hợp statin là viêm mũi họng (3,7%), đau cơ (3,2%) và đau khớp (2,6%).
Đơn trị liệu ezetimibe không gây ra sự gia tăng đáng kể men gan. Mặc dù tỷ lệ tăng nồng độ transaminase ở gan ≥ 3 lần so với ULN là tương tự giữa ezetimibe và giả dược, tỷ lệ tăng transaminase cao hơn ở những bệnh nhân sử dụng ezetimibe kết hợp với statin (1,3%) so với bệnh nhân điều trị bằng statin đơn thuần (0,4%). Mức độ tăng là nhẹ, thoáng qua, có thể đảo ngược và không có ý nghĩa lâm sàng rõ ràng. Một đánh giá có hệ thống về các thử nghiệm lâm sàng ngẫu nhiên đã chứng minh rằng so với điều trị bằng ezetimibe đơn độc, liệu pháp phối hợp với statin không dẫn đến sự gia tăng đáng kể về nguy cơ tăng transaminase, đau cơ, tăng CPK, tiêu cơ vân, tác dụng không mong muốn tiêu hóa hoặc ngừng điều trị do tác dụng không mong muốn.
Theo dõi tính an toàn liên tục cho đơn trị liệu ezetimibe là không cần thiết; tuy nhiên, khi sử dụng với statin, các xét nghiệm chức năng gan nên được thực hiện khi bắt đầu điều trị và theo khuyến nghị của statin. Nếu tăng ALT hoặc AST trên 3 lần mức bình thường và kéo dài nên ngừng ezetimibe và/hoặc statin.
THUỐC GẮN ACID MẬT-RESIN
Sơ lược về nhóm Resin
Nhóm resin hay có tên gọi khác là nhựa gắn acid mật. Chúng có bản chất là các nhựa tham gia trao đổi ion. Tuy nhiên do chỉ là nhựa trao đổi ion nên chỉ sau khi ngừng dùng thuốc 3-6 tháng, lượng cholesterol toàn phần và LDL-Cholesterol tăng trở lại.
Các biệt dược thường được biến đến của nhóm thuốc này: Cholestyramine, Colestipol và Colesevelam.
Cơ chế tác dụng
Thuốc gắn acid mật là các polyme lớn liên kết các acid mật tích điện âm và muối mật trong ruột non, làm mất vai trò của các chất này.
Trong quá trình tiêu hóa bình thường, acid mật được tiết ra trong mật từ gan và túi mật vào ruột. Các acid mật làm nhũ hóa các chất béo và lipid có trong thực phẩm, tạo điều kiện cho việc hấp thụ chất béo và vitamin hòa tan trong mỡ từ chế độ ăn uống. Một phần chính của acid mật được tiết ra được tái hấp thu từ ruột và trở về gan thông qua tuần hoàn cửa, tạo nên chu kỳ ruột gan. Tuy nhiên, khoảng 5% không được tái hấp thu và acid mật bổ sung được tổng hợp từ cholesterol của gan.
Khi acid mật giảm, cholesterol trong gan được chuyển thành acid mật và có sự tăng bù trừ các thụ thể LDL. Đơn trị liệu với thuốc gắn acid mật làm giảm LDL xuống 5-30% phụ thuộc vào liều.
Việc giảm hàm lượng cholesterol trong tế bào gan thúc đẩy sự gia tăng các thụ thể LDL và tăng thanh thải LDL khỏi tuần hoàn.
Giảm LDL-C thường thấy rõ trong vòng 2 tuần với colesevelam và 1 tháng với colestipol và cholestyramine.
Chỉ định
Các thuốc gắn acid mật được chỉ định để giảm LDL khi dùng đơn trị liệu hoặc kết hợp với statin để giảm LDL-C tăng ở những bệnh nhân bị tăng lipid máu nguyên phát.
Chống chỉ định
Chống chỉ định ở những bệnh nhân có tiền sử tắc ruột, tắc nghẽn đường mật hoàn toàn, tăng triglyceride lớn hơn 500 mg/dL và có tiền sử viêm tụy do triglyceride hoặc quá mẫn.
Cholestyramine và colestipol là thuốc nhóm C đối với phụ nữ mang thai. Việc sử dụng thuốc trong khi mang thai hoặc cho con bú hoặc bởi phụ nữ trong độ tuổi sinh đẻ đòi hỏi cân nhắc giữa lợi ích tiềm năng với nguy cơ đối với mẹ hoặc con.
Colesevelam là thuốc loại B dành cho bệnh nhân có thai và có thể sử dụng trong thai kỳ nếu cần thiết.
Liều dùng
a. Cholestyramine
Liều khởi đầu được đề nghị là 4 g, một hoặc hai lần mỗi ngày. Liều duy trì hằng ngày là 8-16 g, chia làm 2 lần. Cân nhắc tăng liều thuốc nếu mục tiêu điều trị không đạt được sau thời gian 4 tuần. Liều tối đa hằng ngày là 24 g, nên dùng thuốc cùng bữa ăn. Mặc dù thuốc được khuyến cáo dùng hai lần một ngày, cholestyramine có thể được dùng chia liều 1-6 lần trong ngày.
b. Colestipol
Liều khởi đầu nên là 5 g dạng hạt nhỏ một hoặc hai lần mỗi ngày hoặc hai viên 1g một lần hoặc hai lần mỗi ngày. Tăng liều 5 g dạng hạt nhỏ/24h hoặc 2 g dạng viên/24h cứ sau 1 – 2 tháng. Liều thường dùng là 5 – 30 g/24h dạng hạt nhỏ hoặc 2-16 g dạng viên/24h một lần hoặc chia liều.
c. Colesevelam
Liều dùng là sáu viên 625 mg mỗi ngày một lần hoặc chia làm hai lần. Thuốc nên được dùng cùng với bữa ăn và uống nhiều nước.Thuốc có thể được dùng cùng lúc với statin hoặc hai loại thuốc có thể dùng cách nhau. Colesevelam có khả năng và ái lực với acid mật lớn hơn so với cholestyramine hoặc colestipol, vì vậy thuốc có thể được sử dụng ở liều thấp hơn. Sau khi bắt đầu, nên kiểm tra lipid máu sau 4-6 tuần. Không có khuyến cáo cụ thể hoặc cách điều chỉnh liều khi dùng colesevelam cho bệnh nhân suy gan.
Tác dụng không mong muốn
Chất gắn acid mật có thể gây ra hoặc làm nặng thêm chứng táo bón từ trước. Để giảm thiểu tác dụng không mong muốn lên đường tiêu hóa khi dùng thuốc gắn acid mật nên dùng liều ban đầu thấp. Khi bị táo bón, tăng lượng chất lỏng và chất xơ trong khẩu phần ăn. Tác dụng không mong muốn ít gặp hơn bao gồm khó chịu ở bụng, đau bụng, đầy hơi, buồn nôn và nôn.
Thuốc gắn acid mật không được khuyến cáo ở những bệnh nhân bị viêm dạ dày, rối loạn vận động đường tiêu hóa khác, ở những người đã phẫu thuật đường tiêu hóa lớn hoặc những người có nguy cơ bị tắc ruột và những người bị tắc nghẽn đường mật hoàn toàn.
Chất gắn acid mật có thể làm tăng triglyceride. Ví dụ, colesevelam có thể làm tăng triglyceride lên 5% ở những bệnh nhân bị tăng lipid máu nguyên phát; tuy nhiên, mức tăng trung bình của triglyceride là 18-22% đã được báo cáo trong các nghiên cứu lâm sàng điều trị bệnh nhân đái tháo đường type 2. Xét nghiệm nồng độ lipid lúc đói nên được thực hiện trước khi bắt đầu điều trị thuốc gắn acid mật, 3 tháng sau khi bắt đầu, và cứ sau 6 – 12 tháng sau đó. Nên ngừng dùng thuốc gắn acid mật nếu triglyceride vượt quá 400 mg/dL.
Sử dụng thuốc gắn acid mật kéo dài có thể liên quan đến tăng khả năng chảy máu do giảm prothrombin máu và thiếu vitamin K. Ngoài ra, tình trạng giảm folate huyết thanh hoặc hồng cầu đã được báo cáo khi sử dụng cholestyramine và colestipol giảm folate huyết thanh hoặc hồng cầu mạn tính đã được báo cáo… Các chất gắn acid mật có thể làm giảm sự hấp thu các vitamin tan trong chất béo. Bệnh nhân đang điều trị vitamin nên uống vitamin ít nhất 4h trước khi dùng các thuốc gắn acid mật.
NIACIN
Sơ lược về nhóm acid nicotinic
Các tên gọi khác của nhóm này là Vitamin PP, Vitamin B3, Niacin.
Vào năm 1873, Nicotinic acid lần đầu tiên được mô tả bởi nhà hóa học Hugo Weidel trong một nghiên cứu về nicotine. Tuy nhiên, khái niệm về các thành phần thực phẩm ngoài protein, chất béo và carbohydrate cần thiết cho sự sống đã xuất hiện từ nhiều năm về trước.
Danh pháp của các vitamin ban đầu có tính theo bảng chữ cái, theo đó, những loại vitamin A tan được trong chất béo và B tan trong nước. Theo thời gian, đã có 8 vitamin B tan trong nước, do sự khác biệt về các tính chất hóa học, nên chúng đã được phân lập và đánh số, với nicotinic acid (hay còn gọi là niacin) được phân lập thành là vitamin B3. Vitamin PP là một đồng phân dạng amid của vitamin B3.
Cơ chế tác dụng
Niacin hoạt động thông qua thụ thể kết hợp protein G (GPR109A) trong tế bào mỡ, ức chế sự hình thành adenosine monophosphate nội bào và điều hòa quá trình phân giải mỡ (bằng cách giảm hoạt hóa lipase, ví dụ như lipase nhạy cảm với hormone). Điều này dẫn đến việc giảm lượng acid béo tự do được giải phóng từ tế bào mỡ có sẵn cho gan để sản xuất triglyceride và VLDL. Giảm nồng độ VLDL dẫn đến giảm sản xuất IDL và LDL ở gan và ngoại biên. Niacin cũng ức chế tế bào gan DGAT-2 và giảm tổng hợp triglyceride trong tế bào gan làm giảm triglyceride kết hợp trong VLDL.
Chỉ định
Niacin được chỉ định để giảm LDL và triglyceride tăng và để tăng HDL ở bệnh nhân tăng cholesterol máu nguyên phát hoặc rối loạn lipid máu hỗn hợp. Niacin là một biện pháp thay thế cho statin khi điều trị hạ LDL-C. Niacin cũng được chỉ định là liệu pháp bổ trợ để hạ triglyceride ở bệnh nhân tăng triglyceride máu nặng.
Chống chỉ định
- Bệnh gan đang hoạt động hoặc tăng transaminase kéo dài không giải thích được
- Loét dạ dày đang hoạt động.
- Niacin phóng thích kéo dài là một thuốc loại C khi mang thai. Cần cân nhắc giữa lợi ích và nguy cơ khi điều trị ở phụ nữ có thai.
- Vì niacin được bài tiết vào sữa mẹ nên có khả năng xảy ra phản ứng bất lợi ở trẻ bú mẹ.
Liều dùng
- Niacin giải phóng tức thì: Liều thông thường: 1 – 2 g chia 2 – 3 lần/24h. Liều khởi đầu 250 mg uống sau bữa ăn tối hằng ngày. Tần suất dùng thuốc và tổng liều hằng ngày có thể tăng lên sau 4 – 7 ngày cho đến khi đạt được mức LDL-C và/hoặc triglyceride mong muốn hoặc đạt được liều 1,5 – 2 g. Nếu mục tiêu không đạt được sau 2 tháng, có thể tăng liều trong khoảng thời gian 2 – 4 tuần lên 1 g x 3 lần/24h hoặc chuyển sang nhóm thuốc khác.
- Niacin giải phóng kéo dài: Nên bắt đầu liều 500 mg/24h để giảm tỷ lệ mắc và mức độ nghiêm trọng của tác dụng không mong muốn và không nên tăng hơn 500 mg trong giai đoạn 4 tuần. Liều duy trì là 1-2 g mỗi 24h. Uống vào lúc đi ngủ với một bữa ăn nhẹ ít béo. Khi kết hợp với statin, liều statin cần thấp hơn liều tối đa cho phép.
- Khi chuyển từ niacin giải phóng nhanh sang giải phóng chậm nên bắt đầu với tổng liều thấp hơn. Nên thận trọng khi dùng niacin giải phóng chậm ở bệnh nhân suy thận hoặc suy gan.
Tác dụng không mong muốn
Các phản ứng bất lợi phổ biến nhất là đỏ bừng mặt, tiêu chảy, buồn nôn, nôn, ho và ngứa. Đỏ mặt đã được báo cáo ở 88% bệnh nhân trong các thử nghiệm. Acid nicotinic gây nóng bừng mặt thông qua liên kết với thụ thể GPR109A và trung gian giải phóng các prostaglandin giãn mạch từ các tế bào Langerhans trong các lớp hạ bì. Các triệu chứng thường kéo dài trong 30-60 phút. Việc đỏ bừng mặt có thể được giảm bớt về tần suất hoặc mức độ nghiêm trọng bằng việc sử dụng aspirin (lên tới liều khuyến cáo là 325 mg) trong 30 phút trước khi dùng niacin.
Trong các nghiên cứu lâm sàng, có 1% phải ngừng điều trị do tăng transaminase lớn hơn 2 lần ULN (Upper limit of normal – giới hạn trên của bình thường). Trong các nghiên cứu kết hợp statin và niacin, 1% có kinh nghiệm cho thấy có thể đảo ngược khi tăng AST hoặc ALT lên hơn 3 lần ULN. Cần theo dõi nồng độ transaminase trong huyết thanh, bao gồm AST và ALT trước khi bắt đầu điều trị, cứ sau 6 tuần và 12 tuần trong năm đầu tiên và định kỳ 3 – 6 tháng sau đó. Nên ngừng sử dụng thuốc nếu nồng độ transaminase tăng lên, đặc biệt nếu chúng tăng gấp 3 lần ULN và vẫn kéo dài hoặc nếu chúng có liên quan đến triệu chứng buồn nôn, sốt hoặc khó chịu. Nhiễm độc gan nặng đã xảy ra ở bệnh nhân thay thế niacin giải phóng nhanh bằng niacin giải phóng chậm ở liều tương đương. Niacin nên thận trọng khi bệnh nhân sử dụng một lượng lớn rượu hoặc có tiền sử bệnh gan. Dạng giải phóng chậm tăng nguy cơ nhiễm độc gan.
Nguy cơ mắc bệnh cơ và tiêu cơ vân tăng khi dùng statin cùng với niacin giải phóng chậm, đặc biệt ở bệnh nhân cao tuổi, đái tháo đường, suy thận hoặc suy giáp không được kiểm soát.
Nên thận trọng khi sử dụng acid nicotinic ở bệnh nhân đau thắt ngực không ổn định hoặc trong giai đoạn cấp tính của nhồi máu cơ tim, đặc biệt khi những bệnh nhân này cũng đang dùng thuốc vận mạch vì niacin có thể làm tăng tác dụng của các thuốc này dẫn đến hạ huyết áp tư thế.
Niacin giải phóng kéo dài có thể làm tăng nồng độ glucose và glycosylated hemoglobin (HbA1C) trong huyết thanh (nhưng nói chung < 5 mmol/L và < 0,3% tương ứng). Nồng độ glucose nên được theo dõi ở bệnh nhân đái tháo đường hoặc có khả năng mắc bệnh đái tháo đường, đặc biệt là trong vài tháng đầu sử dụng hoặc điều chỉnh liều
THUỐC DẠNG KHÁNG THỂ ĐƠN DÒNG ỨC CHẾ ENZYME PCSK9
Cơ chế tác dụng
- Protein convertase subtilisin/kexin type 9 (PCSK9) là enzyme loại serine protease, được mã hoá bởi gen PCSK9 và sản xuất tại gan. PCSK9 gắn vào receptor của lipoprotein trọng lượng phân tử thấp (LDL-R) trên bề mặt tế bào gan, dẫn đến thoái giảm số lượng receptor này và do đó làm tăng nồng độ LDL-C trong máu.
- Kháng thể kháng PCSK9 tương tác với vị trí gắn của nó trên LDL-R, làm tăng bộc lộ LDL-R và từ đó làm giảm nồng độ LDL-C (hình 6.5).
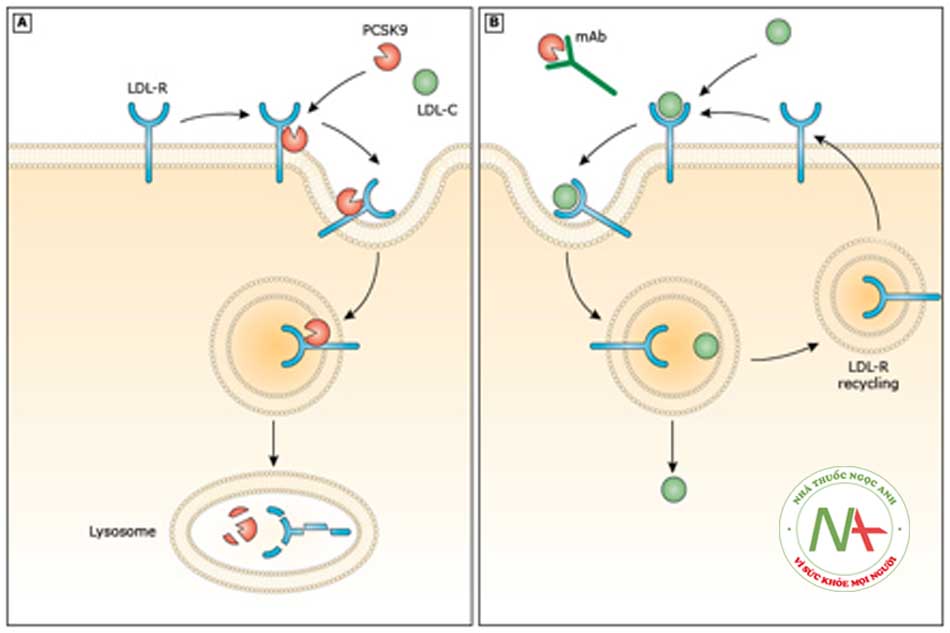
- Alirocumab và evolocumab là các kháng thể đơn dòng người có khả năng gắn vào PCSK9 tự do trong huyết tương, làm tăng thoái hoá enzyme này, qua đó làm giảm nồng độ PCSK9. Điều này giúp tăng số lượng LDL-R được tái sử dụng trên bề mặt tế bào gan, làm giảm nồng độ LDL-C trong máu. Các kháng thể này đặc hiệu với PCSK9 và không gắn vào các enzyme khác trong họ PCSK.
- Inclisiran là chất bất hoạt, làm giảm biểu hiện của mRNA, qua đó làm giảm nồng độ PCSK9 thông qua việc ức chế tổng hợp PCSK9.
- Các thử nghiệm gần đây cho thấy, nhóm thuốc này làm giảm LDL-C rất hiệu quả và khi phối hợp với statin sẽ làm giảm mạnh hơn nữa LDL-C và giảm các biến cố lâm sàng. Nguyên nhân là dùng statin có thể gây hồi ứng tăng nồng độ PCSK9, qua đó làm giảm tác dụng hạ LDL-C của statin.
Chỉ định
Vào năm 2015, Cục quản lý Dược phẩm và thực phẩm Hoa Kỳ FDA đã chấp nhận sử dụng các thuốc ức chế PCSK9 đầu tiên: Praluent (alirocumab) và Repatha (evolocumab).
Các chỉ định của nhóm thuốc này bao gồm:
- Tăng cholesterol máu có tính gia đình loại đồng hợp tử.
- Rối loạn lipid máu tiên phát khó đáp ứng với các thuốc điều trị rối loạn lipid máu khác.
- Kiểm soát nồng độ LDL-C mục tiêu khi khó khống chế bởi statin đơn thuần.
- Dự phòng các biến cố tim mạch thứ phát.
Liều dùng
- Alirocumab (Praluent):
- Dạng đóng gói: 75, 150 mg/ml, sử dụng đơn độc, bút tiêm đóng sẵn.
- Liều khởi đầu: Một liều 75 mg mỗi 2 tuần
- Liều duy trì: Một liều 75 – 150 mg mỗi 2 tuần.
- Cần kiểm tra lại LDL-C trong vòng 4-8 tuần sau khi bắt đầu điều trị để chỉnh liều.
- Có thể khởi đầu ngay bằng liều 150 mg mỗi tuần nếu bệnh nhân có tăng cholesterol máu tính chất gia đình thể đồng hợp, dị hợp hoặc có nguy cơ rất cao với nồng độ LDL-C >50% so với mục tiêu cần đạt.
- Evolocumab (Repatha):
- Dạng đóng gói: 140 mg/mL, sử dụng đơn độc, bút tiêm đóng sẵn.
- Liều trong điều trị rối loạn lipid máu tiên phát hoặc hỗn hợp:
- Một liều 140 mg mỗi 2 tuần hoặc
- Một liều 420 mg mỗi tháng
- Tăng cholesterol máu có tính gia đình thể đồng hợp tử:
- Một liều 420 mg mỗi tháng
- Có thể tới tăng tới một liều 420 mg mỗi 2 tuần sau 12 tuần (nếu bệnh nhân đang lọc huyết tương chu kỳ)
Tác dụng không mong muốn
Mặc dù tác dụng khá mạnh trong điều trị rối loạn lipid máu nhưng các thuốc PCSK9 đều có nhược điểm. Cả hai thuốc trên cần phải được tiêm sau mỗi 2-4 tuần nên gây bất tiện cho khá nhiều người và cũng là những thuốc đắt tiền.
Một số tác dụng không mong muốn của các chất ức chế PCSK9 bao gồm:
- Các tác dụng phụ trên da: phát ban, sưng, đau, mày đay, chàm, ngứa, viêm mạch quá mẫn, bầm tím ở vị trí tiêm.
- Các triệu chứng thần kinh: lú lẫn, khó tập trung, ngủ gà.
- Các triệu chứng cảm lạnh, cúm.
- Đau lưng.
- Một số lo ngại khác:
- Ảnh hưởng đến hoạt động của HCV.
- Tăng tỷ lệ mắc u đại tràng.
- Tăng đề kháng insulin và đái tháo đường.
CÁC THUỐC ĐIỀU TRỊ RỐI LOẠN LIPID MÁU KHÁC
- Thuốc ức chế enzyme CETP (cholesteryl ester transfer protein): Torcetrapib, Dalcetrapib (đây là một protein trong huyết tương xúc tác cho việc chuyển cholesteryl ester (CE) từ HDL-C trao đổi với TG từ apoB có chứa lipoprotein (VLDL và LDL). Tuy nhiên, các thử nghiệm lâm sàng hiện tại chưa cho thấy lợi ích rõ ràng thuốc này trên các biến cố tim mạch.
- Thuốc ức chế trực tiếp apoB: Mipomersen, thường được dùng trong rối loạn lipid máu có tính gia đình thể đồng hợp tử. Tại thời điểm hiện tại, thuốc đã được phê duyệt bởi FDA nhưng chưa được phê duyệt bởi EMA .
- Thuốc ức chế MTP (microsomal triglyceride transfer protein): Lomitapide ức chế chuyển triglyceride và phospholipid từ hệ thống nội bào nhẵn vào Apo-B, qua đó giảm sự tạo thành VLDL và chylomicron. Chỉ định dùng trong bệnh rối loạn lipid có tính chất gia đình thể đồng hợp tử.
Xem thêm:
Thuốc chẹn kênh canxi: Cơ chế, cách dùng trong điều trị tim mạch
Rung nhĩ mới khởi phát: Nguyên nhân, chẩn đoán và hướng dẫn điều trị theo BMJ
TÀI LIỆU THAM KHẢO
- Lionel Opie Bernard Gersh. Drugs for the Heart, 8th Edition 2013. Elsevier.
- Bertram G. Katzung, MD, PhD. Basic & Clinical Pharmacology, Fourteenth Edition 2018, by McGraw-Hill Education.
- Kanu Chatterjee, Eric J Topol. Cardiac Drugs, Second Edition 2015, by Jaypee Brothers Medical Publishers
- Catapano AL, Graham I, De Backer G, et al. 2016 ESC/EAS Guidelines for the Management of Dyslipidaemias. Eur Heart J 2016; 37:2999.
- Lloyd-Jones DM, Morris PB, Ballantyne CM, et al. 2017 Focused Update of the 2016 ACC Expert Consensus Decision Pathway on the Role of Non-Statin Therapies for LDL-Cholesterol Lowering in the Management of Atherosclerotic Cardiovascular Disease Risk: A Report of the American College of Cardiology Task Force on Expert Consensus Decision Pathways. J Am Coll Cardiol 2017; 70:1785.
- Nissen SE, Stroes E, Dent-Acosta RE, et al. Efficacy and Tolerability of Evolocumab vs Ezetimibe in Patients With Muscle-Related Statin Intolerance: The GAUSS-3 Randomized Clinical Trial. JAMA 2016; 315:1580.
- Ouchi Y, Sasaki J, Arai H, et al. Ezetimibe Lipid-Lowering Trial on Prevention of Atherosclerotic Cardiovascular Disease in 75 or Older (EWTOPIA 75): A Randomized, Controlled Trial. Circulation 2019; 140:992.
- Cholesterol Treatment Trialists’ Collaboration. Efficacy and safety of statin therapy in older people: a meta-analysis of individual participant data from 28 randomised controlled trials. Lancet 2019; 393:407.
- Grundy SM, Stone NJ, Bailey AL, et al. 2018 AHA/ACC/AACVPR/AAPA/ABC/ACPM/ADA/AGS/APhA/ASPC/NLA/PCNA Guideline on the Management of Blood Cholesterol: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. J Am Coll Cardiol 2019; 73:e285.
- Silverman MG, Ference BA, Im K, et al. Association Between Lowering LDL-C and Cardiovascular Risk Reduction Among Different Therapeutic Interventions: A Systematic Review and Meta-analysis. JAMA 2016; 316:1289.
- Goldberg AC, Bays HE, Ballantyne CM, et al. Efficacy and safety of ABT-335 (fenofibric acid) in combination with atorvastatin in patients with mixed dyslipidemia. Am J Cardiol 2009; 103:515.
- Ballantyne CM, Davidson MH. Possible differences between fibrates in pharmacokinetic interactions with statins. Arch Intern Med 2003; 163:2394.
- Elam MB, Ginsberg HN, Lovato LC, et al. Association of Fenofibrate Therapy With Long-term Cardiovascular Risk in Statin-Treated Patients With Type 2 Diabetes. JAMA Cardiol 2017; 2:370.
- Selak V, Elley CR, Bullen C, et al. Effect of fixed dose combination treatment on adherence and risk factor control among patients at high risk of cardiovascular disease: randomised controlled trial in primary care. BMJ 2014; 348:g3318.
- Bahiru E, de Cates AN, Farr MR, et al. Fixed-dose combination therapy for the prevention of atherosclerotic cardiovascular diseases. Cochrane Database Syst Rev 2017; 3:CD009868.
- Sách Thuốc tim mạch trong thực hành lâm sàng (PGS.TS.BS. Phạm Mạnh Hùng)
Từ khóa » Cơ Chế Của Nhóm Fibrat
-
Các Nhóm Thuốc điều Trị Rối Loạn Lipid Máu | Vinmec
-
Fenofibrat - Dược Thư
-
Cơ Chế Tác Dụng, Chỉ định Tác Dụng Không Mong Muốn Của Nhóm ...
-
Thuốc Hạ Mỡ Máu Nhóm Fibrat: Cơ Chế, Chỉ định Và TDKMM - MPseno
-
Nhóm Thuốc Fibrates: Lịch Sử Phát Triển, Tác Dụng, Lưu ý Tác Dụng Phụ
-
Fenofibrat - Thuốc điiều Trị Hạ Lipid (mỡ) Máu Nhóm Fibrat
-
Nhóm Thuốc Fibrate Trị Mỡ Máu Cao: Chỉ định Và Lưu ý Khi Dùng
-
Fenofibrate: Dẫn Chất Của Acid Fibric, Là Thuốc Hạ Lipid Máu
-
Rối Loạn Lipid Máu - Cẩm Nang MSD - Phiên Bản Dành Cho Chuyên Gia
-
Fibrat Hạ Mỡ Máu Và Tác Dụng Phụ Hay Gặp?
-
Cập Nhật điều Trị Rối Loạn Lipid Máu – Phần II | Tim Mạch Học
-
Rối Loạn Chuyển Hóa Lipid Máu - Cục Y Tế Dự Phòng
-
Fenofibrat 100-US – Công Ty TNHH US Pharma USA, Việt Nam