Cách Pha Loãng Dung Dịch Axit Sunfuric (H2SO4) đậm đặc đặc An Toàn
Có thể bạn quan tâm
Axit sunfuric (H2SO4) là một hợp chất hóa học vô cùng quen thuộc trong đời sống. Tuy nhiên, cách pha loãng axit sunfuric đặc thì không phải ai cũng biết. Bài viết dưới đây sẽ cung cấp cho bạn một số thông tin cần thiết về cách sử dụng hợp chất này sao cho hiệu quả.
Mục lục- Tính chất của axit sunfuric
- Tính chất vật lý
- Tính chất hóa học
- Phương pháp điều chế axit sunfuric
- Ứng dụng của axit sunfuric trong đời sống
- Cách pha loãng axit sunfuric đặc đúng kỹ thuật
- Những lưu ý - cảnh báo khi pha loãng dung dịch axit sunfuric H2SO4 đặc
- Cách bảo quản axit sunfuric
Tính chất của axit sunfuric
Tính chất vật lý
- H2SO4 tồn tại dưới dạng chất lỏng, dạng nhớt, nặng hơn nước, khó bay hơi và có độ tan vô hạn trong nước.
- H2SO4 đặc có tính háo nước, hút nước mạnh và tỏa nhiều nhiệt.
- Axit sunfuric có khả năng làm than hóa các hợp chất hữu cơ.
Tính chất hóa học
1. Axit sunfuric loãng
- Axit sunfuric loãng là một axit mạnh với đầy đủ các tính chất hóa học chung của một axit, bao gồm:
+ Chuyển màu giấy quỳ tím thành màu đỏ.
+ Tác dụng với kim loại đứng trước hydro trong dãy hoạt động hóa học của kim loại.
K > Ba > Ca > Na > Mg > Al > Zn > Fe2+ > Ni > Sn > Pb > H > Cu > Hg+ > Ag > Pt >Au
Ví dụ:
Fe + H2SO4 → FeSO4 + H2
+ Tác dụng với bazơ tạo ra muối và nước
H2SO4 + NaOH → NaHSO4 + H2O
H2SO4 + 2NaOH → Na2SO4 + 2H2O
+ Axit sunfuric loãng tác dụng với oxit bazơ tạo ra muối và nước
H2SO4 + MgO → MgSO4 + H2O
H2SO4 + CuO → CuSO4 + H2O
+ Tác dụng với muối tạo thành muối mới, axit mới và kim loại trong muối giữ nguyên hóa trị.
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2
H2SO4 + BaCl2 → BaSO4 +2HCl
2. Axit sunfuric đặc
Trong axit sunfuric đặc thì S có mức oxi hóa +6 cao nhất, do đó H2SO4 đặc có tính axit mạnh, tính oxy hóa mạnh và có tính háo nước.
+ Tác dụng với kim loại tạo muối và nhiều sản phẩm oxy hóa khác nhau như SO2, H2S, S.
3Cr + 4H2SO4 đặc nóng → 3CrSO4 + 4H2O + S
- Tác dụng với phi kim
C + 2H2SO4 đặc nóng → CO2 +2SO2 + 2H2O
S +2H2SO4 đặc nóng → 3SO2 + 2H2O
- Tác dụng với các chất khử khác
H2SO4 đặc nóng + 8HI → H2S + 4I2 + 4H2O
- Tính háo nước
C12H22O11 + H2SO4 đặc nóng → 12C +11H2O
Phương pháp điều chế axit sunfuric
Trong công nghiệp, axit sunfuric được sản xuất từ lưu huỳnh, oxi và nước theo phương pháp tiếp xúc. Ngoài ra có thể sản xuất axit sunfuric từ quặng pirit sắt. Cụ thể quá trình diễn ra như sau:
- Đốt quang pirit sắt hoặc lưu huỳnh để tạo khí SO2
S + O2 → SO2
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
SO2 sinh ra sẽ bị oxy hóa thành lưu huỳnh trioxit bởi ôxi dưới sự có mặt của chất xúc tác oxit vanadi (V2O5)
2SO2 + O2 (xúc tác V2O5, nhiệt độ 450−500 oC )→ 2SO3
Sau đó hòa tan lưu huỳnh trioxit bằng nước.
SO3 + H2O → H2SO4
Ngoài ra, SO3 cũng bị hấp thụ bởi axit sunfuric và tạo thành ôleum (H2SO4.xSO3).
H2SO4 + xSO3 → H2SO4.xSO3
Ôleum sau đó phản ứng với nước để tạo axit sunfuric đậm đặc.
H2SO4.xSO3 + xH2O → (x+1)H2SO4
Ứng dụng của axit sunfuric trong đời sống
Axit sunfuric có công thức hóa học là H2SO4, là một loại axit vô cơ mạnh. Căn cứ vào các tính chất hóa học, axit sunfuric được ứng dụng trong rất nhiều lĩnh vực sản xuất:
- Sản xuất giấy, tơ sợi
- Phẩm nhuộm
- Ngành sơn
- Ngành luyện kim
- Sản xuất phân bón
- Sản xuất hóa chất tẩy rửa
- ...

Axit sunfuric được ứng dụng phổ biến trong đời sống làm chất tẩy rửa, chất déo, làm giấy,...
Đầu tiên, nó được gọi là một loại hóa chất thương mại. H2SO4 được sử dụng để sản xuất ra axit photphoric (H3PO4). Từ đó, nó cung cấp nhiên liệu phục vụ quá trình sản xuất phân hóa học, bột giặt, chất tẩy rửa,… Theo các nhà khoa học, có tới 60% quốc gia trên thế giới sử dụng axit sunfuric như một hóa chất không thể thiếu trong các dây chuyền sản xuất này.
Phương pháp được sử dụng là phương pháp ướt, dùng axit sunfuric để phân hủy hợp chất có trong quặng apatit.
Ca5(PO4)3X + 5H2SO4 + 10H2O → 3H3PO4 + 5CaSO4·2H2O + HX
Ngoài ra, đây còn là thành phần chính để sản xuất nhôm sunfat (công thức hóa học Al2(SO4)3), sản xuất nylon, dược phẩm, thuốc trừ sâu,…
Axit sunfuric còn có tác dụng bảo vệ môi trường. Khả năng làm sạch cống rãnh, những khu vực ô nhiễm đều được lọc sạch bằng những chất tẩy rửa có thành phần chính là axit sunfuric.
Cách pha loãng axit sunfuric đặc đúng kỹ thuật
Như đã biết, axit sunfuric phản ứng cực mạnh với nước. Nhiệt lượng tỏa ra từ phản ứng này lên tới 19KCal. Bởi vậy, người ta thường pha loãng axit sunfuric để sử dụng.
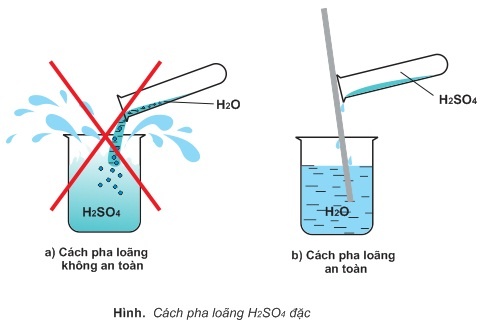
Axit sunfuric gặp nước
- Nguyên tắc pha loãng: muốn pha loãng h2so4 đặc phải Rót axit sunfuric (H2SO4) vào nước chứ không làm ngược lại.
- Thao tác pha loãng: Cho nước tinh khiết vào cốc thí nghiệm. Cho axit sunfuric vào một cốc khác. Tỷ lệ axit/nước bao nhiêu phụ thuộc vào độ loãng của dung dịch. Bạn cần sử dụng một chiếc đũa thủy tinh để thực hiện quá trình này. Sau đó, đặt chiếc đũa thủy tinh đứng thẳng, rót từ từ H2SO4 dọc theo thân đũa cho tới khi hết và khuấy nhẹ. Để an toàn nhất, các thao tác này nên được làm trong phòng thí nghiệm – nơi có đủ các dụng cụ thí nghiệm cần thiết. Nếu không bạn có thể thay thế bằng các vật dụng tương tự.
Những lưu ý - cảnh báo khi pha loãng dung dịch axit sunfuric H2SO4 đặc
Dường như cách pha loãng dung dịch axit sunfuric khá đơn giản và dễ hiểu. Vậy khi pha loãng cần lưu ý những điều gì?
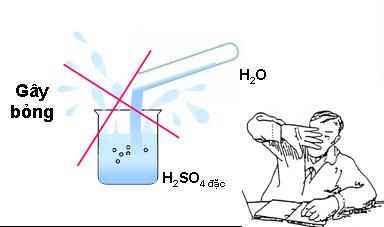
Không được đổ nước vào axit sunfuric đậm đặc
- Đầu tiên, không bao giờ được đổ nước vào axit sunfuric nguyên nhân là hóa chất này rất háo nước, nếu rót nước vào axit sunfuric sẽ có thể gây nổ, khiến bạn bị thương: bỏng rộp da, ăn mòn,…
- Không nên pha vào các bình thủy tinh vì bình thủy tinh dễ biến đổi bởi tác động của nhiệt. Đây là phản ứng tỏa nhiệt rất mạnh nên việc dùng các cốc nhựa là giải pháp hợp lý nhất.
- Không được để axit sunfuric tiếp xúc với da, mắt và đường hô hấp. Nếu hít phải axit sunfuric, bạn có thể bị ho, tức ngực, khó thở. Axit sunfuric dính vào mắt gây phồng rộp, rát, đỏ mắt,…Nói chung đây là một axit rất nguy hiểm với sức khỏe con người. Nếu rủi ro xảy ra, cách duy nhất là đưa nạn nhân tới các trạm y tế gần nhất để được hỗ trợ kịp thời. Hậu quả của quá trình pha loãng axit sunfuric không đúng cách chính là lời cảnh báo nghiêm trọng nhất đối với chúng ta.
Cách bảo quản axit sunfuric
- Bảo quản axit sunfuric trong các bồn, phuy nhựa. Tuyệt đối không sử dụng bồn chứa bằng nhôm, thiếc, inox và kẽm bởi axit sunfuric có tính ăn mòn kim loại rất mạnh.
- Đối với các bồn sắt lớn chứa axit sunfuric đều phải tráng lớp PU và đậy nắp kín, đặt nơi khô ráo, tránh xa nơi có chưa bazơ hay các chất khử.
- Không để gần các kim loại, kim loại nhẹ, các chất có tính axít để tránh gây cháy nổ như HCl, axit nitric, axit photphoric, ….
Bài viết là một số lưu ý nhỏ, mong rằng sẽ giúp ích cho bạn trong quá trình pha loãng axit sunfuric. Quý khách hàng có nhu cầu sử dụng axit sunfuric hãy truy cập cập website https://labvietchem.com.vn/ để xem thông tin chi tiết sản phẩm. Chúng tôi cung ứng số lượng lớn axit sunfuric đáp ứng các nhu cầu học tập và nghiên cứu hóa, lý sinh.
THAM KHẢO THÊM:
- Tác dụng của Axit HCL với đời sống và sản xuất
- Cách xử lý khi cơ thể tiếp xúc với axit: 5 điều tuyệt đối không nên là
Tìm kiếm liên quan:
- cách pha h2so4 10%
- cách pha loãng axit hno3
- điều chế axit sunfuric
Từ khóa » H2so4 Loãng
-
Axit Sunfuric Loãng: Tính Chất Hóa Học, Công Thức, ứng Dụng
-
Tính Chất Hóa Học Của H2so4 Loãng
-
Tính Chất Hóa Học Của Axit Sunfuric H2SO4 Và ứng Dụng - VOH
-
Axit Sunfuric H2SO4 Loãng: Phản ứng Và Các Dạng Bài Tập Cơ Bản
-
Chất Nào Sau đây Phản ứng được Với H2SO4 Loãng
-
Kim Loại Nào Không Tác Dụng Với H2SO4 Loãng
-
Chứng Minh Dd H2SO4 Loãng Có Những Tính Chất Hóa Học Của Axit
-
Tính Chất Hóa Học Của Axit Sunfuric (H2SO4) đặc Và Loãng - TopLoigiai
-
Tính Chất Hóa Học, Tính Chất Vật Lý Của Axit Sunfuric (H2SO4). Ví Dụ ...
-
Tính Chất Hóa Học Của Axit Sunfuric (H2SO4) Và ứng Dụng Trong Thực ...
-
Axit Sunfuric Là Gì? Tính Chất, ứng Dụng Và Lưu ý Khi Sử Dụng H2SO4
-
Cho Mình Hỏi S Có Tác Dụng Với H2so4 Loãng Không? - MTrend
-
Tính Axit Mạnh Của Dung Dịch H2SO4 Loãng