Cách Tính Số Mol: Công Thức Tính Và Bài Tập Minh Họa - LabVIETCHEM
Có thể bạn quan tâm
Khi làm quen với môn hóa học, có lẽ số mol, nồng độ mol là những thuật ngữ mà các em học sinh sẽ bắt gặp rất nhiều trong các bài học. Và đó cũng chính là những kiến thức đầu tiên mà các em phải nắm vững để bắt đầu bước vào chinh phục môn hóa học. Vậy mol, nồng độ mol là gì? Cách tính số mol ra sao? Hãy cùng LabVIETCHEM đi tìm hiểu những kiến thức thú vị về số mol qua bài viết sau đây nhé!
Cách tính số mol
Mục lục- Mol là gì?
- Nồng độ mol là gì?
- Các cách tính số mol
- +> Cách tính số mol nguyên tử, phân tử theo khối lượng
- +> Cách tính số mol của chất khí ở điều kiện tiêu chuẩn (đktc)
- Cách tính số mol dư
- Bài tập tính số mol, nồng độ mol
Mol là gì?

Mol là gì?
Trước khi tìm hiểu cách tính số mol, chúng ta cần phải biết được khái niệm mol là gì?
- Theo wikipedia, Mol hay mole (ký hiệu: mol), là đơn vị đo lường dùng trong hóa học nhằm diễn tả lượng chất có chứa 6,022.1023 số hạt đơn vị nguyên tử hoặc phân tử chất đó. Số 6,02214129(27)×1023 - được gọi là hằng số Avogadro (ký hiệu NA), như 1 mol sắt - Fe hay 6.1023 nguyên tử Fe.
- Mol là một trong các đơn vị cơ bản của hệ SI cho các hạt vi mô.Trong các phép biến đổi các đại lượng, ta có thể làm tròn: N = 6,023.1023.
- Tùy vào việc lựa chọn hạt đơn vị mà mol được chia thành hai loại, bao gồm mol nguyên tử và mol phân tử.
+ Mol nguyên tử của một nguyên tố chính là lượng nguyên tố đó có chứa NA nguyên tử chất nguyên tố đó, như mol nguyên tử kali sẽ có 6,02×1023 nguyên tử K.
+ Mol phân tử của một chất chính là lượng chất của NA phân tử của chất đó như 1 mol phân tử oxy sẽ có 6,022×1023 phân tử khí oxy.
Nồng độ mol là gì?

Nồng độ mol là gì?
Trong dung dịch có chứa cả chất tan và chất không tan. Lượng chất tan trong một thể tích dung môi cố định càng lớn thì nồng độ càng cao. Nồng độ này sẽ đạt giá trị cực đại khi dung dịch bão hòa tức chất tan gần như không thể hòa tan thêm vào dung dịch được nữa. Nếu vẫn cố thêm chất tan vào, hiện tượng phân tử bị kết tinh sẽ xảy ra, dẫn đến các pha cùng tồn tại hoặc tạo thể vấn (huyền phù)
- Nồng độ mol thể tích (M) (nồng độ phân tử gam) biểu thị số mol của một chất tan cho trước trong 1 lít dung dịch như trong 5 lít dung dịch có chứa 3 mol hạt tan tạo thành dung dịch 0,6 M, còn gọi là 0,6 phân tử gam. Sử dụng mol có nhiều ưu điểm vì nó cho phép đo số tuyệt đối các hạt có trong dung dịch, bất kể khối lượng và thể tích của chúng.
- Nồng độ molan hay nồng độ mol khối lượng (m) biểu thị số mol của một chất cho trước trong 1 kg dung môi như 4 kg dung môi chứa 3 mol hạt tan, tạo thành dung dịch có nồng độ 0,75 mol/kg, còn gọi là "0,75 molal."
- Nồng độ mol khối lượng bất biến theo nhiệt độ và có liên hệ với khối lượng dung môi hơn là thể tích dung dịch. Do đó, nồng độ mol khối lượng là một hằng số bất định, không phụ thuộc vào nhiệt độ và áp suất. Còn với nồng độ mol thể tích, nó sẽ tăng khi nhiệt độ giảm.
Các cách tính số mol
Các công thức tính số mol nguyên tử, phân tử
+> Cách tính số mol nguyên tử, phân tử theo khối lượng
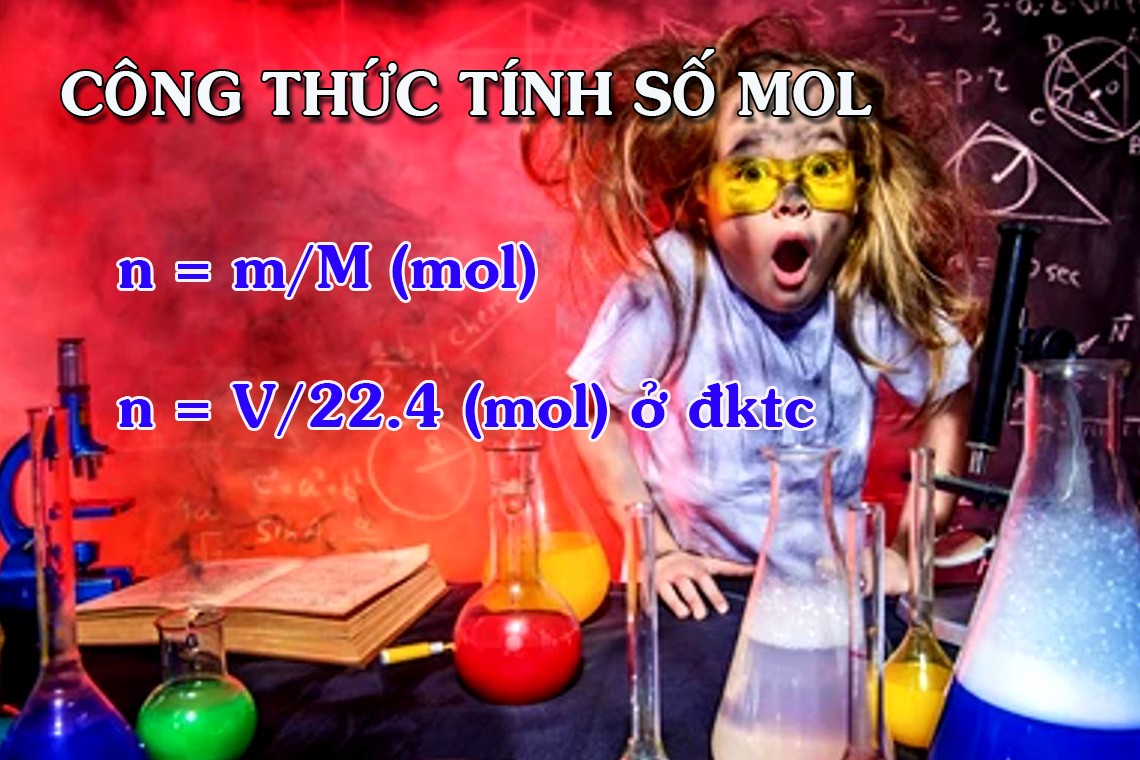
n = m/M
trong đó:
- n là số mol chất (mol).
- M là khối lượng mol (g/mol): Là khối lượng mol của chất đó tính ra gam của N phân tử hoặc nguyên tử chất đó. Khối lượng mol có giá trị bằng phân tử khối hoặc phân tử khối của chất đó như khối lượng mol nguyên tử cacbon – C là 12 g/mol, khối lượng mol của phân tử amoniac – NH3 là 17 g/mol.
Các bạn cần chú ý rằng, khối lượng mol của nguyên tử và phân tử là không giống nhau. Ví dụ, khối lượng mol của phân tử Nito – N2 là 28 g/mol còn khối lượng mol của nguyên tử Nito – N là 14 g/mol
- m là khối lượng của chất đó (g).
+> Cách tính số mol của chất khí ở điều kiện tiêu chuẩn (đktc)
- Thể tích mol của các chất khí ở cùng điều kiện nhiệt độ và áp suất là bằng nhau
- 1mol chất khí có thể tích 22,4 lít ở 0 độ C, 1atm tức là VH2 = VO2 = VSO2 = VN2 = 22,4 lít.
- 1 mol chất khí có thể tích 24 lít ở điều kiện phòng là 20 độ C, 1 atm.
Công thức tính số mol chất khí (đktc)
n = V/22,4
trong đó
- n là số mol chất khí (mol).
- V là thể tích chất khí ở điều kiện tiêu chuẩn (lít).
- 22,4 là hằng số trong điều kiện tiêu chuẩn.
Đối với trường hợp chất khí ở trạng thái tự nhiên, điều kiện khác với điều kiện tiêu chuẩn, bạn không thể sử dụng công thức trên mà phải cần tới những công thức và phép tính phức tạp hơn.
Cách tính số mol dư
Dạng bài toán có chất dư sau phả ứng. Bài toán sẽ cho biết lượng của 2 chất tham gia phản ứng và yêu cầu tính lượng chất được tạo thành. Trong số 2 chất tham gia sẽ có 1 chất phản ứng hết, chất còn lại có thể.
Các bước giải bài toán tính số mol dư:
B1: Tính số mol (đổi lượng chất đề bài cho ra số mol).
B2: Viết và cân bằng phương trình hóa học:
aA + bB → cC + dD
B3: So sánh tỉ lệ: ( nA, nB lần lượt là số mol của A và B)
+ 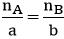
+ 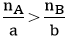
+ 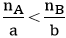
Tính lượng các chất theo chất phản ứng hết.
Công thức: Số mol (dư) = Tổng số mol ban đầu – tổng số mol đã phản ứng
Lưu ý: Với những bài toán cho cả lượng chất tham gia và lượng chất sản phẩm thì sẽ tính toán theo lượng chất sản phẩm.
Bài tập tính số mol, nồng độ mol
Ví dụ 1:
Cho 3,9 gam Kali vào dung dịch HCl dư. Tính thể tích khí hydro thu được ở điều kiện chuẩn.
Lời giải:
Phản ứng xảy ra theo 2 phương trình
2K + 2HCl → 2KCl + H2 ↑ (1)
2K + 2H2O → 2KOH + H2 ↑ (2)
Số mol Kali: nK = 3,9/39 = 0,1 mol
Theo phương trình phản ứng (1) và (2), nH2 = nK = 0,1 mol
Vậy thể tích khí hydro thu được ở điều kiện tiêu chuẩn là: VH2 = 0,1 x 22,4 = 2,24 lít.
Ví dụ 2:
Tính nồng độ mol của 5 lít dung dịch có chứa 0,5 mol NaCl.
Lời giải:
Nồng độ mol sẽ được tính như sau:
CM = 0,5/5 = 0,1M
Ví dụ 3 : Tính nồng độ mol của dung dịch khi hòa tan 15,8g KMnO4 trong 5 lít nước.
Lời giải:
Số mol của KMnO4 là: nKMnO4 = 15,8/158 =0,1 (mol)
Nồng độ mol của dung dịch: CM = 0,1/5 =0,02M
Ví dụ 4: Trong 100ml dung dịch có hòa tan 8 gam NaOH. Tính nồng độ mol của dung dịch.
Lời giải :
Ta có V = 100ml = 0,1 lít
nNaOH = 8/40 = 0,2 mol
Áp dụng công thức trên ta có:
CM = n/V =0,2/0,1= 2M
Ví dụ 4: Tính khối lượng chất tan có trong 600ml dung dịch CuSO4 có nồng độ mol là 1,5M
Lời giải:
Ta có V = 500 ml = 0,5 lít
Áp dụng công thức CM = n/V => nCuSO4 = V x CM = 0,5 x 1,2 =0,6 (mol)
Khối lượng Đồng sunfat CuSO4: nCuSO4 x MCuSO4 = 0,6 x 160 = 96 (g)
Ví dụ 5: Đốt cháy 6,2(g) P trong bình chứa 6,72(l) khí O2 ở đktc theo sơ đồ phản ứng sau
P + O2 → P2O5
Hỏi: Sau phản ứng chất nào còn dư và nếu dư thì với khối lượng bao nhiêu?
– Giải:
Bước 1. Tính số mol của các chất tham gia phản ứng.
nP = 6,2 : 31 = 0,2 (mol)
nO2 = 6,72 : 22,4 = 0,3 (mol)
Bước 2. Cân bằng phương trình hóa học.
4P + 5O2 → 2P2O5
4 5 2
Bước 3. Dựa vào phương trình phản ứng và tỉ lệ, tìm tỉ lệ số mol và hệ số phản ứng của 2 chất tham gia theo phương trình phản ứng.
nP : 4 = 0,2 : 4 = 0.05
nO2 : 5 = 0,3 : 5 = 0.06
Ta có tỉ lệ phản ứng: nP : 4 < nO2 : 5
=> P phản ứng hết, O2 còn dư.
=> Phương trình tính theo số mol P.
=> nO2 phản ứng = (0.2 x 5) : 4 = 0,25 (mol)
=> Số mol O2 dư = 0,3 – 0,25 = 0,05 (mol)
Hy vọng với những thông tin mà LabVIETCHEM chia sẻ ở trên, các em đã có câu trả lời cho câu hỏi mol là gì? Nồng độ mol là gì? Cách tính số mol như thế nào?. Chúc các em học hỏi được những kiến thức hữu ích nhất để học tập tốt.
XEM THÊM:
Công thức tính nồng độ phần trăm (C%), mol (CM) và bài tập áp dụng
Cách tính đương lượng và định luật đương lượng trong hóa học
Phương trình nhiệt phân KClO3 (muối Kali Clorat)
Tìm kiếm liên quan:
- công thức tính the tích hóa học 10
- công thức tính thể tích dung dịch
- công thức tính khối lượng dung dịch
- công thức tính phần trăm số mol
Từ khóa » Công Thức Tính Atm Trong Hóa Học
-
Công Thức Tính Số Mol Khí ở điều Kiện Không Chuẩn - CungHocVui
-
TỔNG HỢP CÁC CÔNG THỨC THƯỜNG... - CHINH PHỤC HÓA HỌC
-
[ Công Thức Tính Số Mol ] Qua Khối Lượng, Qua Thể Tích, Qua ...
-
Cách Tính Số Mol ở điều Kiện Nhiệt độ áp Suất - Minh Vương
-
Công Thức Tính Số Mol Theo áp Suất
-
Công Thức Tính Số Mol Theo Thể Tích - TopLoigiai
-
Công Thức Tính Mol ở điều Kiện Không Chuẩn? - VQUIX.COM
-
Công Thức Tính Nồng độ Mol, Số Mol, Nồng độ Phần Trăm Chuẩn 100%
-
(DOC) Hóa Lý (lý Thuyết + Bài Tập + Lời Giải) | Trầm Kỳ
-
Átmốtphe Tiêu Chuẩn – Wikipedia Tiếng Việt
-
Cách để Tính áp Suất Riêng Phần - WikiHow
-
[PDF] ĐỀ CƯƠNG ÔN TẬP BÀI THI HÓA HỌC ĐẠI CƯƠNG.pdf