Cách Viết Cấu Hình Electron (e) Nguyên Tử Và Bài Tập Vận Dụng
Có thể bạn quan tâm
Vậy cấu hình electron nguyên tử là gì? Cách viết cấu hình electron nguyên tử ra sao? lớp electron ngoài cùng của nguyên tử có đặc điểm gì và cấu hình electron của 20 nguyên tố đầu như thế nào? chúng ta hãy cùng tìm hiểu qua bài viết dưới đây.
I. Thứ tự các mức năng lượng trong nguyên tử
- Các electron trong nguyên tử ở trạng thái cơ bản lần lượt chiếm các mức năng lượng từ thấp đến cao.
- Từ trong ra ngoài, mức năng lượng của các lớp tăng theo thứ tự từ 1 đến 7 và năng lượng của phân lớp theo thứ tự s, p, d, f.
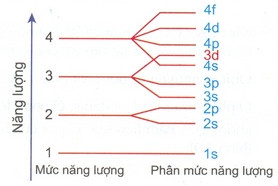 Hình 1.10 sơ đồ phân bố năng lượng ở các lớp và các phân lớp
Hình 1.10 sơ đồ phân bố năng lượng ở các lớp và các phân lớp
- Khi điện tích hạt nhân tăng, có sự chèn mức năng lượng nên mức năng lượng 4s thấp hơn 3d.
- Thứ tự sắp xếp mức năng lượng (phân mức năn lượng): 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s...
- Thứ tự các lớp electron: 1s 2s 2p 3s 3p 3d 3f 4s 4p 4d 4f...
II. Cấu hình Electron nguyên tử
1. Cấu hình Electron nguyên tử
- Cấu hình electron nguyên tử biểu diễn sự phân bố electron trên các phân lớp thuộc các lớp khác nhau.
• Quy ước cách viết cấu hình electron nguyên tử:
- Số thứ tự lớp electron được ghi bằng chữ số (1, 2, 3,...)
- Phân lớp được ghi bằng các chữ cái thường (s, p, d, f).
- Số electron trong một phân lớp được ghi bằng số ở phía trên bên phải của phân lớp (s2,p5,...)
• Cách viết cấu hình electron nguyên tử bao gồm các bước:
- Bước 1: Xác định số electron của nguyên tử.
- Bước 2: Các electron được phân bố lần lượt vào các phân lớp theo chiều tăng của năng lượng trong nguyên tử (1s 2s 2p 3s 3p 4s 3d 4p 5s...) và tuân theo quy tắc sau:
- Phân lớp s chứa tối đa 2 electron;
- Phân lớp p chứa tối đa 6 electron;
- Phân lớp d chứa tối đa 10 electron;
- Phân lớp f chứa tối đa 14 electron.
- Bước 3: Viết cấu hình electron biểu diễn sự phân bố electron trên các phân lớp thuộc các lớp khác nhau.
• Một số lưu ý khi viết cấu hình electron:
- Cần xác định đúng số e của nguyên tử hay ion (số electron(e) = số proton(p) = Z).
- Nắm vững các nguyên lí và quy tắc, kí hiệu của lớp và phân lớp.
- Quy tắc bão hòa và bán bão hòa trên d và f: Cấu hình e bền khi các e điền vào phân lớp d và f đạt bão hòa (d, f) hoặc bán bão hòa (d, f).
* Ví dụ: Viết cấu hình e nguyên tử của các nguyên tố sau:
° Nguyên tử Hidro có Z = 1, có 1e ⇒ Cấu hình electron của nguyên tử H là: 1s1
° Nguyên tử Heli có Z = 2, có 2e ⇒ Cấu hình electron của nguyên tử H là: 1s2 đã bão hòa.
° Nguyên tử Liti có Z = 3, có 3e ⇒ Cấu hình electron của nguyên tử H là: 1s22s1
° Nguyên tử Neon có Z = 10, có 10e ⇒ Cấu hình electron của nguyên tử Ne là: 1s22s22p6
° Nguyên tử Clo có Z = 17, có 17e ⇒ Cấu hình electron của nguyên tử Cl là: 1s22s22p63s23p5
- Cấu hình electron viết gọn của Clo: [Ne]3s23p5
- Electron cuối cùng của Clo điền vào phân lớp p ⇒ Clo là nguyên tố p.
- [Ne] là ký hiệu cấu hình e của nguyên tử Neon, là khí hiếm gần nhất đứng trước Clo.
° Nguyên tử sắt Fe có Z = 26, có 26e ⇒ Cấu hình electron của nguyên tử Fe là: 1s22s22p63s23p64s23d6
- Cấu hình electron viết gọn của Fe: [Ar]3d64s2
- Electron cuối cùng của Fe điền vào phân lớp d ⇒ Sắt (Fe) là nguyên tố d.
• Cách xác định nguyên tố s, p, d, f:
- Nguyên tố s: có electron cuối cùng điền vào phân lớp s
- Nguyên tố p: có electron cuối cùng điền vào phân lớp p
- Nguyên tố d: có electron cuối cùng điền vào phân lớp d
- Nguyên tố f: có electron cuối cùng điền vào phân lớp f
* Lưu ý trường hợp đặc biệt: Các nguyên tố có cấu hình nguyên tử bán bão hòa:
- Cr (Z = 24) 1s22s22p63s23p63d44s2 chuyển thành 1s22s22p63s23p63d54s1.
- Cu (Z = 29) 1s22s22p63s23p63d94s2 chuyển thành 1s22s22p63s23p63d104s1.
2. Cấu hình electron nguyên tử của 20 nguyên tố đầu
| Z | Tên nguyên tố | Ký hiệu hóa học | Số lớp electron | Cấu hình e | |||
| Lớp K (n=1) | Lớp L (n=2) | Lớp M (n=3) | Lớp N (n=4) | ||||
| 1 | Hidro | H | 1 | 1s1 | |||
| 2 | Heli | He | 2 | 1s2 | |||
| 3 | Liti | Li | 2 | 1 | 1s22s1 | ||
| 4 | Beri | Be | 2 | 2 | 1s22s2 | ||
| 5 | Bo | B | 2 | 3 | 1s22s22p1 | ||
| 6 | Cacbon | C | 2 | 4 | 1s22s22p2 | ||
| 7 | Nitơ | N | 2 | 5 | 1s22s22p3 | ||
| 8 | Oxi | O | 2 | 6 | 1s22s22p4 | ||
| 9 | Flo | F | 2 | 7 | 1s22s22p5 | ||
| 10 | Neon | Ne | 2 | 8 | 1s22s22p6 | ||
| 11 | Natri | Na | 2 | 8 | 1 | 1s22s22p63s1 | |
| 12 | Magie | Mg | 2 | 8 | 2 | 1s22s22p63s2 | |
| 13 | Nhôm | Al | 2 | 8 | 3 | 1s22s22p63s23p1 | |
| 14 | Silic | Si | 2 | 8 | 4 | 1s22s22p63s23p2 | |
| 15 | Photpho | P | 2 | 8 | 5 | 1s22s22p63s23p3 | |
| 16 | Lưu huỳnh | S | 2 | 8 | 6 | 1s22s22p63s23p4 | |
| 17 | Clo | Cl | 2 | 8 | 7 | 1s22s22p63s23p5 | |
| 18 | Agon | Ar | 2 | 8 | 8 | 1s22s22p63s23p6 | |
| 19 | Kali | Ka | 2 | 8 | 8 | 1 | 1s22s22p63s23p64s1 |
| 20 | Canxi | Ca | 2 | 8 | 8 | 2 | 1s22s22p63s23p64s2 |
3. Đặc điểm của electron lớp ngoài cùng của nguyên tử
- Đối với nguyên tử của tất cả các nguyên tố, lớp electron ngoài cùng có nhiều nhất là 8 electron.
- Các nguyên tử có 1, 2, 3 electron ở lớp ngoài cùng và nguyên tử heli không tham gia vào các phản ứng há học ( trừ 1 số điều kiện đặc biệt) ví cấu hình electron của các nguyên tử này rất bền. Đó là các nguyên tố khí hiếm chỉ có một nguyên tử.
- Các nguyên tử có 1, 2, 3 electron ở lớp ngoài cùng dễ NHƯỜNG electron là nguyên tử của các nguyên tố kim loại (trừ H, He, B).
- Các nguyên tử có 5, 6, 7 electron ở lớp ngoài cùng dễ NHẬN electron thường là nguyên tử của nguyên tố phi kim.
- Các nguyên tử có 4 electron ngoài cùng có thể là nguyên tử của nguyên tố kim loại hoặc phi kim.
⇒ Như vậy, lớp electron ngoài cùng quyết định tính chất hóa học của một nguyên tố, và khi biết cấu hình electron của nguyên tử có thể dự đoán được loại nguyên tố.
III. Bài tập về cấu hình electron nguyên tử
* Bài 1 trang 27 SGK Hóa 10: Nguyên tử có Z = 11 thuộc loại nguyên tố:
A. s. B. p. C. d. D. f.
Chọn đáp án đúng.
° Lời giải bài 1 trang 27 SGK Hóa 10:
- Đáp án đúng: A. s.
- Ta thấy, nguyên tố có Z = 11 ⇒ cấu hình e: 1s22s22p63s1 ⇒ e cuối cùng xếp vào phân lớp s nên thuộc nguyên tố s.
* Bài 2 trang 27 SGK Hóa 10: Cấu hình electron nguyên tử nào sau đây của lưu huỳnh (Z = 16):
A. 1s22s22p53s23p5
B. 1s22s22p63s23p6
C. 1s22s22p63s23p4
D. 1s22s22p63s23p3
Chọn đáp án đúng.
° Lời giải bài 2 trang 27 SGK Hóa 10:
- Đáp án đúng: C : 1s22s22p63s23p4 có Z = 16.
* Bài 3 trang 28 SGK Hóa 10: Cấu hình electron của nguyên tử nhôm (Z = 13) là 1s22s22p63s23p1. Vậy:
A. Lớp thứ nhất (Lớp K) có 2 electron.
B. Lớp thứ hai (Lớp L) có 8 electron.
C. Lớp thứ ba (Lớp M) có 3 electron.
D. Lớp ngoài cùng có 1 electron.
Tìm câu sai.
° Lời giải bài 3 trang 28 SGK Hóa 10:
- Đáp án sai: D.Lớp ngoài cùng có 1 electron;
- Lớp ngoài cùng nguyên tử nhôm là 3s23p1 có 3 electron.
* Bài 4 trang 28 SGK Hóa 10: Tổng số hạt proton, notron và electron trong nguyên tử của một nguyên tố là 13.
a) Xác định nguyên tử khối.
b) Viết cấu hình electron nguyên tử của nguyên tố đó.
(Cho biết: các nguyên tố có số hiệu nguyên từ từ 2 đến 82 trong bảng tuần hoàn thì
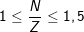 )
)
° Lời giải bài 4 trang 28 SGK Hóa 10:
a) Gọi tổng số hạt proton, tổng số hạt notron, tổng số hạt electron lần lượt là Z, N, E.
- Ta có N + Z + E = 13 vì Z = E nên 2Z + N = 13 (*)
- Mặt khác từ nguyên tố số 2 đến nguyên tố 82 trong bảng tuần hoàn thì: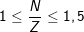
⇒ Z ≤ N ≤ 1,5Z; Từ (*) có N=13-2Z
⇒ Z ≤ 13-2Z ≤ 3,5Z
⇒ 3Z ≤ 13 ≤ 3,5Z ⇒ 3,7 ≤ Z ≤ 4,3
- Vì Z nguyên dương nên chọn Z = 4 ⇒ N = 13 – 2Z = 13 - 8 = 5. Vậy nguyên tử khối (A) của nguyên tố là: A = Z + N = 4 + 5 = 9.
b) Z = 4, có 4 electron, nên có cấu hình electron là: 1s22s2.
* Bài 5 trang 28 SGK Hóa 10: Có bao nhiêu electron ở lớp ngoài cùng trong nguyên tử của các nguyên tố có số hiệu nguyên tử lầnl ượt bằng 3, 6, 9, 18?
° Lời giải bài 5 trang 28 SGK Hóa 10:
Số electron lớp ngoài cùng trong nguyên tử của các nguyên tố có số hiệu nguyên tử bằng 3, 6, 9, 18 lần lượt là 1, 4, 7, 8. Do các nguyên tử có cấu hình electron như sau:
Z = 3: 1s22s1 ;
Z = 6 : 1s22s22p2;
Z = 9: 1s22s22p5 ;
Z = 18: 1s22s22p63s23p6.
* Bài 6 trang 28 SGK Hóa 10: Viết cấu hình electron của nguyên tử các cặp nguyên tố mà hạt nhân nguyên tử có số proton là:
a) 1, 3. b) 8, 16. c) 7, 9.
Những nguyên tố nào là kim loại? là phi kim? Vì sao?
Từ khóa » Cách Vẽ Các Lớp Electron
-
Cách Vẽ Sơ đồ Cấu Tạo Nguyên Tử. - Học Tốt Hóa Học 8-9
-
Cách Vẽ Sơ đồ Cấu Tạo Nguyên Tử Lớp 8 - Học Tốt
-
Cách Vẽ Sơ đồ Cấu Tạo Nguyên Tử Chính Xác Nhất - TopLoigiai
-
Vẽ Sơ đồ Cấu Tạo Nguyên Tử - Nguyễn Thủy Tiên - Hoc247
-
Bài Tập Tính Số Hạt Mỗi Loại , Vẽ Sơ đồ Cấu Tạo Nguyên Tử - YouTube
-
Cách Viết Cấu Hình Electron Nguyên Tử - Hóa Lớp 10 - YouTube
-
Cấu Tạo Vỏ Electron Của Nguyên Tử - Thầy Dũng Hóa
-
Vẽ Sơ đồ Cấu Tạo Nguyên Tử Có Số P Lần Lượt Là 8, 12, 16, 19 ... - Hoc24
-
Cách để Viết Cấu Hình Electron Của Nguyên Tử - WikiHow
-
Top 29 Vẽ Sơ đồ Cấu Tạo Nguyên Tử Flo 2022
-
Nguyên Tử Là Gì? Lớp Electron Là Gì? Cấu Tạo Hạt Nhân Nguyên Tử
-
Vẽ Sơ đồ Cấu Tạo Các Nguyên Tử: Cacbon (6 ), Sắt (26 ), Và Phốt Phô ...
-
Cấu Hình Electron – Wikipedia Tiếng Việt