[CHI TIẾT] Liên Kết Ion Là Gì, được Hình Thành Như Thế Nào? - Monkey
Có thể bạn quan tâm
Đăng ký nhận tư vấn về sản phẩm và lộ trình học phù hợp cho con ngay hôm nay!
*Vui lòng kiểm tra lại họ tên *Vui lòng kiểm tra lại SĐT *Vui lòng kiểm tra lại Email Học tiếng Anh cơ bản (0-6 tuổi) Nâng cao 4 kỹ năng tiếng Anh (3-11 tuổi) Học Toán theo chương trình GDPT Học Tiếng Việt theo chương trình GDPT *Bạn chưa chọn mục nào! Đăng Ký Ngay X
ĐĂNG KÝ NHẬN TƯ VẤN THÀNH CÔNG!
Monkey sẽ liên hệ ba mẹ để tư vấn trong thời gian sớm nhất! Hoàn thành X
ĐÃ CÓ LỖI XẢY RA!
Ba mẹ vui lòng thử lại nhé! Hoàn thành x
Đăng ký nhận bản tin mỗi khi nội dung bài viết này được cập nhật
*Vui lòng kiểm tra lại Email Đăng Ký- Trang chủ
- Ba mẹ cần biết
- Giáo dục
- Kiến thức cơ bản
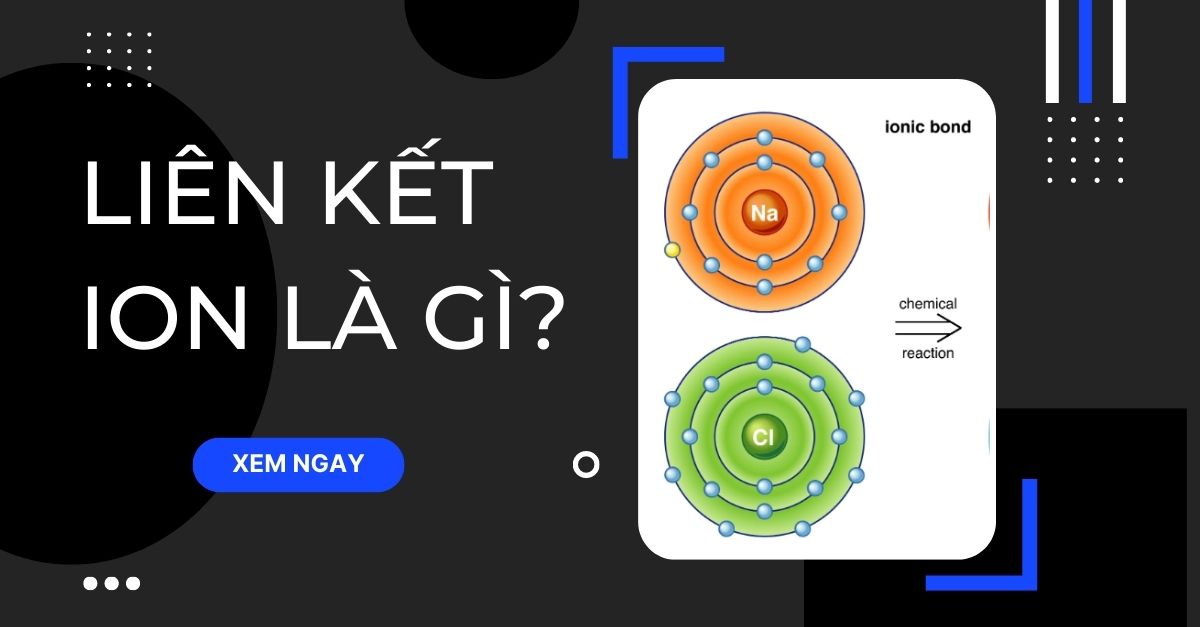 Kiến thức cơ bản Liên kết ion là gì? Cấu tạo, bản chất và bài tập chi tiết
Kiến thức cơ bản Liên kết ion là gì? Cấu tạo, bản chất và bài tập chi tiết .jpg) Đào Vân
Đào Vân 12/06/20223 phút đọc
.png) Mục lục bài viết
Mục lục bài viết Khi các phân tử thêm hoặc mất bớt electron trong quá trình phản ứng hóa học, tạo ra các phần tử mang điện được gọi là ion (liên kết tĩnh điện). Bản chất của liên kết ion là lực hút tĩnh điện giữa 2 ion mang điện tích trái dấu. Vậy liên kết ion là gì, được hình thành như thế nào? Bài viết sau đây sẽ giải đáp câu hỏi này một cách chi tiết nhất.
 Monkey Junior Lộ trình học tiếng Anh toàn diện Giá chỉ từ 799.000 VNĐ 1.359.000 VNĐ
Monkey Junior Lộ trình học tiếng Anh toàn diện Giá chỉ từ 799.000 VNĐ 1.359.000 VNĐ - Lộ trình Tiếng Anh toàn diện cho trẻ 0-11 tuổi chuẩn đầu ra Cambridge
- Áp dụng các phương pháp giáo dục được kiểm chứng trên thế giới
- Công nghệ M-Speak độc quyền chấm điểm và nhận xét phát âm chuẩn tới từng âm vị
- Kho học liệu khổng lồ với 4000+ hoạt động tương tác
- Hệ thống lớp học, giáo viên đồng hành cùng ba mẹ và bé
 Monkey Stories Kho truyện tương tác Giá chỉ từ 699.000 VNĐ 1.199.000 VNĐ
Monkey Stories Kho truyện tương tác Giá chỉ từ 699.000 VNĐ 1.199.000 VNĐ - Luyện đọc với kho 1000+ truyện tranh tương tác
- Rèn luyện kỹ năng Đọc - Hiểu thông qua trò chơi và câu hỏi tương tác
- Lộ trình học 14 cấp độ giúp dễ dàng nhận thấy sự tiến bộ của trẻ
- Công nghệ trí tuệ nhân tạo M-Speak chấm điểm và nhận xét phát âm khi bé kể chuyện
 Monkey Math Ứng dụng học Toán bằng Tiếng Anh Giá chỉ từ 499.000 VNĐ 832.000 VNĐ
Monkey Math Ứng dụng học Toán bằng Tiếng Anh Giá chỉ từ 499.000 VNĐ 832.000 VNĐ - 4 cấp độ học từ dễ đến nâng cao phù hợp với nhiều lứa tuổi & trình độ của trẻ
- Hệ thống bài học đồ sộ và bài bản giúp trẻ tự tin tiếp cận kiến thức mới
- Sách bài tập bổ trợ Monkey Math Workbook hỗ trợ đắc lực trong việc nâng cao năng lực toán học cho trẻ
- Hơn 60 chủ đề thuộc 7 chuyên đề toán học lớn giúp trẻ dễ dàng nắm bắt các khái niệm toán học
- Phát triển đồng bộ tư duy & ngôn ngữ giúp con học giỏi cả toán và tiếng Anh
 VMonkey Truyện tiếng Việt Giá chỉ từ 399.000 VNĐ 665.000 VNĐ
VMonkey Truyện tiếng Việt Giá chỉ từ 399.000 VNĐ 665.000 VNĐ - Áp dụng phương pháp học tập hiện đại qua trò chơi, hình ảnh, âm thanh
- Học vần chuẩn và nhanh nhất theo chương trình học vần theo sách giáo khoa mới
- Trẻ có thể đọc trôi chảy trước khi vào lớp 1 nhờ 700+ truyện tranh tương tác, 300+ sách nói
- Tăng khả năng Đọc - Hiểu với 1500+ câu hỏi tương tác sau truyện
- Phát triển trí tuệ cảm xúc (EQ) và nuôi dưỡng tâm hồn của trẻ nhờ 1000+ truyện cổ tích dân gian, thơ, bài học cuộc sống chọn lọc
- Hệ thống bài học đồ sộ, bài bản
- Trẻ tự tin tiếp thu kiến thức mới trên lớp
- Cấp độ học từ Dễ đến Nâng cao phù hợp với trình độ và nhận thức của trẻ

Định nghĩa ion và liên kết ion là gì?
Trong phần này, chúng ta cần nắm chắc những định nghĩa cơ bản về ion, liên kết ion và phân loại của chúng.
Định nghĩa về ion và liên kết ion
- Khái niệm Ion: Ion (điện tích) là quá trình một nhóm nguyên tử hay nguyên tử tử bị mất hoặc nhận thêm một hay nhiều electron.
- Khái niệm liên kết ion: Liên kết ion, hay liên kết điện tích, là một liên kết hóa học có bản chất là lực hút tĩnh điện giữa hai ion mang điện tích trái dấu. Liên kết ion thường là liên kết giữa các nguyên tử nguyên tố phi kim với các nguyên tử nguyên tố kim loại. Các nguyên tử kim loại có độ âm điện nhỏ, dễ mất electron tạo ra ion dương. (Theo Wikipedia)

Phân loại ion dương (cation) và ion âm (anion)
Ion được chia làm 2 loại là ion dương cation và ion âm anion. Cụ thể, trong quá trình ion hóa một nguyên tử hay nhóm nguyên tử sẽ nhận thêm hoặc mất bớt đi các electron tạo thành các cation hoặc anion.
-
Anion là các ion có điện tích âm được hình thành bởi các nguyên tử trung tính. Khi một nguyên tử trong quá trình ion hóa hút một hoặc nhiều electron vào trong nó, các ion được hình thành. Thông thường, các anion được hình thành bởi các nguyên tố phi kim, ví dụ Oxy tạo thành anion -2, Clo tạo thành anion -1,... Do các nguyên tử này có độ âm điện rất lớn, chúng hút các electron và tạo thành các anion.
-
Cation là các ion mang điện tích dương được hình thành khi các nguyên tử hoặc nhóm nguyên tử trung tính mất đi các electron. Khi bỏ các electron, số lượng proton trong hạt nhân cao hơn, do đó nguyên tử được tích điện dương. Các Cation được hình thành từ kim loại tại nhóm S trong bảng tuần hoàn hóa học. Do các Cation các các kích thước điện tích khác nhau tùy thuộc vào số lượng electron mất đi mà hình thành lên các Cation khác nhau như: Ca2+, Al3+,...
Ion đơn nguyên tử và đa nguyên tử là gì?
- Ion đơn nguyên tử là ion có duy nhất một nguyên tử, mang điện tích âm hoặc dương. Ví dụ: Mg2+. Al3+, Cl-, F-,...
- ion đa nguyên tử là ion được tạo ra bởi nhiều nguyên tử liên kết với nhau để tạo thành nhóm nguyên tử.
Ví dụ: NO3-. SO42-, NH4+,...
Liên kết ion được hình thành như thế nào?
Như chúng ta đã biết, liên kết ion là là liên kết được tạo thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
Ví dụ: Na+ + Cl- → NaCl. Liên kết giữa Na+ và Cl- là một liên kết ion.

Điều kiện hình thành
Liên kết ion chỉ được hình thành khi có 2 điều kiện sau:
-
Liên kết được hình thành bởi các nguyên tố có tính chất khác hẳn nhau (giữa kim loại và phi kim).
-
Trừ một số trường hợp điển hình, hiệu độ âm điện giữa 2 nguyên tử liên kết ion phải >= 1,7.
Dấu hiệu nhận biết
Chúng ta có thể dựa vào các dấu hiệu dưới đây để nhận biết một liên kết ion:
-
Phân tử hợp chất được hình thành từ kim loại điện hình đến phi kim điển hình. Ví dụ: NaCl, CaCl2, BaF2,... Các hợp chất này đều chứa liên kết ion- liên kết được hình thành giữa anion phi kim và anion kim loại.
-
Phân tử chứa hợp chất muối và cation hoặc anion đa nguyên tử.
Ví dụ: MgSO4, NH4Cl,... Đây đều là liên kết ion - liên kết này được hình thành giữa anion phi kim và cation kim loại và anion gốc axit.
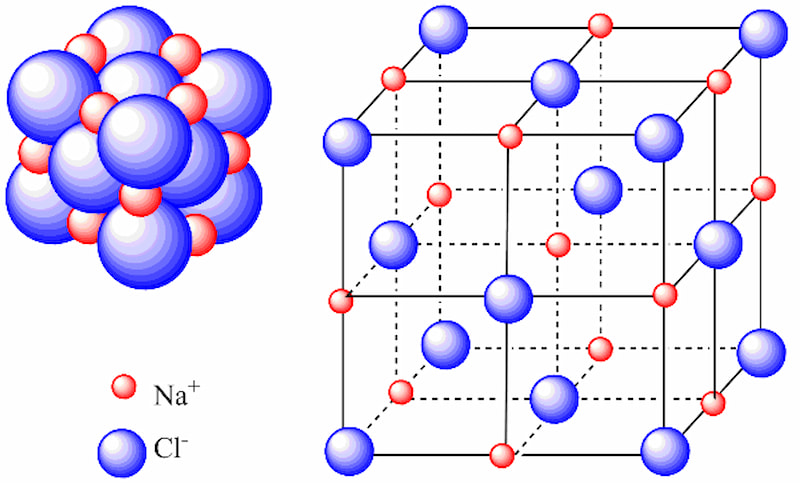
Cấu trúc mạng tinh thể của liên kết ion
Cấu trúc mạng tinh thể của liên kết ion là sự kết hợp của nhiều phân tử ion thành một liên kết khổng lồ. Và sự sắp xếp theo một cấu trúc hình học này được gọi là mạng tinh thể.
Ví dụ: NaCl không chứa một ion Na và một ion Cl, liên kết ion này là sự sắp xếp của nhiều ion Na+ và Cl- thành mạng lưới tinh thể, có tỉ lệ 1-1.
Tính chất của hợp chất có liên kết ion
Từ đặc trưng của liên kết ion có thể thấy rằng, các hợp chất có liên kết ion sẽ thường mang những tính chất phổ biến như:
-
Trạng thái: Chất rắn ion tồn tại ở nhiệt độ phòng và ở dạng tinh thể.
-
Cấu trúc: Thông thường ion được sắp xếp theo cấu trúc mạng tinh thể.
-
Tính dẫn điện: Ở tinh thể rắn, ion không dẫn điện, nhưng ở dạng dung dịch thì dẫn điện.
-
Dễ vỡ khi gặp áp lực: Khi bị đặt dưới áp lực, các hợp chất của ion dễ vỡ đồng thời liên kết bị phá vỡ dọc theo các mặt phẳng.
-
Lực hút tĩnh điện: Liên kết ion là liên kết có lực hút tĩnh điện mạnh. Do đó, hợp chất ion thường được biết đến là rất cứng, nhiệt độ nóng chảy và nhiệt độ sôi cao do liên kết ion tương đối bền vững. Ví dụ: NaCl có nhiệt độ nóng chảy là 800 độ, MgO là 2800 độ.
-
Dẫn điện: Ở trạng thái nóng chảy và khi tan trong dung dịch. Ở trạng thái rắn thường không dẫn điện.
Các bài viết không thể bỏ lỡ Monkey Math - Ứng dụng học toán tiếng Anh chỉ với 2K/Ngày Sự điện li là gì? Lý thuyết và giải bài tập chi tiết Số oxi hóa là gì? 4 quy tắc xác định số oxi hóa của 1 nguyên tố

Liên kết ion và liên kết cộng hóa trị khác nhau như thế nào?
Đều là liên kết xảy ra trong quá trình phản ứng hóa học, nhưng đâu là sự khác biệt giữa liên kết ion và liên kết cộng hóa trị?
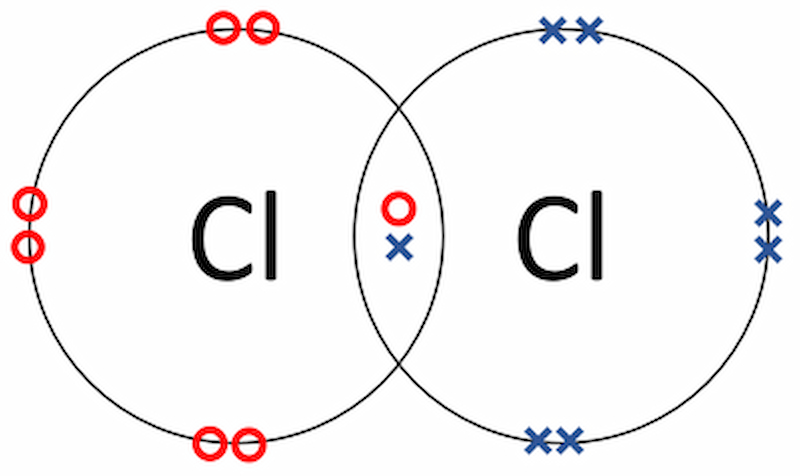
Chúng ta cùng tìm hiểu sự khác nhau này thông qua định nghĩa, bản chất liên kết và hiệu độ âm điện trong bảng so sánh sau:
| Loại liên kết | Liên kết ion | Liên kết cộng hóa trị |
| Định nghĩa | Liên kết được hình thành bởi lực hút tĩnh điện tạo liên kết giữa các ion mang điện tích trái dấu. | Liên kết được hình thành giữa 2 nguyên tử sử dụng chung 1 hoặc nhiều cặp electron. |
| Bản chất của liên kết | Bản chất của liên kết ion là sự dịch chuyển electron từ nguyên tử này sang nguyên tử khác. | Bản chất của liên kết cộng hóa trị là quá trình sử dụng một hoặc nhiều cặp electron chung. |
| Hiệu độ âm điện | Có hiệu độ âm điện >=1,7. | 0 < Hiệu độ âm điện <1,7. |
Hướng dẫn giải một số bài tập về liên kết ion SGK Hóa học 10 kèm lời giải
Cùng áp dụng những kiến thức đã học trên để thực hành một số bài tập Hóa học 10 về liên kết ion sau đây:
Bài 1 (trang 59 SGK Hóa 10):
Liên kết hóa học trong NaCl được hình thành là do:
A. Hai hạt nhân nguyên tử hút electron rất mạnh.
B. Mỗi nguyên tử Na và Cl góp chung 1 electron.
C. Mỗi nguyên tử đó nhường hoặc thu electron để trở thành các ion trái dấu hút nhau.
D. Na → Na+ e ; Cl + e → Cl- ; Na+ + Cl- → NaCl.
Chọn đáp án đúng nhất
Đáp án: D đúng
Bài 2 (trang 59 SGK Hóa 10):
Muối ăn ở thể rắn là:
A. Các phân tử NaCl
B. Các ion Na+ và Cl-
C. Các tinh thể hình lập phương: các ion Na+ và Cl- được phân bố luân phiên đều đặn trên mỗi đỉnh.
D. Các tinh thể hình lập phương: các ion Na+ và Cl- được phân bố luân phiên đều đặn thành từng phân tử riêng rẽ.
Chọn đáp án đúng nhất.
Đáp án: C đúng
Bài 3 (trang 60 SGK Hóa 10):
a) Viết cấu hình electron của cation liti (Li+) và anion oxit (O2-).
b) Những điện tích ở ion Li+ và O2- do đâu mà có?
c) Nguyên tử khí hiếm nào có cấu hình electron giống Li+ và nguyên tử khí hiếm nào có cấu hình electron giống O2-.
d) Vì sao 1 nguyên tử oxi kết hợp được với 2 nguyên tử liti?
Đáp án:
a) Cấu hình electron của cation liti (Li+) là 1s2 và anion oxit (O2-) là 1s22s22p6.
b) Điện tích ở Li+ do mất 1e mà có, điện tích ở O2- do O nhận thêm 2e mà có.
c) Nguyên tử khí hiếm He có cấu hình electron giống Li+
Nguyên tử khí hiếm Ne có cấu hình electron giống O2-
d) Vì mỗi nguyên tử liti chỉ có thể nhường 1e, mà một nguyên tử oxi thu 2e.
2Li → 2Li+ + 2e;
O + 2e → O2-;
2Li+ + O2- → Li2O.
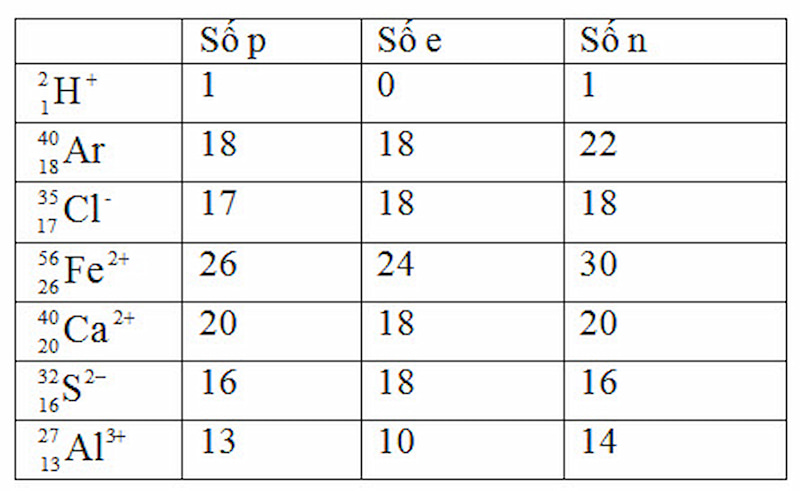
Bài 4 (trang 60 SGK Hóa 10):
Đề bài:
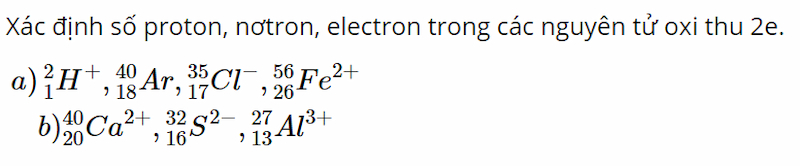
Lời giải:
| GIÚP CON HỌC TOÁN KẾT HỢP VỚI TIẾNG ANH SIÊU TIẾT KIỆM CHỈ TRÊN MỘT APP MONKEY MATH. VỚI NỘI DUNG DẠY HỌC ĐA PHƯƠNG PHÁP GIÚP BÉ PHÁT TRIỂN TƯ DUY NÃO BỘ VÀ NGÔN NGỮ TOÀN DIỆN CHỈ VỚI 2K/NGÀY.
|
Bài tập về liên kết ion để học sinh thực hành
Ngoài bài tập trong sách giáo khoa hóa học 10, dưới đây là một số bài tập liên quan mà Monkey tổng hợp để các em cùng nhau luyện tập:
I/ PHẦN TRẮC NGHIỆM
Câu 1: Liên kết ion là liên kết hóa học được hình thành bằng lực hút tĩnh điện giữa
A. Anion và electron tự do
B. Các ion mang điện tích cùng dấu
C. Hạt nhân của nguyên tử này và hạt nhân của nguyên tử kia
D. Cation và anion
Câu 2: Loại hạt nào sau đây tham gia vào quá trình liên kết hóa học?
A. Hạt electron
B. Hạt notron
C. Hạt proton
D. Hạt nhân nguyên tử
Câu 3: Liên kết ion được tạo thành giữa
A. hai nguyên tử kim loại.
B. hai nguyên tử phi kim.
C. một nguyên tử kim loại mạnh và một nguyên tử phi kim mạnh.
D. một nguyên tử kim loại yếu và một nguyên tử phi kim yếu.
Câu 4: Dãy chất nào sau đây mà phân tử chỉ chứa liên kết ion?
A. KCl; MgO; BaCl2
B. BaCl2; MgO; H2O
C. NaBr; Na2O; KNO3
D. SO2; H2SO4; HClO4
Câu 5: Trong tinh thể NaCl, nguyên tố Na và Cl ở dạng ion và có sô electron lần lượt là
A. 10 và 18
B. 12 và 16
C. 10 và 10
D. 11 và 17
Câu 6: Mạng tinh thể ion có đặc tính nào dưới đây?
A. Bền vững, nhiệt độ nóng chảy cao và nhiệt độ sôi thấp
B. Bền vững, nhiệt độ nóng chảy và nhiệt độ sôi khá cao
C. Bền vững, nhiệt độ nóng và nhiệt độ sôi thấp
D. Dễ bay hơi
Câu 7: Phân tử nào sau đây có liên kết phân cực nhất?
A. F2O
B. Cl2O
C. ClF
D. O2
Câu 8: Phát biểu nào sau đây là không đúng?
A. Liên kết ion là liên kết được tạo thành do sự nhận electron
B. Liên kết ion là liên kết giữa 2 nguyên tử có hiệu độ âm điện lớn hơn 1
C. Liên kết ion là liên kết được hình thành do sự góp chung electron.
D. Liên kết ion được hình thành nhờ lực hút tĩnh điện giữa ion mang điện tích trái dấu
Câu 9: Liên kết trong phân tử chất nào sau đây mang nhiều tính chất của liên kết ion nhất?
A. LiCl
B. NaCl
C. KCl
D. CsCl
Câu 10: Năng lượng ion hóa của nguyên tử là:
A. Năng lượng giải phóng bởi nguyên tử khi tạo liên kết ion
B. Năng lượng giải phóng khi nguyên tử nhận thêm electron
C. Năng lượng cần để tách electron ra khỏi nguyên tử ở trạng thái cơ bản
D. Năng lượng cần để cung cấp để nguyên tử nhận thêm electron
II/ PHẦN TỰ LUẬN
Câu 1. Hãy viết công thức electron và công thức cấu tạo của các phân tử sau: PH3, SO2
Câu 2. Viết công thức electron, công thức cấu tạo của HClO, HCN, HNO2.
Câu 3. Viết công thức cấu tạo của các phân tử và ion sau: H2SO3, Na2SO4, HClO4, CuSO4, NaNO3, CH3COOH, NH4NO3, H4P2O7.
Câu 4. Viết công thức electron, công thức cấu tạo của các phân tử:NH3, C2H2, C2H4, CH4, Cl2, HCl, H2O.
Câu 5. Viết công thức cấu tạo của các phân tử và ion sau: NH4+, Fe3O4, KMnO4, Cl2O7
Câu 6. Viết công thức electron và công thức cấu tạo các chất sau:HNO3, Al(OH)3, K2Cr2O7, N2O5, Al2S3, H2CrO4, PCl5
Câu 7: Xác định số oxi hóa của các nguyên tố trong hợp chất , đơn chất và ion sau:
a) H2S, S, H2SO3, H2SO4.
b) HCl, HClO, NaClO2, HClO3.
c) Mn, MnCl2, MnO2, KMnO4.
Cho các phân tử sau : C2H2 (1) ; BF3 (2) ; BeCl2 (3) ; C2H4 (4) ; CH4 (5) ; Cl2 (6) ; H2 (7) ; H2O (8) ; NH3 (9) ; HCl (10). Trong các phân tử trên, sự hình thành liên kết trong các phân tử nhờ :
a. Sự lai hoá sp các AO hoá trị là :
A. (1), (3), (6).
B. (1), (2), (3), (5).
C. (1), (3), (4), (7).
D. (1), (3).
b. Sự lai hoá sp2 các AO hoá trị là :
A. (2), (4).
B. (2), (6).
C. (2), (3), (4).
D. A, B, C.
b. Sự lai hoá sp3 các AO hoá trị là :
A. (5), (6), (8), (10).
B. (5), (8), (9).
C. (3), (5), (8), (9).
D. (5), (6), (8), (9).
Câu 8: Cho độ âm điện Cs : 0,79 ; Ba : 0,89 ; H : 2,2 ; Cl : 3,16 ; S : 2,58 ; N : 3,04 ; O : 3,44 để xét sự phân cực của liên kết trong phân tử các chất sau: NH3 , H2S, H2O, CsCl . Chất nào trong các chất trên có liên kết ion ?
Câu 9: X, A, Z là những nguyên tố có số điện tích hạt nhân là 9, 19, 8.
a) Viết cấu hình electron nguyên tử của các nguyên tố đó.
b) Dự đoán liên kết hóa học có thể có giữa các cặp X và A, A và Z, Z và X.
Câu 10: Cho độ âm điện: Be (1,5), Al (1,5), Mg (1,2), Cl (3,0), N (3,0), H (2,1), S (2,5), O (3,5). Chất nào sau đây có liên kết ion ?
| Với việc sở hữu Kho trò chơi và video, giọng đọc, hình ảnh minh họa sinh động, hấp dẫn. Luôn đổi mới, cập nhật thường xuyên - tăng hứng thú học cho trẻ khi học tiếng Anh cùng Monkey Junior chỉ với 2K/ngày.
|
Bài viết trên đây đã cung cấp những lý thuyết chi tiết nhất về liên kết ion cùng bài tập thực hành trong SGK Hóa học 10. Hy vọng bạn có thêm nhiều kiến thức bổ ích xung quanh ion, liên kết ion và quá trình tiếp thu bài học hiệu quả. Truy cập website của Monkey mỗi ngày để có thêm nhiều thông tin thú vị về môn Hóa học nhé!
Tài liệu tham khảoIonic bond - Ngày truy cập: 13/06/2022
https://www.britannica.com/science/ionic-bond
Ionic and Covalent Bonds - Ngày truy cập: 13/06/2022
https://chem.libretexts.org/Bookshelves/Organic_Chemistry/Supplemental_Modules_(Organic_Chemistry)/Fundamentals/Ionic_and_Covalent_Bonds
Chia sẻ ngaySao chép liên kết
.jpg) Đào Vân
Đào Vân Tôi là Đào Vân, biên tập viên có hơn 4 năm kinh nghiệm viết bài nhiều lĩnh vực như giáo dục, sức khỏe, công nghệ...
Bài viết liên quan- Hàm số tuần hoàn là gì? Cách tính chu kỳ của hàm số lượng giác cực chuẩn
- Ý nghĩa công suất điện và cách tính công suất điện tiêu thụ chi tiết nhất
- 1 hecta bằng bao nhiêu mẫu? Cách quy đổi héc ta nhanh chóng
- Công thức tính chu vi hình tứ giác đầy đủ chính xác nhất
- Cách tính đường kính hình tròn đơn giản chỉ với 3 công thức
 Giúp bé giỏi Tiếng Anh Sớm Đăng ký ngay tại đây *Vui lòng kiểm tra lại họ tên *Vui lòng kiểm tra lại SĐT *Vui lòng kiểm tra lại Email Đăng ký ngay Nhận các nội dung mới nhất, hữu ích và miễn phí về kiến thức Giáo dục trong email của bạn *Vui lòng kiểm tra lại Email Đăng Ký Các Bài Viết Mới Nhất
Giúp bé giỏi Tiếng Anh Sớm Đăng ký ngay tại đây *Vui lòng kiểm tra lại họ tên *Vui lòng kiểm tra lại SĐT *Vui lòng kiểm tra lại Email Đăng ký ngay Nhận các nội dung mới nhất, hữu ích và miễn phí về kiến thức Giáo dục trong email của bạn *Vui lòng kiểm tra lại Email Đăng Ký Các Bài Viết Mới Nhất .jpg) Lì xì tết - Truyền thống và cách dạy trẻ về quản lý tiền tết
Lì xì tết - Truyền thống và cách dạy trẻ về quản lý tiền tết  Danh sách các trò chơi dân gian Việt Nam trong ngày Tết & lưu ý khi tổ chức
Danh sách các trò chơi dân gian Việt Nam trong ngày Tết & lưu ý khi tổ chức  Trang trí Tết 2025: Cùng bé sáng tạo - Đón xuân rộn ràng
Trang trí Tết 2025: Cùng bé sáng tạo - Đón xuân rộn ràng  Phương pháp giúp nuôi dạy trẻ 2 tuổi tự lập như người Nhật mà ba mẹ nào cũng nên biết
Phương pháp giúp nuôi dạy trẻ 2 tuổi tự lập như người Nhật mà ba mẹ nào cũng nên biết  Cẩm nang dạy tiếng Anh cho trẻ sơ sinh hiệu quả ngay tại nhà
Cẩm nang dạy tiếng Anh cho trẻ sơ sinh hiệu quả ngay tại nhà .jpg) Lì xì tết - Truyền thống và cách dạy trẻ về quản lý tiền tết
Lì xì tết - Truyền thống và cách dạy trẻ về quản lý tiền tết  Danh sách các trò chơi dân gian Việt Nam trong ngày Tết & lưu ý khi tổ chức
Danh sách các trò chơi dân gian Việt Nam trong ngày Tết & lưu ý khi tổ chức  Trang trí Tết 2025: Cùng bé sáng tạo - Đón xuân rộn ràng
Trang trí Tết 2025: Cùng bé sáng tạo - Đón xuân rộn ràng  Phương pháp giúp nuôi dạy trẻ 2 tuổi tự lập như người Nhật mà ba mẹ nào cũng nên biết
Phương pháp giúp nuôi dạy trẻ 2 tuổi tự lập như người Nhật mà ba mẹ nào cũng nên biết  Cẩm nang dạy tiếng Anh cho trẻ sơ sinh hiệu quả ngay tại nhà
Cẩm nang dạy tiếng Anh cho trẻ sơ sinh hiệu quả ngay tại nhà 


Đăng ký tư vấn nhận ưu đãi
Monkey Junior
Mới! *Vui lòng kiểm tra lại họ tên *Vui lòng kiểm tra lại SĐT Bạn là phụ huynh hay học sinh ? Học sinh Phụ huynh *Bạn chưa chọn mục nào! Đăng Ký Mua Monkey JuniorTừ khóa » Hóa Học 10 Liên Kết Ion
-
Hoá Học 10 Bài 12: Liên Kết Ion - Tinh Thể Ion
-
Lý Thuyết Hóa 10: Bài 12. Liên Kết Ion - Tinh Thể Ion - TopLoigiai
-
Giải Hóa 10 Bài 12: Liên Kết Ion - Tinh Thể Ion
-
Bài 12. Liên Kết Ion - Tinh Thể Ion
-
Giải Bài 12 Hóa Học 10: Liên Kết Ion Tinh Thể Ion - Tech12h
-
Giải Hóa 10 Bài 12: Liên Kết Ion - Tinh Thể Ion
-
Hóa Học Lớp 10 - Bài 12 - Liên Kết Ion - Tinh Thể Ion - Tiết 1 - YouTube
-
Liên Kết Ion - Bài 12 - Cô Phạm Thu Huyền (DỄ HIỂU NHẤT)
-
Tổng Hợp Lý Thuyết Liên Kết Ion - Hóa Học 10 - CungHocVui
-
Soạn Hoá Học 10 Bài 12: Liên Kết Ion Tinh Thể Ion
-
Giải Bài Tập Hóa 10 Bài 12: Liên Kết Ion - Tinh Thể Ion
-
Hoá Học 10 Bài 12: Liên Kết Ion - Tinh Thể Ion - MarvelVietnam
-
Giải Bài Tập SGK Bài 12: Liên Kết Ion - Tinh Thể Ion - HocTapHay
-
Lý Thuyết Liên Kết Ion – Tinh Thể Ion Trang 56 - 58 SGK Hóa Học Lớp 10