Lý Thuyết Hóa 10: Bài 12. Liên Kết Ion - Tinh Thể Ion - TopLoigiai
Có thể bạn quan tâm
Tóm tắt Lý thuyết Hóa học 10 Kết nối tri thức Bài 12: Liên kết cộng hóa trị theo chương trình Sách mới ngắn gọn nhất. Tổng hợp lý thuyết Hóa học 10 trọn bộ chi tiết, đầy đủ.
Bài 12: Liên kết cộng hóa trị
Mục lục nội dung I. Sự tạo thành liên kết cộng hóa trị1. Sự tạo thành phân tử có liên kết đơn2. Sự tạo thành phân tử có liên kết đôi3. Sự tạo thành phân tử có liên kết baII. Độ âm điện và liên kết hóa họcIII. Mô tả liên kết cộng hóa trị bằng sự xen phủ các orbital nguyên tử1. Sự xen phủ các orbital nguyên tử tạo liên kết 𝛔 (sigma)2. Sự xen phủ các orbital nguyên tử tạo liên kết p (pi)IV. Năng lượng liên kết cộng hóa trịI. Sự tạo thành liên kết cộng hóa trị
- Liên kết cộng hóa trị là liên kết được hình thành giữa hai nguyên tử bằng một hay nhiều cặp electron chung.
- Cặp electron chung giữa hai nguyên tử có thể được tạo thành theo hai kiểu khác nhau:
+ Mỗi nguyên tử góp một hay nhiều electron để tạo thành các cặp electron dùng chung.
+ Cặp electron dùng chung chỉ do một nguyên tử đóng góp, liên kết giữa hai nguyên tử là liên kết cộng hóa trị kiểu cho – nhận.
1. Sự tạo thành phân tử có liên kết đơn
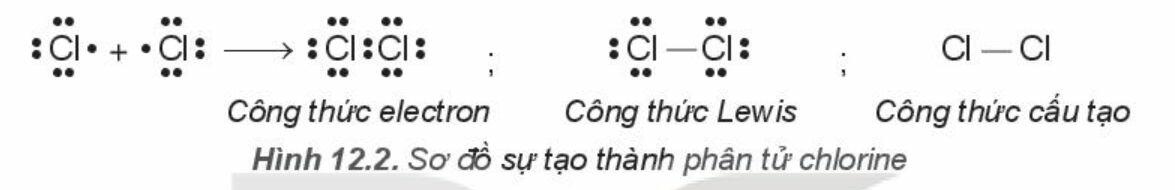
a) Sự tạo thành phân tử chlorine
- Phân tử chlorine (Cl2):
Mỗi nguyên tử chlorine có 7 electron hóa trị, 2 nguyên tử chlorine liên kết với nhau bằng cách mỗi nguyên tử chlorine góp 1 electron
=> 1 cặp electron dùng chung
- Thay 1 cặp electron dùng chung bằng 1 gạch nối => Liên kết đơn
- Phân tử hydrogen chloride (HCl):
Nguyên tử hydrogen liên kết với nguyên tử chlorine bằng cách mỗi nguyên tử góp 1 electron tạo thành 1 cặp electron dùng chung trong phân tử HCl
=> Giữa 2 nguyên tử H và Cl có 1 cặp electron dùng chung => Liên kết đơn

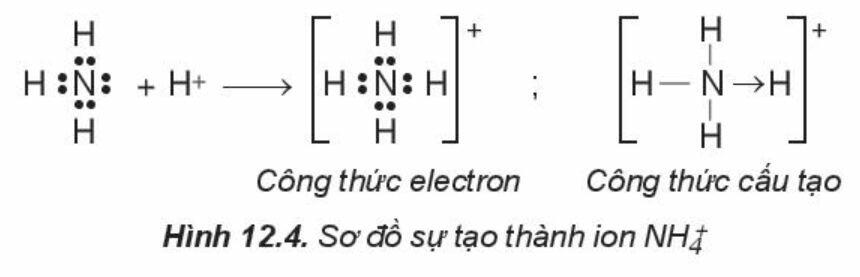
- Phân tử hợp chất có liên kết cho – nhận:
Phân tử NH3, lớp ngoài cùng của nguyên tử N có 5 electron, trong đó có cặp electron chưa liên kết
=> Ion H+ có orbital trống, không có electron
=> Khi phân tử NH3 kết hợp với H+, nguyên tử N đóng góp cặp electron chưa liên kết để tạo liên kết với H+ tạo thành NH4+
=> Liên kết cho – nhận được hình thành
=> Nguyên tử N là nguyên tử cho, ion H+ là nguyên tử nhận
2. Sự tạo thành phân tử có liên kết đôi
- Phân tử oxygen (O2):
+ Mỗi nguyên tử oxygen có 6 electron hóa trị, hai nguyên tử oxygen liên kết với nhau bằng cách mỗi nguyên tử đóng góp 2 electron, tạo thành hai cặp electron dùng chung. Trong phân tử O2, mỗi nguyên tử oxygen đều có 8 electron ở lớp ngoài cùng, thỏa mãn quy tắc octet.

+ Giữa hai nguyên tử oxygen có hai cặp electron dùng chung (biểu diễn bằng hai gạch nối), đó là liên kết đôi.
- Phân tử carbon dioxide (CO2):
Nguyên tử carbon có 4 electron hóa trị, nguyên tử oxygen có 6 electron hóa trị. Hai nguyên tử oxygen liên kết với một nguyên tử carbon bằng cách mỗi nguyên tử oxygen đóng góp 2 electron và nguyên tử carbon đóng góp 4 electron tạo thành 4 cặp electron dùng chung. Khi đó, trong phân tử CO2, mỗi nguyên tử đều có 8 electron ở lớp ngoài cùng, thỏa mãn quy tắc octet.
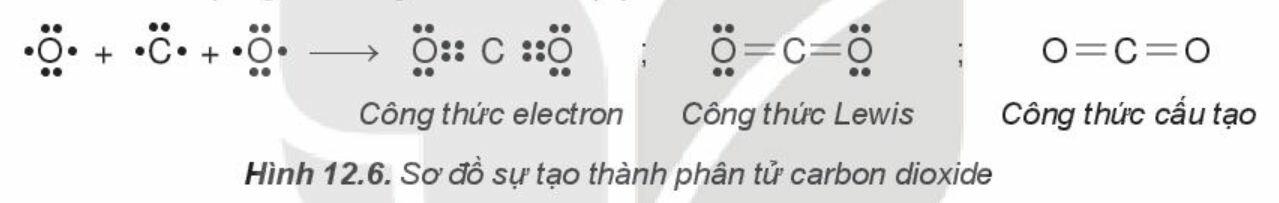
Phân tử CO2 có hai liên kết đôi.
3. Sự tạo thành phân tử có liên kết ba
Phân tử nitrogen (N2):
Nguyên tử nitrogen có 5 electron hóa trị, 2 nguyên tử nitrogen liên kết với nhau bằng cách mỗi nguyên tử nitrogen đóng góp 3 electron, tạo thành 3 cặp electron dùng chung

=> Giữa 2 nguyên tử nitrogen có 3 cặp electron dùng chung => Liên kết ba
Kết luận: Liên kết cộng hóa trị là liên kết được tạo thành giữa hai nguyên tử bằng một hay nhiều cặp electron dùng chung.
Chú ý:
+ Liên kết trong các phân tử Cl2; O2; N2 … có cặp electron dùng chung không bị hút lệch về phía nguyên tử nào được gọi là liên kết cộng hóa trị không phân cực.
+ Liên kết trong phân tử HCl có cặp electron dùng chung lệch về phía nguyên tử có độ âm điện lớn hơn (Cl) được gọi là liên kết cộng hóa trị phân cực.
II. Độ âm điện và liên kết hóa học
- Độ âm điện đặc trưng cho khả năng hút electron của nguyên tử khi hình thành liên kết hóa học.
- Dựa vào sự khác nhau về độ âm điện giữa các nguyên tử tham gia liên kết, có thể dự đoán được loại liên kết giữa hai nguyên tử đó.

Ví dụ:
- Trong phân tử HCl, hiệu độ âm điện của Cl và H: 3,16 – 2,20 = 0.96
=> Liên kết cộng hóa trị phân cực
- Trong phân tử NaCl, hiệu độ âm điện của Cl và Na: 3,16 – 0,93 = 2,23
=> Liên kết ion
Chú ý:
Liên kết cộng hóa trị phân cực có thể được coi là dạng trung gian giữa liên kết công hóa trị không phân cực và liên kết ion.
III. Mô tả liên kết cộng hóa trị bằng sự xen phủ các orbital nguyên tử
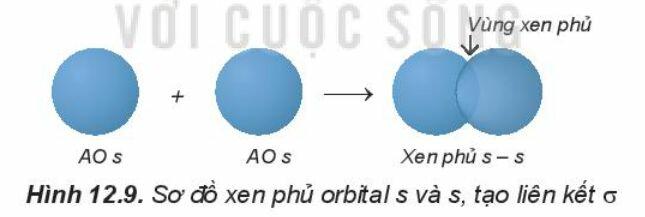
1. Sự xen phủ các orbital nguyên tử tạo liên kết 𝛔 (sigma)
Liên kết được tạo nên từ xen phủ trục của hai AO gọi là liên kết sigma (s).
- Sự xen phủ s – s
- Sự xen phủ s – p
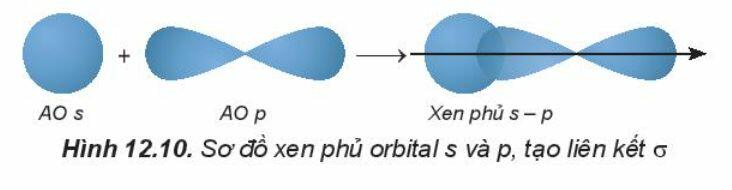
- Sự xen phủ p – p
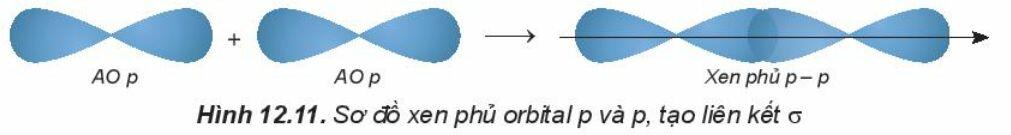
Chú ý:
+ Các liên kết cộng hóa trị đơn đều là liên kết sigma.
+ Trong liên kết sigma, mật độ xác suất tìm thấy electron lớn nhất dọc theo trục liên kết.
2. Sự xen phủ các orbital nguyên tử tạo liên kết p (pi)
Sự xen phủ, trong đó trục của các orbital tham gia liên kết song song với nhau và vuông góc với đường nối tâm của hai nguyên tử liên kết, được gọi là xen phủ bên. Sự xen phủ bên tạo ra liên kết p (pi).
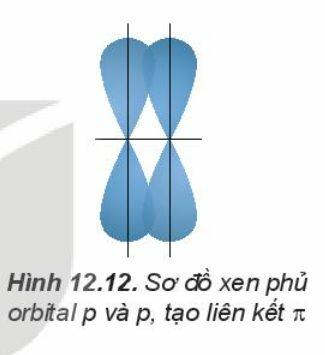
Liên kết đôi gồm một liên kết s và một liên kết p. Liên kết ba gồm một liên kết s và hai liên kết p.
IV. Năng lượng liên kết cộng hóa trị
- Khái niệm: Năng lượng liên kết (Eb) là năng lượng cần thiết để phá vỡ một liên kết hóa học trong phân tử ở thể khí thành các nguyên tử ở thể khí
- Đơn vị: kJ/mol
Ví dụ: Để phá vỡ 1 mol liên kết H-Cl thành các nguyên tử H và Cl (ở thể khí) theo phương trình
HCl(g) → H(g) + Cl(g)
Cần năng lượng là 432 kJ, nên năng lượng liên kết H-Cl là Eb = 432 kJ/mol
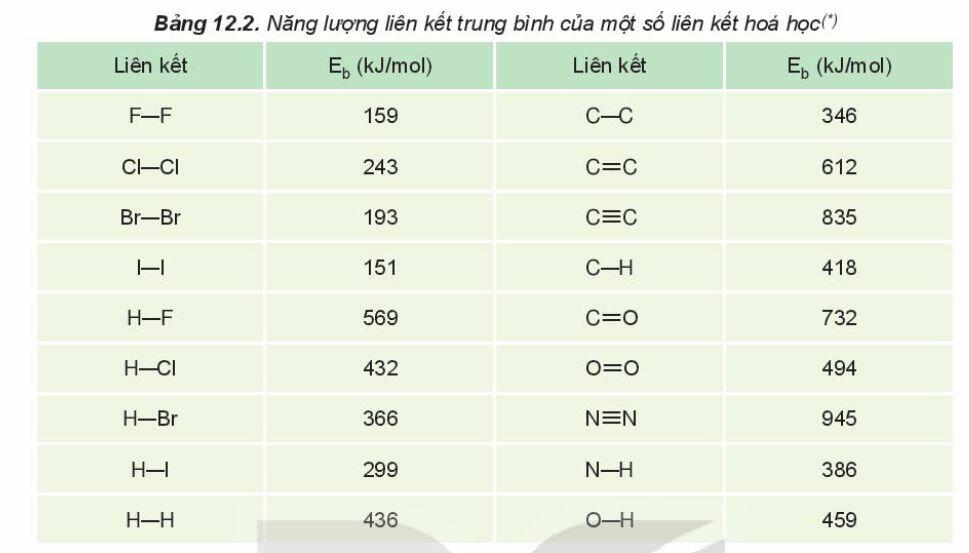
=> Năng lượng liên kết càng lớn thì liên kết càng bền và phân tử càng khó bị phân hủy (đặc trưng cho độ bền của liên kết)
>>> Xem toàn bộ:
- Lý thuyết Hóa 10 Kết nối tri thức
- Soạn Hóa 10 Kết nối tri thức
- Sơ đồ tư duy Hóa 10 Kết nối tri thức
- Trắc nghiệm Hóa 10 Kết nối tri thức
-------------------------------------------
Trên đây Toploigiai đã cùng các bạn Tóm tắt Lý thuyết Hóa học 10 Kết nối tri thức Bài 12: Liên kết cộng hóa trị theo chương trình Sách mới ngắn gọn nhất. Mời các bạn hãy click ngay vào trang chủ Toploigiai để tham khảo và chuẩn bị bài cho năm học mới Lớp 10 nhé. Chúc các bạn học tốt.
Từ khóa » Hóa Học 10 Liên Kết Ion
-
Hoá Học 10 Bài 12: Liên Kết Ion - Tinh Thể Ion
-
Giải Hóa 10 Bài 12: Liên Kết Ion - Tinh Thể Ion
-
Bài 12. Liên Kết Ion - Tinh Thể Ion
-
Giải Bài 12 Hóa Học 10: Liên Kết Ion Tinh Thể Ion - Tech12h
-
Giải Hóa 10 Bài 12: Liên Kết Ion - Tinh Thể Ion
-
Hóa Học Lớp 10 - Bài 12 - Liên Kết Ion - Tinh Thể Ion - Tiết 1 - YouTube
-
Liên Kết Ion - Bài 12 - Cô Phạm Thu Huyền (DỄ HIỂU NHẤT)
-
Tổng Hợp Lý Thuyết Liên Kết Ion - Hóa Học 10 - CungHocVui
-
Soạn Hoá Học 10 Bài 12: Liên Kết Ion Tinh Thể Ion
-
Giải Bài Tập Hóa 10 Bài 12: Liên Kết Ion - Tinh Thể Ion
-
Hoá Học 10 Bài 12: Liên Kết Ion - Tinh Thể Ion - MarvelVietnam
-
[CHI TIẾT] Liên Kết Ion Là Gì, được Hình Thành Như Thế Nào? - Monkey
-
Giải Bài Tập SGK Bài 12: Liên Kết Ion - Tinh Thể Ion - HocTapHay
-
Lý Thuyết Liên Kết Ion – Tinh Thể Ion Trang 56 - 58 SGK Hóa Học Lớp 10