Cho 10,2 (g) Al2O3 Tác Dụng Vừa đủ Với 200g Dung Dịch HCl.a) Viết ...
Có thể bạn quan tâm
HOC24
Lớp học Học bài Hỏi bài Giải bài tập Đề thi ĐGNL Tin tức Cuộc thi vui Khen thưởng- Tìm kiếm câu trả lời Tìm kiếm câu trả lời cho câu hỏi của bạn
Lớp học
- Lớp 12
- Lớp 11
- Lớp 10
- Lớp 9
- Lớp 8
- Lớp 7
- Lớp 6
- Lớp 5
- Lớp 4
- Lớp 3
- Lớp 2
- Lớp 1
Môn học
- Toán
- Vật lý
- Hóa học
- Sinh học
- Ngữ văn
- Tiếng anh
- Lịch sử
- Địa lý
- Tin học
- Công nghệ
- Giáo dục công dân
- Tiếng anh thí điểm
- Đạo đức
- Tự nhiên và xã hội
- Khoa học
- Lịch sử và Địa lý
- Tiếng việt
- Khoa học tự nhiên
- Hoạt động trải nghiệm
- Hoạt động trải nghiệm, hướng nghiệp
- Giáo dục kinh tế và pháp luật
Chủ đề / Chương
Bài học
HOC24
 Khách vãng lai Đăng nhập Đăng ký Khám phá Hỏi đáp Đề thi Tin tức Cuộc thi vui Khen thưởng
Khách vãng lai Đăng nhập Đăng ký Khám phá Hỏi đáp Đề thi Tin tức Cuộc thi vui Khen thưởng - Tất cả
- Toán
- Vật lý
- Hóa học
- Sinh học
- Ngữ văn
- Tiếng anh
- Lịch sử
- Địa lý
- Tin học
- Công nghệ
- Giáo dục công dân
- Tiếng anh thí điểm
- Hoạt động trải nghiệm, hướng nghiệp
- Giáo dục kinh tế và pháp luật
Câu hỏi
Hủy Xác nhận phù hợp Chọn lớp Tất cả Lớp 12 Lớp 11 Lớp 10 Lớp 9 Lớp 8 Lớp 7 Lớp 6 Lớp 5 Lớp 4 Lớp 3 Lớp 2 Lớp 1 Môn học Toán Vật lý Hóa học Sinh học Ngữ văn Tiếng anh Lịch sử Địa lý Tin học Công nghệ Giáo dục công dân Tiếng anh thí điểm Đạo đức Tự nhiên và xã hội Khoa học Lịch sử và Địa lý Tiếng việt Khoa học tự nhiên Hoạt động trải nghiệm Hoạt động trải nghiệm, hướng nghiệp Giáo dục kinh tế và pháp luật Mới nhất Mới nhất Chưa trả lời Câu hỏi hay
- Lê Hồng Quang
Cho 10,2 (g) Al2O3 tác dụng vừa đủ với 200g dung dịch HCl.
a) Viết phương trình
b) Tính nồng độ phần trăm HCl đã dùng.
c)Tính nồng độ phần trăm dung dịch sau phản ứng.
Giúp mình câu c thôi nha. Cho mình cảm ơn bạn nào đã giúp mình câu c.
Xem chi tiết Lớp 9 Hóa học Chương I. Các loại hợp chất vô cơ 0 1 Gửi Hủy
Gửi Hủy 
- Đặng -Phúc- Thịnh-9A1
Cho 13 gam Kẽm Zn tác dụng vừa đủ với 100 gam dung dịch HCl.a) Viết phương trình hóa học của phản ứng.b) Tính nồng độ phần trăm dung dịch HCl đã dùng.c) Tính nồng độ phần trăm dung dịch muối tạo thành.
Xem chi tiết Lớp 9 Hóa học 2 0 Gửi Hủy
Gửi Hủy  Nguyễn Hoàng Minh
Nguyễn Hoàng Minh  3 tháng 12 2021 lúc 14:36
3 tháng 12 2021 lúc 14:36 \(n_{Zn}=\dfrac{13}{65}=0,2(mol)\\ a,PTHH:Zn+2HCl\to ZnCl_2+H_2\\ b,n_{HCl}=0,4(mol)\\ \Rightarrow C\%_{HCl}=\dfrac{0,4.36,5}{100}.100\%=14,6\%\\ c,n_{ZnCl_2}=n_{H_2}=0,2(mol)\\ \Rightarrow m_{ZnCl_2}=0,2.136=27,2(g)\\ \Rightarrow C\%_{ZnCl_2}=\dfrac{27,2}{13+100-0,2.2}.100\%\approx 24,16\%\)
Đúng 1 Bình luận (0) Gửi Hủy
Gửi Hủy  Luminos
Luminos  6 tháng 12 2021 lúc 9:18
6 tháng 12 2021 lúc 9:18 Ủa thịnh THCS HTA đúng kh? Này đề thi giữa kì hóa mà thịnh đi hỏi hả ;) tui méc thầy nha
Đúng 0 Bình luận (0) Gửi Hủy
Gửi Hủy 
- nhân
cho 2,4gam Mg phản ứng vừa đủ với 400gam dung dịch hcl.
a) viết pthh xảy ra
b) tính nồng độ phần trăm của dung dịch hcl đã dùng
c) tính nồng độ phần trăm của muối trong dung dịch sau phản ứng
Xem chi tiết Lớp 9 Hóa học 2 0 Gửi Hủy
Gửi Hủy  HaNa
HaNa  4 tháng 10 2023 lúc 17:08
4 tháng 10 2023 lúc 17:08 Chúc cậu học tốt nhee
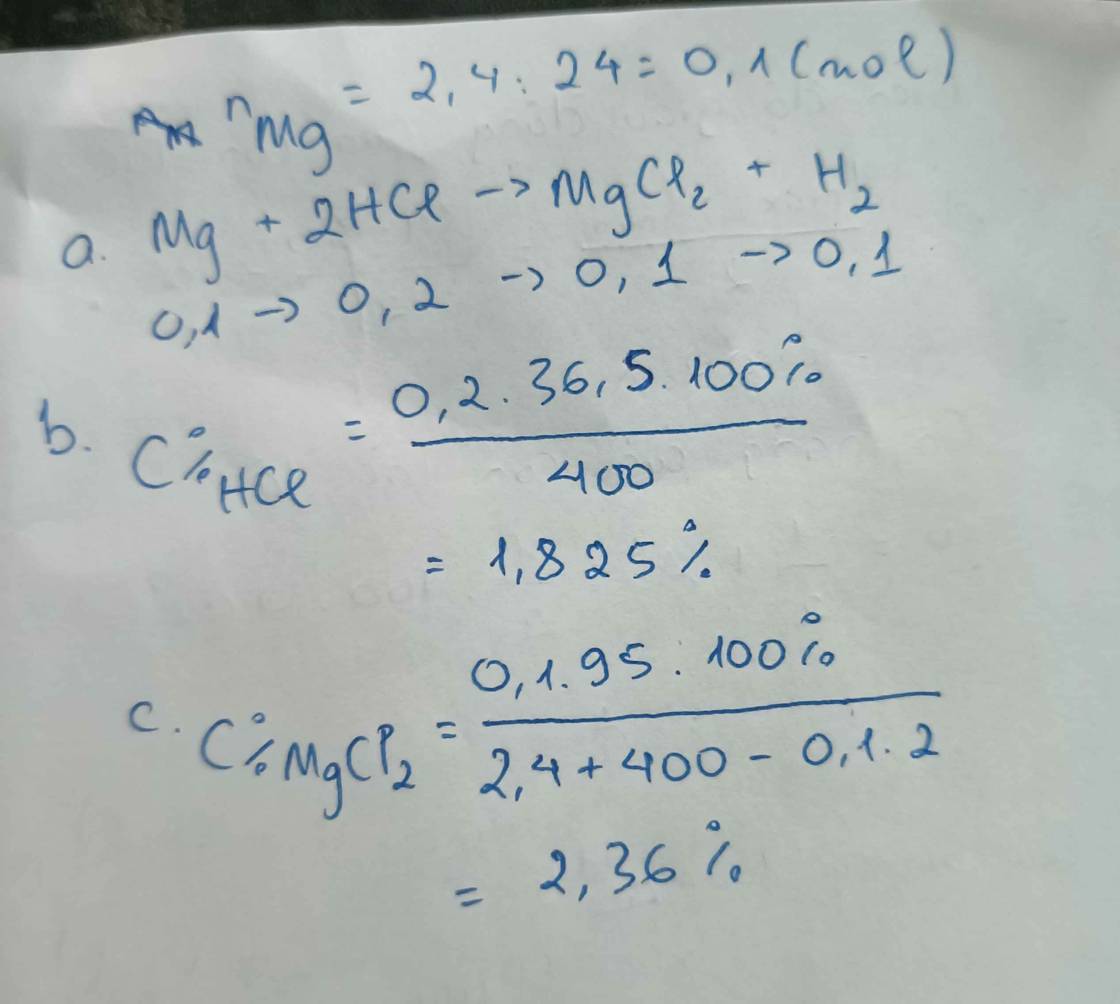
 Gửi Hủy
Gửi Hủy  Lê Ng Hải Anh
Lê Ng Hải Anh  4 tháng 10 2023 lúc 17:10
4 tháng 10 2023 lúc 17:10 a, \(Mg+2HCl\rightarrow MgCl_2+H_2\)
b, Ta có: \(n_{Mg}=\dfrac{2,4}{24}=0,1\left(mol\right)\)
Theo PT: \(n_{HCl}=2n_{Mg}=0,2\left(mol\right)\Rightarrow C\%_{HCl}=\dfrac{0,2.36,5}{400}.100\%=1,825\%\)
c, Theo PT: \(n_{MgCl_2}=n_{H_2}=n_{Mg}=0,1\left(mol\right)\)
Ta có: m dd sau pư = 2,4 + 400 - 0,1.2 = 402,2 (g)
\(\Rightarrow C\%_{MgCl_2}=\dfrac{0,1.95}{402,2}.100\%\approx2,36\%\)
Đúng 1 Bình luận (0) Gửi Hủy
Gửi Hủy 
- dhdw
Cho 200g dd HCl tác dụng vừa đủ với 21.2 gam Na2CO3
a. Tính thể tích khí sinh ra (đkc)
b. Tính nồng độ phần trăm của dd HCl đã dùng
c. Tính nồng độ phần trăm của dd sau phản ứng
Giải hộ mình câu c
Xem chi tiết Lớp 9 Hóa học 2 0
 Gửi Hủy
Gửi Hủy  ๖ۣۜDũ๖ۣۜN๖ۣۜG
๖ۣۜDũ๖ۣۜN๖ۣۜG  19 tháng 1 2022 lúc 16:55
19 tháng 1 2022 lúc 16:55 a) \(n_{Na_2CO_3}=\dfrac{21,2}{106}=0,2\left(mol\right)\)
PTHH: Na2CO3 + 2HCl --> 2NaCl + CO2 + H2O
0,2------------------>0,4---->0,2
mdd sau pư = 200 + 21,2 - 0,2.44 = 212,4(g)
=> \(C\%\left(NaCl\right)=\dfrac{0,4.58,5}{212,4}.100\%=11,017\%\)
Đúng 7 Bình luận (0) Gửi Hủy
Gửi Hủy  Nguyễn Hoàng Minh
Nguyễn Hoàng Minh  19 tháng 1 2022 lúc 16:56
19 tháng 1 2022 lúc 16:56 $PTHH:Na_2CO_3+2HCl\to 2NaCl+H_2O+CO_2\uparrow$
$n_{Na_2CO_3}=\dfrac{21,2}{106}=0,2(mol)$
Theo PT: $n_{NaCl}=n_{CO_2}=0,2(mol)$
$\Rightarrow m_{NaCl}=0,4.58,5=23,4(g);m_{CO_2}=0,2.44=8,8(g)$
$\Rightarrow C\%_{NaCl}=\dfrac{23,4}{21,2+200-8,8}.100\%\approx 11,01\%$
Đúng 4 Bình luận (3) Gửi Hủy
Gửi Hủy 
- Haley Woo
(3 điểm). Cho 13 gam Kẽm Zn tác dụng vừa đủ với 100 gam dung dịch HCl. a) Viết phương trình hóa học của phản ứng. b) Tính nồng độ phần trăm dung dịch HCl đã dùng. c) Tính nồng độ phần trăm dung dịch muối tạo thành.
Xem chi tiết Lớp 9 Hóa học 2 0 Gửi Hủy
Gửi Hủy  Nguyễn Nho Bảo Trí
Nguyễn Nho Bảo Trí  6 tháng 12 2021 lúc 10:30
6 tháng 12 2021 lúc 10:30 \(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
a) Pt : \(Zn+2HCl\rightarrow ZnCl_2+H_2|\)
1 2 1 1
0,2 0,4 0,2 0,2
b) \(n_{HCl}=\dfrac{0,2.2}{1}=0,4\left(mol\right)\)
⇒ \(m_{HCl}=0,4.36,5=14,6\left(g\right)\)
\(C_{ddHCl}=\dfrac{14,6.100}{100}=14,6\)0/0
c) \(n_{ZnCl2}=\dfrac{0,4.1}{2}=0,2\left(mol\right)\)
⇒ \(m_{ZnCl2}=0,2.136=27,2\left(g\right)\)
\(m_{ddspu}=13+100-\left(0,2.2\right)=112,6\left(g\right)\)
\(C_{ZnCl2}=\dfrac{27,2.100}{112,6}=24,16\)0/0
Chúc bạn học tốt
Đúng 2 Bình luận (1)
 Gửi Hủy
Gửi Hủy  Minh Nhân
Minh Nhân  6 tháng 12 2021 lúc 10:32
6 tháng 12 2021 lúc 10:32 \(n_{Zn}=\dfrac{13}{65}=0.2\left(mol\right)\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(0.2........0.4..........0.2.......0.2\)
\(m_{HCl}=0.4\cdot36.5=14.6\left(g\right)\)
\(C\%_{HCl}=\dfrac{14.6}{100}\cdot100\%=14.6\%\)
\(m_{ZnCl_2}=0.2\cdot136=27.2\left(g\right)\)
\(m_{\text{dung dịch sau phản ứng}}=13+100-0.2\cdot2=112.6\left(g\right)\)
\(C\%_{ZnCl_2}=\dfrac{27.2}{112.6}\cdot100\%=24.1\%\)
Đúng 2 Bình luận (0) Gửi Hủy
Gửi Hủy 
- trần thị minh anh
Cho 10 (g) NaOH tác dụng vừa đủ với dung dịch H2SO4 10%.
a- Viết PTHH xảy ra
b- Tính khối lượng muối tạo thành.
c- Tính khối lượng dung dịch H2SO4 tam gia phản ứng.
d- Tính nồng độ phần trăm của dung dịch thu được sau phản ứng.
Giúp mình zới
Xem chi tiết Lớp 9 Hóa học Bài 10. Một số muối quan trọng 1 0 Gửi Hủy
Gửi Hủy  𝓓𝓾𝔂 𝓐𝓷𝓱
𝓓𝓾𝔂 𝓐𝓷𝓱  13 tháng 10 2021 lúc 20:31
13 tháng 10 2021 lúc 20:31 PTHH: \(2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\)
Ta có: \(n_{Na_2SO_4}=n_{H_2SO_4}=\dfrac{1}{2}n_{NaOH}=\dfrac{1}{2}\cdot\dfrac{10}{40}=0,125\left(mol\right)\) \(\Rightarrow\left\{{}\begin{matrix}m_{ddH_2SO_4}=\dfrac{0,125\cdot98}{10\%}=122,5\left(g\right)\\m_{Na_2SO_4}=0,125\cdot142=17,75\left(g\right)\end{matrix}\right.\)
\(\Rightarrow C\%_{Na_2SO_4}=\dfrac{17,75}{10+122,5}\cdot100\%\approx13,4\%\)
Đúng 1 Bình luận (0)
 Gửi Hủy
Gửi Hủy 
- Quốc Vinh Nguyễn
Cho 13 g kẽm (Zn) tác dụng vừa đủ với 200g dung dịch HCL
a) viết phương trình phản ứng
b) Tính thể tích khí thoát ra sau phản ứng ở ĐKTC
c)tính nồng độ phần trăm của dung dịch HCL đã dùng
(cho: Zn= 65, H=1, CL= 35,5)
Xem chi tiết Lớp 8 Hóa học 1 0 Gửi Hủy
Gửi Hủy  Nguyễn Quang Minh
Nguyễn Quang Minh  12 tháng 5 2022 lúc 5:37
12 tháng 5 2022 lúc 5:37 \(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\\ pthh:Zn+2HCl\rightarrow ZnCl_2+H_2\) 0,2 0,4 0,2 \(V_{H_2}=0,2.22,4=4,48\left(l\right)\\ C\%_{HCl}=\dfrac{0,4.36,5}{200}.100\%=7,3\%\)
Đúng 3 Bình luận (0) Gửi Hủy
Gửi Hủy 
- Khôi Đoàn
Cho 10,2 g Al2O3 tác dụng vừa đủ với dung dịch HCl 10%.a)Tính khối lượng dung dịch HCl cần dùng.b)Tìm khối lượng của AlCl3 tạo ra sau phản ứngc)Tìm nồng độ phần trăm của dung dịch muối.
Xem chi tiết Lớp 9 Hóa học 3 0 Gửi Hủy
Gửi Hủy  Nguyễn Nho Bảo Trí
Nguyễn Nho Bảo Trí  17 tháng 9 2021 lúc 15:55
17 tháng 9 2021 lúc 15:55 \(n_{Al2O3}=\dfrac{10,2}{102}=0,1\left(mol\right)\)
Pt : \(Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O|\)
1 6 2 3
0,1 0,6 0,1
a) \(n_{HCl}=\dfrac{0,1.6}{1}=0,6\left(mol\right)\)
\(m_{HCl}=0,6.36,5=21,9\left(g\right)\)
\(m_{ddHCl}=\dfrac{21,9.100}{10}=219\left(g\right)\)
b) \(n_{AlCl3}=\dfrac{0,6.2}{6}=0,2\left(mol\right)\)
⇒ \(m_{AlCl3}=0,2.133,5=26,7\left(g\right)\)
c) \(m_{ddspu}=10,2+219=229,2\left(g\right)\)
\(C_{AlCl3}=\dfrac{26,7.100}{229,2}=11,65\)0/0
Chúc bạn học tốt
Đúng 1 Bình luận (0) Gửi Hủy
Gửi Hủy  bùi đình hoàng anh 17 tháng 9 2021 lúc 15:50
bùi đình hoàng anh 17 tháng 9 2021 lúc 15:50 nAl2O3=10.2:102=0.1(mol)
PTHH:Al2O3+6HCl->2AlCl3+3H2O
theo pthh:nHCl:nAl2O3=6->nHCl=6*0.1=0.6(mol)
mHCl=0.6*36.5=21.9(g)
mdd HCl=21.9*100:14.6=150(g)
theo pthh:nAlCl3:nAl2O3=2->nAlCl3=0.1*2=0.2(mol)
mAlCl3=0.2*133.5=26.7(g)
mdd sau phản ứng:10.2+150=160.2
Đúng 0 Bình luận (0) Gửi Hủy
Gửi Hủy  Nguyễn Cẩm Uyên
Nguyễn Cẩm Uyên  17 tháng 9 2021 lúc 16:12
17 tháng 9 2021 lúc 16:12 a)\(n_{Al_2O_3}=\dfrac{m}{M}=\dfrac{10,2}{102}=0,1\left(mol\right)\)
PTHH:\(Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O\)
0,1 0,6 0,2 0,3 (mol)
\(m_{HCl}=n.M=0,6.36,5=21,9\left(g\right)\)
b)\(m_{AlCl_3}=n.M=0,2.133,5=26,7\left(g\right)\)
c)\(m_{ddHCl}=\dfrac{m_{HCl}}{C\%}.100\)=\(\dfrac{21,9}{10}.100\)=219(g)
theo định luật bảo toàn khối lượng
\(m_{Al_2O_3}+m_{ddHCl}=m_{ddAlCl_3}\)\(\Rightarrow m_{ddAlCl_3}=10,2+219\)=229,2(g)
\(C\%_{AlCl_3}=\dfrac{m_{AlCl_3}}{m_{ddAlCl_3}}.100\)=\(\dfrac{26,7}{229,2}.100\)=8,92%
Đúng 0 Bình luận (0)
 Gửi Hủy
Gửi Hủy 
- Hoàng Phúc Nguyễn
-
Cho 25 gam dung dịch axit axetic 6% tác dụng vừa đủ với dung dịch Na2CO3 5,3%.
a) Viết PTHH
b) Tính khối lượng dung dịch Na2CO3 đã dùng.
c) Tính nồng độ phần trăm của dung dịch muối thu được sau phản ứng.
"Mong mn giúp đỡ."
Xem chi tiết Lớp 9 Hóa học 2 0 Gửi Hủy
Gửi Hủy  ๖ۣۜDũ๖ۣۜN๖ۣۜG
๖ۣۜDũ๖ۣۜN๖ۣۜG  10 tháng 5 2022 lúc 21:04
10 tháng 5 2022 lúc 21:04 a) Na2CO3 + 2CH3COOH --> 2CH3COONa + CO2 + H2O
b) \(n_{CH_3COOH}=\dfrac{25.6\%}{60}=0,025\left(mol\right)\)
PTHH: Na2CO3 + 2CH3COOH --> 2CH3COONa + CO2 + H2O
0,0125<-----0,025------------>0,025------>0,0125
=> \(m_{Na_2CO_3}=0,0125.106=1,325\left(g\right)\)
c) \(m_{dd.sau.pư}=1,325+25-0,0125.44=25,775\left(g\right)\)
\(C\%_{dd.CH_3COONa}=\dfrac{0,025.82}{25,775}.100\%=7,95\%\)
Đúng 1 Bình luận (2) Gửi Hủy
Gửi Hủy  Buddy
Buddy  10 tháng 5 2022 lúc 21:03
10 tháng 5 2022 lúc 21:03 m CH3COOH=1,5g=>n=0,025 mol
2CH3COOH+Na2CO3->2CH3COONa+H2O+CO2
0,025--------------0,0125----------0,025
=>m Na2CO3=0,0125.106=1,325g
=>mdd=25g
c)
C% =\(\dfrac{0,025.82}{25+25}100=4,1\%\)
Đúng 0 Bình luận (0) Gửi Hủy
Gửi Hủy 
- Nguyễn Bùi Đăng Dương
cho 200g dung dịch NaOh 20% tác dụng vừa hết với 100g dung dịch hcla) tính nồng độ phần trăm axit hcl đã dùngb) tính nồng độ phần trăm của dung dịch muối
Xem chi tiết Lớp 8 Hóa học Bài 44: Bài luyện tập 8 1 0 Gửi Hủy
Gửi Hủy  Lê Ng Hải Anh
Lê Ng Hải Anh  20 tháng 4 2023 lúc 20:42
20 tháng 4 2023 lúc 20:42 Ta có: \(m_{NaOH}=200.20\%=40\left(g\right)\Rightarrow n_{NaOH}=\dfrac{40}{40}=1\left(mol\right)\)
PT: \(NaOH+HCl\rightarrow NaCl+H_2O\)
a, Theo PT: \(n_{HCl}=n_{NaOH}=1\left(mol\right)\)
\(\Rightarrow C\%_{HCl}=\dfrac{0,1.36,5}{100}.100\%=36,5\%\)
b, \(n_{NaCl}=n_{NaOH}=1\left(mol\right)\)
Ta có: m dd sau pư = 200 + 100 = 300 (g)
\(\Rightarrow C\%_{NaCl}=\dfrac{1.58,5}{300}.100\%=19,5\%\)
Đúng 1 Bình luận (0) Gửi Hủy
Gửi Hủy Từ khóa » Tính Nồng độ Phần Trăm Hcl đã Dùng
-
Tính Nồng độ Phần Trăm Của Dung Dịch HCl đã Dùng - HOC247
-
Tính Nồng độ Phần Trăm Của Dung Dịch HCl đã Tham Gia Phản ứng
-
Tính Nồng độ Phần Trăm Của Dung Dịch HCl đã Dùng. - Tự Học 365
-
Tính Nồng độ Phần Trăm Của Dung Dịch HCl đã Dùng Và Dung Dịch X
-
Tính Nồng độ Phần Trăm Của Dung Dịch HCl đã Dùng
-
Công Thức Tính Nồng độ Phần Trăm, Ví Dụ Minh Họa - VietChem
-
Công Thức Tính Nồng độ Mol - Luật Hoàng Phi
-
Nồng độ Phần Trăm Là Gì? Công Thức, Hướng Dẫn Tính & Lưu ý Khi Tính
-
Người Ta Dùng 13 Gam Kẽm Cho Vào 400g Dd HCL A. Tính Thể Tích ...
-
Tính Nồng độ Phần Trăm Của Các Dung Dịch Sau - Hàng Hiệu Giá Tốt
-
Công Thức Tính Nồng độ Mol Và Nồng độ Phần Trăm
-
[Chi Tiết] Bài Tập & Công Thức Tính Nồng Độ Mol Dung Dịch!
-
1.hòa Tan 16 Gam CuO Vào Dung Dịch HCl 7.3% A. Tính ... - MTrend
