Cho Phản ứng Xảy Ra ở áp Suất Không đổi: 2H2 CO = CH3OH(k ...
HOC24
Lớp học Học bài Hỏi bài Giải bài tập Đề thi ĐGNL Tin tức Cuộc thi vui Khen thưởng- Tìm kiếm câu trả lời Tìm kiếm câu trả lời cho câu hỏi của bạn
Lớp học
- Lớp 12
- Lớp 11
- Lớp 10
- Lớp 9
- Lớp 8
- Lớp 7
- Lớp 6
- Lớp 5
- Lớp 4
- Lớp 3
- Lớp 2
- Lớp 1
Môn học
- Toán
- Vật lý
- Hóa học
- Sinh học
- Ngữ văn
- Tiếng anh
- Lịch sử
- Địa lý
- Tin học
- Công nghệ
- Giáo dục công dân
- Tiếng anh thí điểm
- Đạo đức
- Tự nhiên và xã hội
- Khoa học
- Lịch sử và Địa lý
- Tiếng việt
- Khoa học tự nhiên
- Hoạt động trải nghiệm
- Hoạt động trải nghiệm, hướng nghiệp
- Giáo dục kinh tế và pháp luật
Chủ đề / Chương
Bài học
HOC24
 Khách vãng lai Đăng nhập Đăng ký Khám phá Hỏi đáp Đề thi Tin tức Cuộc thi vui Khen thưởng
Khách vãng lai Đăng nhập Đăng ký Khám phá Hỏi đáp Đề thi Tin tức Cuộc thi vui Khen thưởng - Tất cả
- Toán
- Vật lý
- Hóa học
- Sinh học
- Ngữ văn
- Tiếng anh
- Lịch sử
- Địa lý
- Tin học
- Công nghệ
- Giáo dục công dân
- Tiếng anh thí điểm
- Hoạt động trải nghiệm, hướng nghiệp
- Giáo dục kinh tế và pháp luật
Câu hỏi
Hủy Xác nhận phù hợp Chọn lớp Tất cả Lớp 12 Lớp 11 Lớp 10 Lớp 9 Lớp 8 Lớp 7 Lớp 6 Lớp 5 Lớp 4 Lớp 3 Lớp 2 Lớp 1 Môn học Toán Vật lý Hóa học Sinh học Ngữ văn Tiếng anh Lịch sử Địa lý Tin học Công nghệ Giáo dục công dân Tiếng anh thí điểm Đạo đức Tự nhiên và xã hội Khoa học Lịch sử và Địa lý Tiếng việt Khoa học tự nhiên Hoạt động trải nghiệm Hoạt động trải nghiệm, hướng nghiệp Giáo dục kinh tế và pháp luật Mới nhất Mới nhất Chưa trả lời Câu hỏi hay
- Nguyễn Huy Hà
Khi 1 mol rượu metylic cháy ở 298K và thể tích cố định theo phản ứng:
CH 3 OH(l) + 3/2O 2 (k) CO 2 (k) + 2H 2 O(l) Giải phóng ra một lượng nhiệt là 725,86 kJ. TínhH của phản ứng:a. Biết nhiệt sinh tiêu chuẩn của H 2 O(l) và CO 2 (k) tương ứng là – 285,84 kJ.mol -1 và –393,51 kJ.mol -1 . Tính sinh nhiệt tiêu chuẩn của CH 3 OH(l).b. Nhiệt bay hơi của CH 3 OH(l) là 34,86 kJ.mol -1 . Tính sinh nhiệt tiêu chuẩn củaCH 3 OH(k).
Xem chi tiết Lớp 12 Hóa học 0 1 Gửi Hủy
Gửi Hủy 
- nguyen van tam
25. Tính ΔGo 373 của phản ứng: CH4 + H2O (k) = CO + 3H2. Biết sinh nhiệt chuẩn ΔHo S,298 của CH4, H2O(k) và CO bằng −74,8; −241,8 và −110,5 kJ/mol. Entropy chuẩn của CH4, H2O (k), CO và H2 bằng 186,2;188,7; 197,6 và 131,1 J/K.mol. Trong tính toán giả thiết rằng ΔHo và ΔSo không phụ thuộc T, các chất được lấy ở trạng thái chuẩn. - Từ giá trị ΔGo 373 tìm được có thể kết luận gì về khả năng tự diễn biến của phản ứng ở 373K? - Ở nhiệt độ nào thì phản ứng tự xảy ra?
26. Cho phản ứng CaCO3(r) à CaO (r) + CO2 (k) Biết sinh nhiệt chuẩn và entropy chuẩn của CaCO3 (r), CaO (r), CO2 (k) lần lượt bằng −1206,9; −635,5; −393,5 (kJ/mol) và 92,9; 39,7; 213,68 (J/mol.K). Khi tính toán giả thiết rằng ΔHo và ΔSo không phụ thuộc vào nhiệt độ, các chất được lấy ở trạng thái chuẩn. a) Ở 298K phản ứng có tự xảy ra không? b) Tại nhiệt độ nào thì phản ứng đã cho tự xảy ra?
giúp với máy ac thank ạ
Xem chi tiết Lớp 10 Hóa học Chương 7. Tốc độ phản ứng và cân bằng hóa học 0 0 Gửi Hủy
Gửi Hủy 
- Pham Van Tien
Cho phản ứng xảy ra ở áp suất không đổi: 2H2 + CO = CH3OH(k). Nhiệt tạo thành tiêu chuẩn ở 298K của CO và CH3OH(k) bằng -110,5 và -201,2 kJ/mol. Nhiệt dung mol đẳng áp của các chất là một hàm của nhiệt độ:
Cp (H2) = 27,28 + 3,3.10-3T (J/mol.K)x
Cp (CO) = 28,41 + 4,1.10-3T (J/mol.K)
Cp (CH3OH)k = 15,28 + 105,2.10-3T (J/mol.K)
Tính ΔH0 của phản ứng ở 298 và 500K?
Xem chi tiết Lớp 7 Hóa học NHIỆT ĐỘNG HÓA HỌC 6 0 Gửi Hủy
Gửi Hủy  Duy 20130611 KTHH03 15 tháng 3 2015 lúc 22:16
Duy 20130611 KTHH03 15 tháng 3 2015 lúc 22:16 Nhiệt phản ứng tại 298K là:
\(\Delta\)Ho298= -201,2.103 - (-110,5.103) = -90700 (J)
Vì phản ứng xảy ra tại áp suất không đổi nên biến thiên nhiệt dung mol của phản ứng là:
\(\Delta\)Cp= Cp(CH3OH) - [Cp(CO) + 2Cp(H2)]
=15,28+105,2.10-3T - [28,41+4,1.10-3T + 2.(27,28+3,3.10-3)]
= -67,69 + 94,58.10-3T (J/K)
Nhiệt phản ứng ở 500K là
\(\Delta\)Ho500= \(\Delta\)Ho298 + \(\int\limits^{500}_{298}\Delta CpdT\)
= -90700 + \(\int\limits^{500}_{298}\left(-67,69+94,58.10^{-3}T\right)dT\)
= -90700 + (-13673,38 +7622,96)
= -96750,42 (J)
Đúng 0 Bình luận (1) Gửi Hủy
Gửi Hủy  Lê Thị Liên 15 tháng 3 2015 lúc 22:16
Lê Thị Liên 15 tháng 3 2015 lúc 22:16 * Ở nhiệt độ và áp suất không đổi :T = const ,P = H0298 = H0298(CH3OH) - 2H0298(CO)
= - 201,2 - (-110,5) = -90,7 (kJ/mol)
*Nhiệt dung mol đẳng áp của p/ư là
\(\Delta\)Cp = \(\Sigma\) Cp(s) - \(\Sigma\)Cp (t) = Cp(CH3OH) - 2.Cp(H2) - Cp(CO)
= 15,28 + 105,2.10-3T - 2.(27,28 + 3,3.10-3T ) - ( 28,41 + 4,1.10-3T ) = -67,69 - 94,5.10-3T (J/mol.K)
*Dựa vào định luật Kirchhoff :
\(\Delta\)HT = \(\Delta\)H298 + \(\int\limits^T_{298}\Delta\)CP dT
= -90,7.103 + \(\int\limits^T_{298}\)( -67,69 - 94,5.10-3T )dT = -90,7.103 - 67,69 (T - 298) - 94,5.10-3(T2 - 2982)/2
= -62136,402 -67,69.T - 4,725.10-2.T2 (J/mol)
H0 của p/ư ở 500k là
H0500 = -62136,402 -67,69.500 - 4,725.10-2.5002 = - 1,78.105 (J/mol)
Đúng 0 Bình luận (0)
 Gửi Hủy
Gửi Hủy  Nguyễn Huy Hoàng Hải 15 tháng 3 2015 lúc 22:51
Nguyễn Huy Hoàng Hải 15 tháng 3 2015 lúc 22:51 Ta có: \(\Delta H_{pứng}^0=\Delta H_{sinh\left(saupư\right)}^0-\Delta H_{sinh\left(trướcpư\right)}^0\) hay ở 298K: \(\Delta H_{298\left(pư\right)}^0=\Delta H_{sinh,298\left(CH_3OH\right)}^0-\Delta H^0_{sinh,298\left(CO\right)}=\left(-201,2\right)-\left(-110,5\right)=-90,7\left(kJ\right)=-90700\left(J\right)\)
Mặt khác ta có: \(\Delta C_{p\left(pư\right)}=\Delta C_{p\left(chấtsp\right)}-\Delta C_{p\left(chấttg\right)}=\Delta C_{p\left(CH_3OH\right)_k}-\left(\Delta C_{p\left(CO\right)_k}+\Delta C_{p\left(H_2\right)}\right)=15,28+105,2.10^{-3}T-\left(28,41+4,1.10^{-3}T+27,28+3,3.10^{-3}T\right)=-40,41+97,8.10^{-3}T\left(\frac{J}{mol.K}\right)\)
Áp dụng công thức của định luật Kirchoff : \(\Delta H_T=\Delta H^0_{298}+\int_{298}^T\Delta C_pdT\)
thay số vào ta có: \(\Delta H^0_T=-90700+\int\limits^T_{298}\left(-40,41+97,8.10^{-3}T\right)dT=-83000,34-40,41T^2+48,9.10^{-3}T^3\left(J\right)\) (1)
Vậy tại T=500K thay số vào(1) ta tính được: \(\Delta H_{500}^0=-4073000,34\left(J\right)=-4073\left(kJ\right)\)
Đúng 0 Bình luận (0)
 Gửi Hủy Xem thêm câu trả lời
Gửi Hủy Xem thêm câu trả lời 
- Minh Nguyen
Thầy và các bạn giúp mình câu này với :Xác định hằng số Cân bằng ở 800K của : CO + 2H2 = CH3OH
biết ở 25oC , delta H0= -90,64 kj/mol và Kp = 4,23
Cp,CO = 27,61 + 5,02.10^-3 T
Cp,H2 = 29,07 - 0,84.10^-3T +2.10^-6 T^2
Cp,CH3OH = 20,4 + 100.10^-3 T - 24,6.10^-6 T^2
Xem chi tiết Lớp 7 Hóa học NHIỆT ĐỘNG HÓA HỌC 4 0
 Gửi Hủy
Gửi Hủy  Nguyễn Văn Toàn 28 tháng 4 2016 lúc 16:52
Nguyễn Văn Toàn 28 tháng 4 2016 lúc 16:52 

 Gửi Hủy
Gửi Hủy  Pham Van Tien 29 tháng 4 2016 lúc 9:29
Pham Van Tien 29 tháng 4 2016 lúc 9:29 Bài này bạn Toàn làm hơi dài mà chưa được chặt chẽ.
Bạn Toàn chứng minh cho Thầy công thức \(\Delta S_{800}\) = \(\Delta S_{298}\) + \(\int\Delta C_p\frac{dT}{T}\)
Chỉ khi nào chứng minh được CT đó mới được sử dụng.
Đúng 0 Bình luận (0) Gửi Hủy
Gửi Hủy  Nguyễn Văn Sử-20143899 8 tháng 5 2016 lúc 16:51
Nguyễn Văn Sử-20143899 8 tháng 5 2016 lúc 16:51 

 Gửi Hủy Xem thêm câu trả lời
Gửi Hủy Xem thêm câu trả lời 
- nguyễn văn dũng
. Cho phản ứng CO (k) +Cl2 COCl2 (k) xảy ra ở 1500C.
a) Nếu muốn cân bằng dịch chuyển theo chiều thu được nhiều sản phẩm hơn thì phải thay đổi nồng độ các chất và áp suất của hệ như thế nào?
b) Tính hằng số Kc và Kp của phản ứng ở nhiệt độ trên. Biết nồng độ ban đầu của CO và Cl2 đều bằng 0,1M và khi cân bằng chỉ còn 50% CO ban đầu. Cho biết R = 0,08205 atm.l/ mol.K
Xem chi tiết Lớp 12 Hóa học 0 1 Gửi Hủy
Gửi Hủy 
- Nguyễn Hoàng Nam
Cho vào một bình kín dung tích không đổi a mol Cl2 và 1 mol H2 thì áp suất của bình là 2,5 atm. Nung nóng bình cho phản ứng xảy ra với hiệu suất đạt 80%. Đưa bình về nhiệt độ ban đầu thì áp suất của bình là
A. 1,35 atm
B. 1,75 atm
C. 2 atm
D. 2,5 atm
Xem chi tiết Lớp 0 Hóa học 1 0 Gửi Hủy
Gửi Hủy  Ngô Quang Sinh
Ngô Quang Sinh  12 tháng 1 2017 lúc 17:40
12 tháng 1 2017 lúc 17:40 
 Gửi Hủy
Gửi Hủy 
- Nguyễn Hoàng Nam
Cho vào một bình kín dung tích không đổi a mol Cl2 và 1 mol H2 thì áp suất của bình là 2,5 atm. Nung nóng bình cho phản ứng xảy ra với hiệu suất đạt 80%. Đưa bình về nhiệt độ ban đầu thì áp suất của bình là:
A. 1,35 atm.
B. 1,75 atm.
C. 2 atm.
D. 2,5 atm.
Xem chi tiết Lớp 0 Hóa học 1 0 Gửi Hủy
Gửi Hủy  Ngô Quang Sinh
Ngô Quang Sinh  9 tháng 6 2017 lúc 3:19
9 tháng 6 2017 lúc 3:19 Chọn đáp án D.
+ Áp suất tỷ lệ với số mol p 1 p 2 = n 1 n 2
+ Ta dễ thấy dù phản ứng xảy ra với hiệu suất bao nhiêu thì số mol khí cũng không đổi → p = c o n s t = 2 , 5 a t m
Đúng 0 Bình luận (0) Gửi Hủy
Gửi Hủy 
- Nguyễn Hoàng Nam
Cho phản ứng ở trạng thái cân bằng: A ( k ) + B ( k ) ⇌ C ( k ) + D ( k ) .
Ở nhiệt độ và áp suất không đổi, xảy ra sự tăng nồng độ của khí A là do:
A. Sự tăng áp suất
B. Sự giảm nồng độ của khí B
C. Sự giảm nồng độ của khí C
D. Sự giảm áp suất
Xem chi tiết Lớp 10 Hóa học 1 0 Gửi Hủy
Gửi Hủy  Ngô Quang Sinh
Ngô Quang Sinh  17 tháng 6 2018 lúc 6:48
17 tháng 6 2018 lúc 6:48 Ở nhiệt độ và áp suất không đổi, xảy ra sự tăng nồng độ của khí A là do:
Sự giảm nồng độ của khí B và sự tăng nồng độ của khí C
Chọn B
Đúng 0 Bình luận (0) Gửi Hủy
Gửi Hủy 
- Nguyễn Hoàng Nam
Cho phản ứng ở trạng thái cân bằng: A(k) + B(k) ⇔ C(k) + D(k).
Ở nhiệt độ và áp suất không đổi, xảy ra sự tăng nồng độ của khí A là do:
A. Sự tăng áp suất.
B. Sự giảm nồng độ của khí B.
C. Sự giảm nồng độ của khí C.
D. Sự giảm áp suất
Xem chi tiết Lớp 10 Hóa học 1 0 Gửi Hủy
Gửi Hủy  Ngô Quang Sinh
Ngô Quang Sinh  12 tháng 8 2019 lúc 8:03
12 tháng 8 2019 lúc 8:03 Đáp án B
Ở nhiệt độ và áp suất không đổi, xảy ra sự tăng nồng độ của khí A là do:Sự giảm nồng độ của khí B và sự tăng nồng độ của khí CChọn B
Đúng 0 Bình luận (0) Gửi Hủy
Gửi Hủy 
- Nguyễn Hoàng Nam
Nén 2 mol N2 và 8 mol H2 vào bình kín có thể tích 2 lít (chứa sẵn chất xúc tác với thể tích không đáng kể) và giữ cho nhiệt độ không đổi. Khi phản ứng trong bình đạt tới trạng thái cân bằng, áp suất các khí trong bình bằng 0,8 lần áp suất lúc đầu (khi mới cho vào bình, chưa xảy ra phản ứng). Hằng số cân bằng của phản ứng xảy ra trong bình là
A. 0,127
B. 0,126
C. 0,218
D. 0,128
Xem chi tiết Lớp 11 Hóa học 1 0 Gửi Hủy
Gửi Hủy  Ngô Quang Sinh
Ngô Quang Sinh  18 tháng 10 2017 lúc 4:48
18 tháng 10 2017 lúc 4:48 Đáp án D
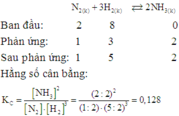
 Gửi Hủy
Gửi Hủy Từ khóa » Tính đen Ta H Của Phản ứng
-
Cách để Tính Entanpy Của Phản ứng Hóa Học - WikiHow
-
SỬ DỤNG ĐỊNH LUẬT HESS VÀ CÁC HỆ QUẢ CỦA NÓ ĐỂ XÁC ...
-
[PDF] ĐỀ CƯƠNG ÔN TẬP BÀI THI HÓA HỌC ĐẠI CƯƠNG.pdf
-
Hoa Dai_cuong_quyen_chuong_3 (dành Cho Sinh Viên đại Học))
-
[PDF] CHƯƠNG III NHIỆT HÓA HỌC
-
Công Thức Hóa Đại Cương - Học Để Thi
-
TÍNH NHIỆT PHẢN ỨNG DỰA VÀO PHƯƠNG PHÁP TỔ HỢP ...
-
Chương 6, 7 - Nhiệt động Học Hóa Học | CTCT - Chúng Ta Cùng Tiến
-
Bai Tap Nhiet Dong Hoa HSG
-
Giúp Em Về Nhiệt động Hóa Học [Lưu Trữ] - GiMiTEC
-
(DOC) Hóa Lý (lý Thuyết + Bài Tập + Lời Giải) | Trầm Kỳ
-
Enthalpy – Wikipedia Tiếng Việt
-
[PDF] BÀI TẬP VỀ NHIỆT ĐỘNG HỌC 1. Tính Năng Lượng Liên Kết Trung ...