Cyclohexene Cấu Trúc, Tính Chất, Tổng Hợp Và Sử Dụng / Hóa Học
Có thể bạn quan tâm
các xyclohene là một olefin anken hoặc tuần hoàn có công thức phân tử là C6H10. Nó bao gồm một chất lỏng không màu, không hòa tan trong nước và có thể trộn với nhiều dung môi hữu cơ. Nó được đặc trưng bởi dễ cháy, và trong tự nhiên, nó thường được tìm thấy trong nhựa than đá..
Cyclohexene được tổng hợp bằng cách hydro hóa một phần benzen và bằng cách khử nước cyclohexanol của rượu; đó là, một hình thức gỉ hơn. Giống như các cycloalken khác, nó trải qua các phản ứng bổ sung điện di và với các gốc tự do; ví dụ phản ứng halogen hóa.
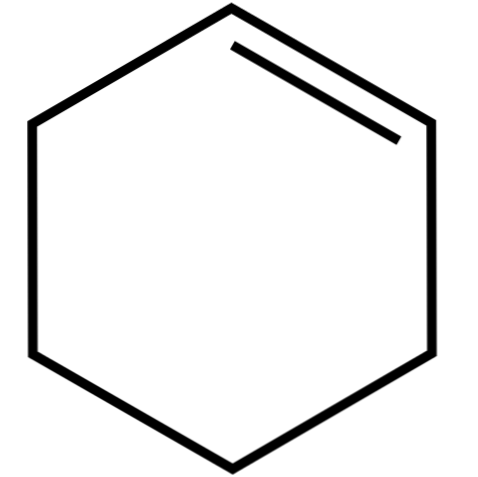
Anken tuần hoàn này (hình trên cùng) tạo thành hỗn hợp azeotropic (không thể tách ra bằng cách chưng cất), với rượu thấp hơn và axit axetic. Nó không ổn định trong việc lưu trữ kéo dài, vì nó bị phân hủy dưới tác động của ánh sáng mặt trời và tia cực tím.
Cyclohexene được sử dụng làm dung môi, và do đó, có rất nhiều ứng dụng, như: chất ổn định khí gas có chỉ số octan cao và để chiết xuất dầu.
Nhưng điều quan trọng nhất là cyclohexene đóng vai trò là nguyên liệu trung gian và nguyên liệu để sản xuất nhiều hợp chất hữu ích, trong số đó: cyclohexanone, axit adipic, axit maleic, cyclohexane, butadien, axit cyclohexylcarboxylic, v.v..
Chỉ số
- 1 Cấu trúc của xyclohexene
- 1.1 Tương tác liên phân tử
- 2 thuộc tính
- 2.1 Tên hóa học
- 2.2 Trọng lượng phân tử
- 2.3 Ngoại hình
- Mùi 2,4
- 2.5 Điểm sôi
- 2.6 Điểm nóng chảy
- 2.7 Điểm chớp cháy
- 2.8 Độ hòa tan trong nước
- 2.9 Độ hòa tan trong dung môi hữu cơ
- Mật độ 2,10
- 2.11 Mật độ hơi
- 2.12 Áp suất hơi
- 2.13 Tự động đánh lửa
- 2.14 Phân hủy
- 2,15 Độ nhớt
- 2.16 Nhiệt đốt cháy
- 2.17 Nhiệt hóa hơi
- 2.18 Sức căng bề mặt
- 2.19 trùng hợp
- 2.20 Ngưỡng mùi
- 2,21 Chỉ số khúc xạ
- 2,22 pH
- Ổn định 2,23
- 2,24 phản ứng
- 3 Tóm tắt
- 4 công dụng
- 5 rủi ro
- 6 tài liệu tham khảo
Cấu trúc của xyclohexene
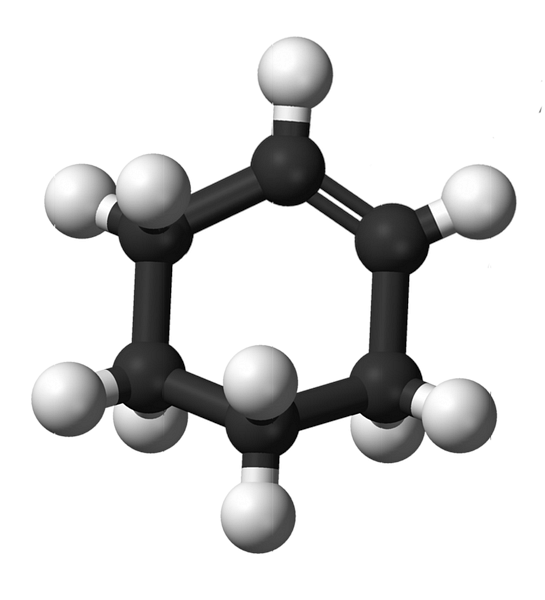
Cấu trúc của cyclohexene với mô hình hình cầu và thanh được thể hiện trong hình trên. Người ta có thể nhận thấy sáu vòng carbon và liên kết đôi, cả hai không bão hòa của hợp chất. Từ quan điểm này, dường như chiếc nhẫn là phẳng; nhưng nó không phải là tất cả.
Để bắt đầu, các nguyên tử cacbon của liên kết đôi có sự lai hóa sp2, cung cấp cho họ một hình học mặt phẳng lượng giác. Do đó, hai nguyên tử cacbon này và những vật liền kề với chúng nằm trong cùng một mặt phẳng; trong khi hai nguyên tử cacbon ở đầu đối diện (với liên kết đôi), ở trên và dưới mặt phẳng đã nói.
Hình dưới minh họa hoàn hảo những gì vừa được giải thích.

Lưu ý rằng dải màu đen bao gồm bốn nguyên tử cacbon: hai trong số các liên kết đôi và các dải khác liền kề với chúng. Viễn cảnh phơi bày là viễn cảnh sẽ thu được nếu một khán giả đặt mắt ngay trước liên kết đôi. Có thể thấy rằng một carbon ở trên và dưới mặt phẳng này.
Vì phân tử cyclohexene không tĩnh, hai nguyên tử cacbon sẽ trao đổi: một sẽ hạ xuống trong khi phân tử kia sẽ tăng lên trên mặt phẳng. Vì vậy, bạn sẽ mong đợi phân tử đó hành xử.
Tương tác liên phân tử
Cyclohexene là một hydrocarbon, và do đó, các tương tác liên phân tử của nó dựa trên các lực phân tán của London.
Điều này là do phân tử này là cực, không có khoảnh khắc lưỡng cực vĩnh viễn và trọng lượng phân tử của nó là yếu tố đóng góp nhiều nhất trong việc giữ cho nó gắn kết trong chất lỏng.
Ngoài ra, liên kết đôi làm tăng mức độ tương tác, vì nó không thể di chuyển với độ linh hoạt tương tự như các nguyên tử cacbon khác và điều này ủng hộ sự tương tác giữa các phân tử lân cận. Vì lý do này mà cyclohexene có điểm sôi cao hơn một chút (83 ° C) so với cyclohexane (81 ° C).
Thuộc tính
Tên hóa học
Xyclohexene, tetrahydrobenzene.
Trọng lượng phân tử
82.146 g / mol.
Ngoại hình
Chất lỏng không màu.
Mùi
Mùi ngọt.
Điểm sôi
83 ºC đến 760 mmHg.
Điểm nóng chảy
-103,5 CC.
Điểm đánh lửa
-7ºC (cốc kín).
Độ hòa tan trong nước
Hầu như không hòa tan (213 mg / L).
Độ hòa tan trong dung môi hữu cơ
Có thể trộn với ethanol, benzen, carbon tetraclorua, ether dầu khí và acetone. Người ta hy vọng rằng nó sẽ có thể hòa tan các hợp chất phân cực, giống như một số đồng vị của than.
Mật độ
0,810 g / cm3 ở 20 CC.
Mật độ hơi
2,8 (so với không khí lấy bằng 1).
Áp suất hơi
89 mmHg ở 25 CC.
Tự động đánh lửa
244 ºC.
Phân hủy
Bị phân hủy khi có muối urani, dưới tác động của ánh sáng mặt trời và tia cực tím.
Độ nhớt
0,625 mPascal ở 25 ºC.
Nhiệt lượng đốt cháy
3,751,7 kJ / mol ở 25 CC.
Nhiệt bay hơi
30,46 kJ / mol ở 25 ºC.
Sức căng bề mặt
26,26 mN / m.
Phản ứng trùng hợp
Nó có thể trùng hợp trong một số điều kiện.
Ngưỡng mùi
0,6 mg / m3.
Chỉ số khúc xạ
1.465 ở 20 ºC.
pH
7-8 ở 20 CC.
Ổn định
Cyclohexene không ổn định trong quá trình lưu trữ lâu dài. Việc tiếp xúc với ánh sáng và không khí có thể gây ra việc sản xuất peroxit. Tương tự như vậy, nó không tương thích với các tác nhân oxy hóa mạnh.
Phản ứng
-Cycloalkenes chủ yếu trải qua các phản ứng bổ sung, cả gốc điện và gốc tự do.
-Phản ứng với brom tạo thành 1,2-dibromocyclohexane.
-Oxy hóa nhanh chóng với sự hiện diện của kali permanganat (KMnO4).
-Nó có khả năng sản xuất một epoxit (cyclohexene oxide) với sự hiện diện của axit peroxybenzoic.
Tổng hợp
Cyclohexene được sản xuất bằng cách xúc tác axit của cyclohexanol:
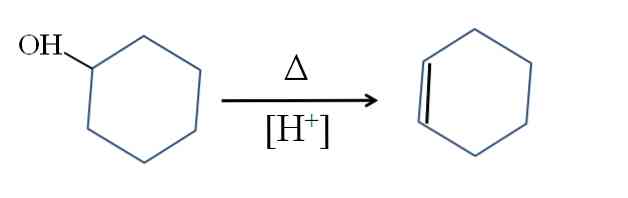
Biểu tượng biểu thị nhiệt cần thiết để thúc đẩy sự thoát ra của nhóm OH dưới dạng phân tử nước trong môi trường axit (-OH2+).
Cyclohexene cũng được sản xuất bởi quá trình hydro hóa một phần benzen; nghĩa là, hai trong số các liên kết đôi của nó thêm một phân tử hydro:
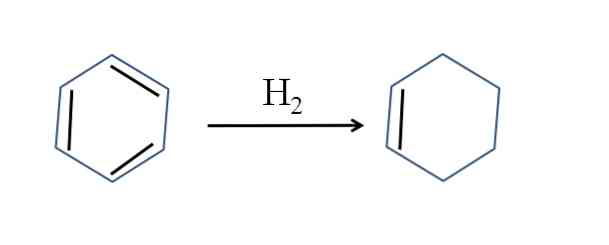
Mặc dù phản ứng có vẻ đơn giản, nhưng nó đòi hỏi áp lực lớn của H2 và chất xúc tác.
Công dụng
-Nó có công dụng như một dung môi hữu cơ. Ngoài ra, nó là nguyên liệu để sản xuất axit adipic, aldehyd adipic, axit maleic, cyclohexane và axit cyclohexylcarboxylic.
-Nó được sử dụng trong sản xuất cyclohexane clorua, một hợp chất được sử dụng làm chất trung gian trong sản xuất dược phẩm và phụ gia cao su..
-Cyclohexene cũng được sử dụng trong quá trình tổng hợp cyclohexanone, nguyên liệu thô để sản xuất thuốc, thuốc trừ sâu, nước hoa và thuốc nhuộm.
-Cyclohexene tham gia vào quá trình tổng hợp aminocyclohexanol, một hợp chất được sử dụng làm chất hoạt động bề mặt và chất nhũ hóa..
-Ngoài ra, cyclohexene có thể được sử dụng để điều chế trong phòng thí nghiệm của butadien. Hợp chất thứ hai được sử dụng trong sản xuất cao su tổng hợp, sản xuất lốp xe ô tô và cũng được sử dụng trong sản xuất nhựa acrylic.
-Cyclohexene là nguyên liệu thô để tổng hợp lysine, phenol, nhựa polycycloolefin và phụ gia cao su.
-Nó được sử dụng như một chất ổn định của khí gas có chỉ số octan cao.
-Tham gia vào quá trình tổng hợp các lớp phủ chống thấm, màng chống nứt và chất kết dính cho lớp phủ.
Rủi ro
Cyclohexene không phải là một hợp chất rất độc hại, nhưng nó có thể gây đỏ da và mắt khi tiếp xúc. Hít phải nó có thể gây ho và buồn ngủ. Ngoài ra, ăn vào có thể gây buồn ngủ, khó thở và buồn nôn.
Cyclohexene được hấp thu kém ở đường tiêu hóa, do đó không có tác dụng toàn thân nghiêm trọng nào được dự kiến do ăn vào. Biến chứng lớn nhất là do hệ hô hấp của nó hút, có thể tạo ra viêm phổi do hóa chất.
Tài liệu tham khảo
- Joseph F. Chiang và Simon Harvey Bauer. (1968). Cấu trúc phân tử của xyclohexene. J. Am. Hóa. Soc. 1969, 91, 8, 1898-1901.
- Karry Barnes. (2019). Cyclohexene: Nguy hiểm, Tổng hợp & Cấu trúc. Học tập. Lấy từ: học.com
- Morrison, R. T. và Boyd, R. N. (1987). Hóa hữu cơ (5tôi Phiên bản.). Biên tập Addison-Wesley Iberoamericana.
- PubChem. (2019). Xyclohexene. Lấy từ: pubool.ncbi.nlm.nih.gov
- Sách hóa học. (2019). Xyclohexene. Lấy từ: chembook.com
- Mạng dữ liệu độc tính. (2017). Xyclohexene. Mạng độc Lấy từ: toxnet.nlm.nih.gov
- Hóa trị. (s.f.). Công thức cấu tạo của cyclohexene là. Lấy từ: chemoxy.com
Từ khóa » Công Thức Cyclohexane
-
Xyclohexan(Phốt Pho,Cấu Tạo Cyclohexane) (Hóa Học) - Mimir
-
Dung Môi Cyclohexanone Và Những điều Cần Biết Về Cyclohexanone
-
CYCLOHEXANE - An Vĩnh Phát
-
Cyclohexane - Wiko
-
Cyclohexanone Là Gì? Đặc Tính Và ứng Dụng Của Cyclohexan
-
Tìm Hiểu Về Cyclohexane - Thiên Phước Group
-
[HHC1 - YDS] Đồng Phân Lập Thể - Các Cấu Dạng Của Cyclohexan
-
1,3-Cyclohexanedione | C6H8O2 - PubChem
-
Hóa Chất Cyclohexane
-
Cyclohexane | C6H12 - PubChem
-
Bán Cyclohexane 99% - Dung Môi Cyclohexanone Giá Rẻ Nhất 2022
-
Cyclohexane Cấu Kết Cấu Công Thức Lewis Cấu Trúc Phân Tử