[ĐÁP ÁN] Tính Chất Hóa Học Cơ Bản Của NH3 Là Gì?
Có thể bạn quan tâm
Nội dung bài viết
- Tính chất hóa học cơ bản của NH3
- Lý thuyết tham khảo
Hướng dẫn trả lời câu hỏi được đội ngũ chuyên gia giảng dạy biên soạn chi tiết, dễ hiểu, bám sát nội dung lý thuyết đã học trong sách giáo khoa kèm những hiểu biết ngoài thực tế.
Tính chất hóa học cơ bản của NH3
A. Tính bazơ yếu và tính oxi hóa
B. Tính bazơ yếu và tính khử
C. Tính bazơ mạnh và tính khử
D. Tính bazơ mạnh và tính oxi hóa
Lời giải:
Đáp án đúng: B
- Tính chất hóa học cơ bản của NH3 là tính bazơ yếu và tính khử.
Lý thuyết tham khảo
1. Tính bazơ yếu
- Tác dụng với nước:
NH3 + H2O ⇋ NH4+ + OH-
⇒ Dung dịch NH3 là một dung dịch bazơ yếu.
- Tác dụng với dung dịch muối (muối của những kim loại có hidroxit không tan):
AlCl3 + 3NH3 + 3H2O → Al(OH)3↓ + 3NH4Cl
Al3+ + 3NH3 + 3H2O → Al(OH)3↓ + 3NH4+
- Tác dụng với axit → muối amoni:
NH3 + HCl → NH4Cl (amoni clorua)
2NH3 + H2SO4 → (NH4)2SO4 (amoni sunfat)
2. Khả năng tạo phức
Dung dịch amoniac có khả năng hòa tan hiđroxit hay muối ít tan của một số kim loại, tạo thành các dung dịch phức chất.
Ví dụ:
* Với Cu(OH)2:
Cu(OH)2 + 4NH3 → [Cu(NH3)4](OH)2 (màu xanh thẫm)
* Với AgCl:
AgCl + 2NH3 → [Ag(NH3)2]Cl
Sự tạo thành các ion phức là do sự kết hợp các phân tử NH3 bằng các electron chưa sử dụng của nguyên tử nitơ với ion kim loại.
3. Tính khử
- Amoniac có tính khử: phản ứng được với oxi, clo và khử một số oxit kim loại (Nitơ có số oxi hóa từ -3 đến 0, +2).
- Tác dụng với oxi:
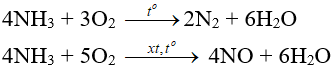
- Tác dụng với clo:
2NH3 + 3Cl2 → N2 + 6HCl
NH3 kết hợp ngay với HCl vừa sinh ra tạo “khói trắng” NH4Cl
- Tác dụng với CuO:
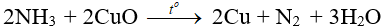
►►CLICK NGAY vào nút TẢI VỀ dưới đây để tải về [ĐÁP ÁN] Tính chất hóa học của NH3 là gì? file tải PDF hoàn toàn miễn phí!
Từ khóa » Tính Chất Bazo Của Nh3
-
Tính Chất Hóa Học Của NH3. Công Thức Và Ứng Dụng Của NH3
-
Tính Bazơ Của NH3 Là Do
-
Tính Bazơ Của NH 3 Do - Khóa Học
-
Tính Chất Hóa Học Của NH3 Là - I. Amoniac - TopLoigiai
-
Tính Chất Hóa Học Của NH3 Và Cấu Tạo Phân Tử Muối Amoni
-
Tính Chất Hoá Học, Cấu Tạo Phân Tử Của Amoniac NH3, Muối Amoni
-
NH3 Là Gì? Tính Chất, Nguồn Gốc, ứng Dụng, Cách điều Chế & Lư ý Khi ...
-
Tính Bazơ Của NH3 Do - HOC247
-
Amoniac (NH3) Là Gì? Cấu Tạo, Cách Điều Chế Và Ứng Dụng Của ...
-
Tính Chất Hóa Học Của NH3
-
Câu 4. Tính Bazơ Của NH3 Do :
-
Nh3 Có Tính Bazo Vì Sao - Mới Cập Nhập - Update Thôi
-
Amoniac Có Tính Chất Vật Lý Nào Sau đây? - Luật Hoàng Phi
-
Tính Chất Của Amoniac (NH3), Muối Amoni: Tính Chất Hóa Học, Vật Lí ...