NH3 Là Gì? Tính Chất, Nguồn Gốc, ứng Dụng, Cách điều Chế & Lư ý Khi ...
Có thể bạn quan tâm
Amoniac là gì? Amoniac có những tính chất hóa học, vật lý như thế nào? Trong tự nhiên Amoniac được hình thành như thế nào cũng như trong công nghiệp và phòng thí nghiệp nó được điều chế ra sao? Bạn đang thắc mắc liệu bên cạnh những ứng dụng vốn có thì NH3 có gây hại đến sức khỏe hay không, các biểu hiện như thế nào khi ta bị ngộ độc NH3 và cách xử lý nó như thế nào? Ngoài ra, NH3 sẽ được vận chuyển và bảo quản ra sao? Nơi nào mua NH3 uy tín nhất, …
Đó là hàng loạt những câu hỏi liên quan đến thuật ngữ NH3 này, Nếu bạn không biết về nó, thì hãy cứ yên tâm. Hôm nay Hóa Chất Trung Sơn sẽ cùng bạn tìm hiểu những điều xoay quanh chất hóa học thú vị này.
Chúng ta sẽ bắt đầu khởi động với khái niệm đơn giản nhất đó là Amoniac là gì?
AMONIAC LÀ GÌ ? CẤU TẠO PHÂN TỬ CỦA NH3
Amoniac bắt nguồn từ tiếng Pháp ammoniac và được phiên dịch ra tiếng việt là a-mô-ni-ắc. Đây là một hợp chất vô cơ có công thức phân tử là NH3. Amoniac là một hợp chất vô cơ được cấu tạo từ 3 nguyên tử nitơ và 1 nguyên tử hidro tạo thành liên kết kém bền.
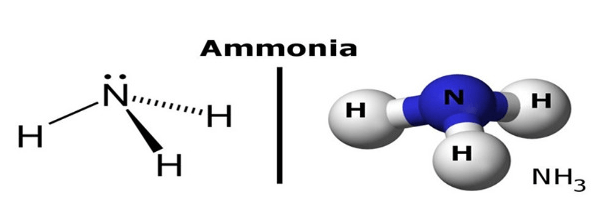
Theo như hình trên, Phân tử NH3 có cấu tạo hình chóp, với nguyên tử nitơ ở đỉnh liên kết cộng hóa trị với 3 nguyên tử hidro ở đáy tam giác. Do nitơ có ba electron độc thân nên có thể tạo 3 liên kết cộng hóa trị trên với hidro (Ba liên kết N – H đều là liên kết cộng hóa trị có phân cực: Ở N có dư điện tích âm, ở các nguyên tử H có dư điện tích dương).
CÁC TÍNH CHẤT CỦA NH3
Amoniac (NH3) cũng như nhiều hóa chất khác đều mang trong mình tính chất hóa học và cả tính chất vật lý. Dưới đây Trung Sơn sẽ cung cấp đến bạn đầy đủ cả 2 tính chất này.

Tính chất vật lý của Amoniac
- Amoniac thường tồn tại ở dạng khí, không màu, có mùi hôi khó chịu. Nồng độ Amoniac lớn có thể gây chết người.
- Amoniac có độ phân cực lớn do phân tử NH3 có cặp electron tự do và liên kết N–H bị phân cực. Do đó NH3 là chất dễ hoá lỏng.
- Dung dịch Amoniac là dung môi hoà tan tốt: NH3 hoà tan các dung môi hữu cơ dễ hơn nước do có hằng số điện môi nhỏ hơn nước. Kim loại kiềm và các kim loại Ca, Sr, Ba có thể hòa tan trong NH3 lỏng tạo dung dịch xanh thẫm.
Tính chất hóa học Amoniac
– Amoniac có tính khử
– Amoniac kém bền bởi nhiệt, nó có thể bị phân hủy ở nhiệt độ cao theo phản ứng hóa học:
- 2NH3 → N2 + 3H2 N2 + 3H2 → 2NH3
– Amoniac tác dụng với ion kim loại chuyển tiếp tạp ion phức:
- 2NH3 + Ag+ → [Ag(NH3)2]+
– Amoniac Nguyên tử hidro trong amoniac có thể bị thế bởi nguyên tử kim loại kiềm hoặc nhôm:
- 2NH3 + 2Na → 2NaNH2 + H2 (350 °C)
- 2NH3 + 2Al → 2AlN + 3H2 (800-900 °C)
– Amoniac tác dụng với dung dịch muối: Dung dịch amoniac có khả năng tạo kết tủa nhiều hidroxit kim loại khí tác dụng.
– Amoniac do tính bazơ nên dung dịch amoniac làm cho quỳ tím hóa xanh còn dung dịch phenolphlatein từ màu chuyển thành hồng. Do đó để phát hiện amoniac, người ta dùng quỳ tím ẩm để nhận biết.
– Amoniac tan trong nước
– Amoniac tác dụng với axit tạo thành muối amoni
Tham khảo thêm bài viết khác: Amoni Clorua Và Những Điều Thú Vị Về Hoá Chất Này
AMONIAC CÓ NGUỒN GỐC TỪ ĐÂU?
Amoniac cũng được sinh ra trong trong tự nhiên thông qua:
- Con người : Cơ quan thận cũng sản sinh ra một lượng nhỏ khí nh3, chính vì vậy mà nước tiểu thường có mùi khai đặc trưng của khí amoniac.
- Sinh vật : Được hình thành từ xác động vật hay thực vật sau một thời gian phân hủy dưới tác động của các vi sinh vật tạo thành khí nh3.
Amoniac còn được điều chế trong công nghiệp và phòng thí nghiệm. Cách điều chế sẽ được đề cập dưới đây.

 +
+Hóa chất Ammonia solution – Xilong
Tư vấn ngay- Thương hiệu: Xilong – Trung Quốc
- Công thức hóa học: NH3
- CAS: 1336-21-6
- Nhiệt độ nóng chảy: -57.5°C
- Nhiệt độ sôi: 37.7°C (1013 hPa)
- Khối lượng riêng: 0.88 g/cm3 (20 °C)
ĐIỀU CHẾ NH3 NHƯ THẾ NÀO ?
NH3 được điều chế theo 2 cách đó là:
Trong phòng thí nghiệm:
- 2NH4Cl + Ca(OH)2 → NH3 + CaCl2 + H2
Trong công nghiệp:
- CH4 + H2O < == > CO + 3H2 (xúc tác Ni, nhiệt độ cao)
- N2 + 3H2 < == > 2NH3 (ΔH = –92 kJ/mol)
ỨNG DỤNG CỦA NH3
Amoniac được dụng rộng rãi trong đời sống cũng như ứng dụng trong công nghiệp. Dưới đây sẽ là một vài ví dụ điển hình về ứng dụng của Amoniac

Phân bón
- Trên thực tế có đến khoảng 83% amoniac lỏng được dùng làm phân bón vì trong tất cả các hợp chất Nito đều có nguồn gốc từ NH3, rất cần thiết cho sự phát triển của cây trồng.
- Năm 2004, của amoniac được sử dụng như phân bón hoặc như là các muối của nó hoặc là giải pháp. Khi áp dụng cho đất, giúp cung cấp năng suất gia tăng của các loại cây trồng như ngô và lúa mì.
- Tiêu thụ nhiều hơn 1% của tất cả các năng lượng nhân tạo, sản xuất amoniac là một thành phần quan trọng của ngân sách năng lượng thế giới.
Dùng làm thuốc tẩy
- Amoniac được dùng trong hộ gia đình là dung dịch NH3 trong nước được sử dụng làm chất tẩy rửa cho nhiều bề mặt. Amoniac lỏng tạo ra ánh sáng rực rỡ.
- Trong đó, amoniac được dùng để làm sạch thủy tinh, đồ sứ và thép không gỉ, hay được sử dụng để làm sạch lò nướng và ngâm đồ để làm sạch bụi bặm…
Trong ngành dệt may
- Amoniac lỏng được sử dụng để điều trị nguyên liệu bông, cung cấp cho một tài sản kiềm bóng sử dụng chất kiềm. Đặc biệt, nó được sử dụng để rửa tiền len.
Xử lý môi trường khí thải
- Amoniac lỏng được sử dụng trong xử lý môi trường nhằm loại bỏ các chất như Nox, Sox trong các khí thải khí đốt các nguyên liệu hóa thạch như than, đá…
Là chất chống khuẩn trong thực phẩm
- Amoniac là một chất khử mạnh, Amoniac khan hiện được sử dụng với mục đích thương mại để giảm hoặc loại bỏ nhiễm khuẩn của thịt bò.
Trong công nghiệp chế biến gỗ
- Amoniac lỏng được sử dụng trong chế biến gỗ, làm cho màu sắc đậm hơn bởi khí Amoniac phản ứng với tự nhiên trong gỗ và làm thay đổi màu sắc đẹp hơn.
Sử dụng trong ngành công nghiệp dầu khí
- Sử dụng Amoniac trong trung hòa acid, thành phần của dầu thô và bảo vệ các thiết bị khỏi bị ăn mòn.
Trong ngành công nghiệp khai thác mỏ
- Amoniac được sử dụng để khai thác các kim loại như đồng niken và molypden từ quặng của họ.
Tìm hiểu thêm thông tin khác: NH4NO3 Là Gì? Và Những Điều Xung Quanh Hoá Chất NH4NO3
TÁC HẠI AMONIAC VÀ CÁCH XỬ LÝ
Tác hại của amoniac
Khí amoniac với nồng độ đậm đặc rất nguy hiểm đối với sức khỏe con người. Cụ thể:
- Hít phải: gây bỏng niêm mạc mũi, cổ họng và đường hô hấp. Điều này làm phá hủy đường thở dẫn đến suy hô hấp. Vì amoniac có tính ăn mòn.
- Tiếp xúc trực tiếp: da, mắt, họng, phổi có thể bị bỏng rất nặng. Những vết bỏng có thể gây mù vĩnh viễn, bệnh phổi, hoặc tử vong.
- Nuốt phải: Vô tình nuốt phải amoniac đậm đặc có thể bỏng ở miệng, cổ họng và dạ dày, đau dạ dày nghiêm trọng, gây nôn.
Xử lý khi ngộ độc amoniac
Amoniac nồng độ cao rất độc với con người tuy nhiên không phải ai cũng biết cách xử lý khi tiếp xúc và bị ngộ độc khí amoniac. Dưới đây là những cách sơ cứu khi bị ngộ độc amoniac:
- Khi hít phải khí amoniac nhanh chóng di chuyển nạn nhân đến nơi thoáng khí, cởi sạch quần áo dính amoniac.
- Súc sạch miệng với nước sạch trong trường hợp nuốt phải amoniac. Cho nạn nhân uống 1-2 cốc sữa.
- Tiếp xúc với dd amoniac thì rửa sạch amoniac dính trên da với xà phòng và nước, rửa mắt sạch với nhiều nước.
- Sau cùng là đưa nạn đến trạm y tế hoặc bệnh viện để cứu chữa.

 +
+Ammonia solution 25% – Merck – 105432
Tư vấn ngay- Thương hiệu: Merck – Mỹ
- Điểm sôi: 37,7 ° C (1013 hPa)
- Tỉ trọng: 0,903 g / cm3 (20 ° C)
- Giới hạn nổ: 15,4 – 33,6% (V)
- Độ nóng chảy: -57,5 ° C
- Áp suất hơi: 483 hPa (20 ° C)
CÁCH BẢO QUẢN VÀ VẬN CHUYỂN NH3 AN TOÀN
Cách bảo quản NH3 an toàn:
- Bảo quản NH3 trong các bồn lỏng hoặc bình chứa có ghi nhãn rõ ràng.
- Không nạp NH3 lỏng đầy quá 80% thể tích thiết bị chứa.
- Lưu trữ trong thùng kín. Lưu trữ tại nơi khô ráo, thoáng mát, riêng biệt và thông gió tốt, tránh xa nơi có thể gây cháy. Tránh nhiệt, độ ẩm và tránh các vật tương khắc.
Cách vận chuyển an toàn:
- Đối với NH3 công nghiệp được bán dưới dạng dung dịch amonia (thường là 28% NH3 trong nước) hoặc amonia lỏng thì nên chứa trong bồn lỏng vận chuyển bằng xe ô tô hoặc bình chứa.
- Phương tiện vận chuyển phải có mái che, thành xe chắc chắn.
- Không chở lẫn người và các vật liệu dễ cháy, bình được xếp ở tư thế đứng một lượt, giữa các bình phải có đệm lót, bốc xếp nhẹ nhàng, không để sản phẩm ở nơi có nhiệt độ cao.
CÁC BIỂU HIỆN CỦA VIỆC NGỘ ĐỘC AMONIAC
Ngộ độc xảy ra nếu hít, nuốt hoặc chạm vào các sản phẩm có chứa một lượng rất lớn các amoniac.
- Hô hấp: Ho, đau ngực (nặng), đau thắt ngực, khó thở, thở nhanh, thở khò khè.
- Mắt, miệng, họng: Chảy nước mắt và đốt mắt, mù mắt, đau họng nặng, đau miệng, môi sức.
- Tim mạch: Nhanh, mạch yếu, sốc.
- Thần kinh: Lẫn lộn, đi lại khó khăn, chóng mặt, thiếu sự phối hợp, bồn chồn, ngẩn ngơ dễ gây tử vong.
- Da: Môi xanh lợt màu, bỏng nặng nếu tiếp xúc lâu.
- Dạ dày và đường tiêu hóa: Đau dạ dày nghiệm trọng, nôn.
Tìm hiểu thông tin khác: Tổng Quan Những Điều Bạn Cần Biết Về Natri Benzoat
SẢN PHẨM CÙNG DANH MỤC

 +
+Hóa chất Ammonia solution – Xilong

 +
+Dung dịch Amoniac – NH4OH – 1.06073.026 – Sơn Đầu

 +
+Ammonia solution 25% – Merck – 105432
 +
+Dung dịch Ammonia 25% – Scharlau
Tư vấn ngayNƠI MUA AMONIAC UY TÍN VÀ CHẤT LƯỢNG
Vì nhu cầu sử dụng khá cao nên trên thị trường hiện nay có rất nhiều nơi cung cấp loại hóa chất này. Tiêu biểu ở khu vực TP Hồ Chí Minh đó là Hoá Chất Trung Sơn. Chúng tôi hiện hiện đang cung cấp AMONIAC với số lượng lớn và các loại hóa chất khác giá rẻ chất lượng. Cam kết đem đến cho bạn sự phục vụ trên cả tuyệt vời.
Nếu bạn có nhu cầu tìm mua AMONIAC thì đừng nên bỏ qua Trung Sơn của chúng tôi.
Sau khi đọc xong bài viết, có lẽ bạn đã tự trả lời được cho mình câu hỏi AMONIAC(NH3) là gì rồi đúng không nào? Dù có một số cảnh báo về mức độ nguy hiểm của Dung dịch nhưng chúng ta cũng không thể phủ nhập được hàng loạt nhưng công dụng của NH3 trong công nghiệp. Hãy liên hệ với Trung Sơn qua website hoặc qua những phương án khác mà chúng tôi thể hiện trên web này.
YÊU CẦU CỦA KHÁCH HÀNG
Từ khóa » Tính Chất Bazo Của Nh3
-
Tính Chất Hóa Học Của NH3. Công Thức Và Ứng Dụng Của NH3
-
Tính Bazơ Của NH3 Là Do
-
Tính Bazơ Của NH 3 Do - Khóa Học
-
Tính Chất Hóa Học Của NH3 Là - I. Amoniac - TopLoigiai
-
Tính Chất Hóa Học Của NH3 Và Cấu Tạo Phân Tử Muối Amoni
-
Tính Chất Hoá Học, Cấu Tạo Phân Tử Của Amoniac NH3, Muối Amoni
-
[ĐÁP ÁN] Tính Chất Hóa Học Cơ Bản Của NH3 Là Gì?
-
Tính Bazơ Của NH3 Do - HOC247
-
Amoniac (NH3) Là Gì? Cấu Tạo, Cách Điều Chế Và Ứng Dụng Của ...
-
Tính Chất Hóa Học Của NH3
-
Câu 4. Tính Bazơ Của NH3 Do :
-
Nh3 Có Tính Bazo Vì Sao - Mới Cập Nhập - Update Thôi
-
Amoniac Có Tính Chất Vật Lý Nào Sau đây? - Luật Hoàng Phi
-
Tính Chất Của Amoniac (NH3), Muối Amoni: Tính Chất Hóa Học, Vật Lí ...