Điều Chế Axit Piric? Axit Piric Có Nguy Hiểm Không Và Những Lưu ý Khi ...
Có thể bạn quan tâm
Axit Picric là một hợp chất hóa học dạng tinh thể màu vàng, có tính axit mạnh nhất của phenol. Tên của nó bắt nguồn từ tiếng Hy Lạp πικρος, nghĩa là đắng để diễn tả mùi vị của nó. Đây được xem là một chất nguy hiểm vì nó rất dễ phát nổ. Do đó các bạn cần nắm được tính chất và những lưu ý khi sử dụng để đảm bảo an toàn khi làm việc với axit piric.

Axit piric bắt nguồn từ tiếng Hy Lạp πικρος
Axit piric là gì?
- Axit Picric là một hợp chất hóa học có tính axit rất mạnh và tồn tại ở dạng tinh thể rắn màu vàng. Nó được đề cập đến lần đầu tiên năm 1742 trong một bản viết tay về giả kim thuật của Jonann Rudolf Glauber và được tạo ra bằng cách nitrat hóa một số chất như sừng động vật, lụa, cây chàm, nhựa tự nhiên.
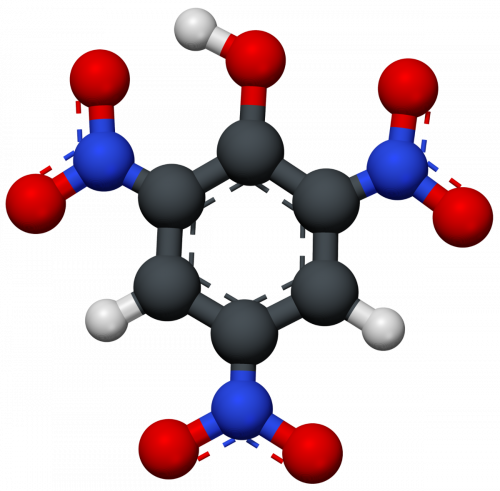
- Đến năm 1841, axit piric được tổng hợp từ phenol và có công thức hóa học là C6H3N3O7, công thức cấu tạo: C6H2(NO2)3OH.
- Cách gọi khác: Picric axit, Carbazotic axit, 2,4,6-trinitrophenol, Phenol trinitrate, Picronitric axit, Trinitrophenol, 2-Hydroxy-1,3,5-trinitrobenzene,…
Cấu trúc phân tử của axit piric
Cấu trúc phân tử của axit piric
Tính chất của axit piric
- Axit piric là hóa chất màu vàng kết tủa, không mùi nhưng có vị đắng.
- Độ tan trong nước: Tan vừa phải trong nước (12.7 g·L−1)
- Axit Picric có tính ăn mòn.
- Dễ phát nổ.
- Khối lượng mol: 229.10 g·mol−1.
- Khối lượng riêng: 1.763 g·cm−3.
- Điểm nóng chảy: 122,5 °C (395,6 K; 252,5 °F).
- Điểm sôi: > 300 °C (573 K; 572 °F) .
Điều chế Axit Picric
- Axit Picric có thể được điều chế bằng cách nitrate hóa phenol, benzene trong phản ứng Wolfenstein-Boters hoặc ngay cả axit acetylsalicylic (aspirin).
1. Điều chế axit piric từ Phenol
Cho Phenol phản ứng với dung dịch HNO3 đặc với chất xúc tác H2SO4 đặc tạo ra nước và axit picric.
C6H5OH + 3HNO3 → 3H2O + C6H2OH(NO2)3
2. Điều chế axit piric từ benzen
Chuỗi phản ứng điều chế axit piric như sau: Benzen -> brombenzen -> phenol -> axit picric.
C6H6 + Br2 -> C6H5Br + HBr (xúc tác FeBr3, nhiệt độ)
C6H5Br + NaOH -> C6H5OH + NaBr (xúc tác áp suất, nhiệt độ cao)
C6H5OH + HNO3 đặc bốc khói trong H2SO4 nóng –> C6H5(NO2)3(OH) + 3H2O
Một số lĩnh vực ứng dụng axit piric
1. Trong công nghiệp
- Axit picric được sử dụng như một chất nhạy cảm trong nhũ tương ngành công nghiệp nhiếp ảnh.
- Là một thành phần của thuốc trừ sâu, thuốc diệt cỏ, thuốc nhuộm …
- Được sử dụng để tổng hợp các hợp chất hóa học trung gian như chloropicrin và axit picramic.
- Vì khả năng dễ cháy nổ nên axit piric được sử dụng trong sản xuất diêm và pin.

Dùng trong sản xuất diêm và pin
- Axit piric ẩm được dùng trong việc nhuôm da hoặc đóng dấu tạm thời. Khi phản ứng với protein của da sẽ tạo ra màu nâu tối và có thể tồn tại trong khoảng một tháng.
2. Trong phòng thí nghiệm
- Dùng làm chất phản ứng để nhuộm mẫu vật như nhuộm Gram trong thao tác với kính hiển vi.
- Tạo muối kết tinh của bazơ hữu cơ (picrate) cho việc nhận dạng và xác định tính chất trong hóa hữu cơ.
- Đượ sử dụng trong một số thuốc thử để phân tích nồng độ glucose.
3. Trong quân sự
- Dùng trong sản xuất đạn dược, đạn, bom và mìn, vũ khí quân sự.

Dùng trong sản xuất đạn dược, đạn, bom và mìn
4. Trong y học
- Trong khoảng đầu thế kỷ 20, axit piric được dùng trong sản xuất dược phẩm như một chất diệt khuẩn, chữa bỏng, sốt rét, mụn dộp, mụn đậu mùa.
- Sử dụng axit picric để xác định nồng độ creatinine trong huyết thanh và nước tiểu.

Sử dụng axit picric để xác định nồng độ creatinine trong huyết thanh
- Axit picric phản ứng Jaffe tạo thành một hỗn hợp màu phức tạp có thể đo bằng quang phổ kế để phát hiện creatinine trong kiểm tra ma túy.
Mức độ nguy hiểm của axit piric
- Axit picric khan nguy hiểm bởi nó là một axít mạnh, phản ứng với các kim loại phổ biến (trừ nhôm) để tạo thành muối dễ phát nổ khi bị cọ xát. Do đó, bom, mìn và lựu đạn đều được mạ một lớp thiếc hoặc để ngăn không cho axit piric phản ứng với lớp vỏ bọc kim loại.
- Chỉ cần các kim loại va chạm nhẹ với axit picric thì muối picrat hình thành và điều này rất nguy hiểm.
- Axit picric đã bị dehydrat hóa đặc biệt nguy hiểm, nhất là khi chai chứa nó quá cũ và có nắp đậy bằng kim loại vì phản ứng tạo muối picrat xảy ra và phát nổ.
- Khi đựng axit piric bằng lọ nhựa và axit bên trong đã bị khô, một vài tinh thể có thể được hình thành trên miệng chai, gặp phải ma sát khi mở nắp có thể phát nổ. Cách xử lý trường hợp này là:
+ Mở chai trong một xô nước (có đá lạnh), để riêng chai cho nước vào bên trong nhằm hòa tan các tinh thể bám trên đó.
+ Chờ vài ngày đến khi thấy nước trong chai thì có thể mở ra. Nếu không yên tâm, hãy gọi chuyên gia về chất nổ.
Những lưu ý khi làm việc với axit piric
- Giữ axit piric ướt, không mở lọ chứa axit mới ra nếu chưa cần sử dụng. Sau khi đã mở ra hãy ghi lại ngày mở nắp để dễ kiểm tra vì mức độ hydrat hóa của axit này là 6 tháng. Khi cần thiết hãy thêm nước cất.
- Không sử dụng dụng cụ bằng sắt để lấy axit khỏi lọ.
- Sau khi lấy hóa chất, dùng khăn ướt lai lại miệng chai, đặc biệt là các ren xoắn ở cổ chai.
- Loại bỏ các chai axit piric cũ có nắp kim loại.
- Không nên giữ một lượng lớn axit picric trong phòng thí nghiệm vì rất nguy hiểm nếu chẳng may phát nổ. Đồng thời sau 2 năm sử dụng phải thay hóa chất mới.
- Khi làm việc với axit piric phải sử dụng tủ hút, tốt nhất hãy mua dung dịch 1% đã pha sẵn để dùng vào việc làm biến màu khi cần thiết.
- Cách xử lý axit piric an toàn: Khử axit bằng natri hydroxit và natri sulfit (Na2SO3). Sau đó thải bỏ theo quy trình, tuyệt đối không đổ xuống bồn rửa vì nó có thể phản ứng với ống dẫn nước thải bằng kim loại và phát nổ.
Trên đây là một số thông tin về axit piric mà LabVIETCHEM muốn chia sẻ đến bạn đọc. Hy vọng, qua đó các bạn đã biết cách điều chế và sử dụng axit piric an toàn, hiệu quả.
Từ khóa » Diều Chế Axit Picric
-
Axit Picric Là Gì? Cấu Tạo Phân Tử, Cách điều Chế & Sử Dụng, Bảo Quản
-
Axit Picric Là Gì? Điều Chế Và ứng Dụng Của Axit Picric - VietChem
-
[CHUẨN NHẤT] Phenol Ra Axit Picric? - Toploigiai
-
Acid Picric – Wikipedia Tiếng Việt
-
Điều Chế Và Ứng Dụng Của Axit Picric
-
Để điều Chế Axit Picric (2,4,6–trinitrophenol) Người Ta đi Từ ...
-
Axit Picric - Công Thức - Điều Chế - Ứng Dụng - Hanimexchem
-
Những ứng Dụng Quan Trọng Của Acid Picric Có Thể Bạn Chưa Biết
-
Axit Picric (2,4,6-trinitrophenol) được điều Chế Bằng Cách Cho ...
-
Để Diều Chế Axit Picric (2,4,6 – Trinitrophenol) Người Ta đi Từ 4,7 Ga
-
Để Diều Chế Axit Picric (2,4,6 – Trinitrophenol) Người Ta đi Từ 4,7 Gam ...
-
Để điều Chế Axit Picric (2,4,6–trinitrophenol) Người Ta đi ... - Khóa Học
-
Độ Nguy Hiểm Của Axit Picric Và Cách Phòng Tránh Rủi Ro