Dung Dịch H2SO4 Có Nồng độ 0,5M (D=1,2g/ml) - Hoc24
Có thể bạn quan tâm
HOC24
Lớp học Học bài Hỏi bài Giải bài tập Đề thi ĐGNL Tin tức Cuộc thi vui Khen thưởng- Tìm kiếm câu trả lời Tìm kiếm câu trả lời cho câu hỏi của bạn
Lớp học
- Lớp 12
- Lớp 11
- Lớp 10
- Lớp 9
- Lớp 8
- Lớp 7
- Lớp 6
- Lớp 5
- Lớp 4
- Lớp 3
- Lớp 2
- Lớp 1
Môn học
- Toán
- Vật lý
- Hóa học
- Sinh học
- Ngữ văn
- Tiếng anh
- Lịch sử
- Địa lý
- Tin học
- Công nghệ
- Giáo dục công dân
- Tiếng anh thí điểm
- Đạo đức
- Tự nhiên và xã hội
- Khoa học
- Lịch sử và Địa lý
- Tiếng việt
- Khoa học tự nhiên
- Hoạt động trải nghiệm
- Hoạt động trải nghiệm, hướng nghiệp
- Giáo dục kinh tế và pháp luật
Chủ đề / Chương
Bài học
HOC24
 Khách vãng lai Đăng nhập Đăng ký Khám phá Hỏi đáp Đề thi Tin tức Cuộc thi vui Khen thưởng
Khách vãng lai Đăng nhập Đăng ký Khám phá Hỏi đáp Đề thi Tin tức Cuộc thi vui Khen thưởng - Tất cả
- Toán
- Vật lý
- Hóa học
- Sinh học
- Ngữ văn
- Tiếng anh
- Lịch sử
- Địa lý
- Tin học
- Công nghệ
- Giáo dục công dân
- Tiếng anh thí điểm
- Hoạt động trải nghiệm, hướng nghiệp
- Giáo dục kinh tế và pháp luật
Câu hỏi
Hủy Xác nhận phù hợp Chọn lớp Tất cả Lớp 12 Lớp 11 Lớp 10 Lớp 9 Lớp 8 Lớp 7 Lớp 6 Lớp 5 Lớp 4 Lớp 3 Lớp 2 Lớp 1 Môn học Toán Vật lý Hóa học Sinh học Ngữ văn Tiếng anh Lịch sử Địa lý Tin học Công nghệ Giáo dục công dân Tiếng anh thí điểm Đạo đức Tự nhiên và xã hội Khoa học Lịch sử và Địa lý Tiếng việt Khoa học tự nhiên Hoạt động trải nghiệm Hoạt động trải nghiệm, hướng nghiệp Giáo dục kinh tế và pháp luật Mới nhất Mới nhất Chưa trả lời Câu hỏi hay Phong Vũ 31 tháng 8 2020 lúc 9:01
Phong Vũ 31 tháng 8 2020 lúc 9:01 Tính nồng độ % của: Dung dịch H2SO4 có nồng độ 0,5M (D=1,2g/ml)
Lớp 8 Hóa học CHƯƠNG III: MOL VÀ TÍNH TOÁN HÓA HỌC Những câu hỏi liên quan
- Mẫn Nhi
Hòa tan 6 gam Magie oxit vào 50 ml dung dịch H2SO4 (D=1,2g/ml) thì vừa đủ.
a) Tính khối lượng H2SO4 tham gia phản ứng.
b) Tính nồng độ % của dung dịch H2SO4.
c) Tính nồng độ % của dung dịch muối sau phản ứng.
Xem chi tiết Lớp 8 Hóa học Bài 42: Nồng độ dung dịch 1 0 Gửi Hủy
Gửi Hủy  Buddy
Buddy  21 tháng 4 2021 lúc 15:28
21 tháng 4 2021 lúc 15:28 a)nMgO=6:40=0,15(mol)
Ta có PTHH:
MgO+H2SO4->MgSO4H2O
0,15......0,15...........0,15..................(mol)
Theo PTHH:mH2SO4=0,15.98=14,7g
b)Ta có:mddH2SO4=D.V=1,2.50=60(g)
=>Nồng độ % dd H2SO4 là:
C%ddH2SO418\66.100%=27,27%
Đúng 2 Bình luận (0) Gửi Hủy
Gửi Hủy 
- Phạm Đình Nam
Tính nồng độ % của dung dịch H2SO4 2M(D= 1,2g/ml)
Xem chi tiết Lớp 9 Hóa học 1 0 Gửi Hủy
Gửi Hủy  hưng phúc
hưng phúc  19 tháng 10 2021 lúc 16:06
19 tháng 10 2021 lúc 16:06 Thiếu đề nhé.
Đúng 1 Bình luận (0) Gửi Hủy
Gửi Hủy 
- tram thai thinh
Hòa tan 6 gam Magie oxit vào 50 ml dung dịch H2SO4 (d=1,2g/ml) thì vừa đủ.
a) Viết phương trình phản ứng hóa học xảy ra?
b) Tính khối lượng H2SO4 tham gia phản ứng.
c) Tính nồng độ % của dung dịch H2SO4.
d) Tính nồng độ % của dung dịch muối sau phản ứng.
Xem chi tiết Lớp 8 Hóa học 1 0 Gửi Hủy
Gửi Hủy  Buddy
Buddy  29 tháng 3 2022 lúc 19:49
29 tháng 3 2022 lúc 19:49 a)nMgO=0,15(mol)
Ta có PTHH:
MgO+H2SO4->MgSO4+H2O
0,15......0,15...........0,15..................(mol)
Theo PTHH:mH2SO4=0,15.98=14,7g
b)Ta có:mddH2SO4=1,2.50=60(g)
=>Nồng độ % dd H2SO4là:
C%ddH2SO4=\(\dfrac{14,7}{60}100\)=24,5%
c)Theo PTHH:mMgSO4=0,15.120=18(g)
Khối lượng dd sau pư là:
mddsau=6+60=66(g)
Vậy nồng độ % dd sau pư là:
C%ddsau=\(\dfrac{18}{66}.100\)=27,27%
Đúng 2 Bình luận (0) Gửi Hủy
Gửi Hủy 
- Thùy Linh Mai
Cho 9,75 gam kẽm tác dụng vừa đủ với 500ml dd H2SO4 (D= 1,2g/ml).
a. Viết PTHH.
b. Tính khối lượng H2SO4 tham gia phản ứng.
c. Tính nồng độ phần trăm của dung dịch H2SO4.
d. Tính nồng độ phần trăm của dung dịch muối sau phản ứng.
Xem chi tiết Lớp 8 Hóa học 2 0 Gửi Hủy
Gửi Hủy  乇尺尺のレ
乇尺尺のレ  21 tháng 4 2023 lúc 20:20
21 tháng 4 2023 lúc 20:20 a)\(PTHH:Zn+H_2SO_4\xrightarrow[]{}ZnSO_4+H_2\)
b)Số mol của kẽm là:
\(n_{Zn}=\dfrac{9,75}{65}=0,15\left(mol\right)\)
\(PTHH:Zn+H_2SO_4\xrightarrow[]{}ZnSO_4+H_2\)
tỉ lệ : 1 1 1 1 (mol)
số mol : 0,15 0,15 0,15 0,15 (mol)
Khối lượng H2SO4 tham gia phản ứng là:
\(m_{H_2SO_4}=0,15.98=14,7\left(g\right)\)
c)Khối lượng của dung dịch H2SO4 là:
\(m_{ddH_2SO_4}=D.V_{dd}=500.1,2=600\left(g\right)\)
Nồng độ phần trăm của dung dịch H2SO4 là:
\(C_{\%H_2SO_4}=\dfrac{m_{H_2SO_4}}{m_{ddH_2SO_4}}.100\%=\dfrac{14,7}{600}.100\%=2,45\%\)
d) Khối lượng của khí H2 là:
\(m_{H_2}=0,15.2=0,3\left(g\right)\)
Khối lượng của ZnSO4 là:
\(m_{ZnSO_4}=0,15.161=24,15\left(g\right)\)
Khối lượng của dung dịch ZnSO4 là:
\(m_{ddZnSO_4}=9,75+600-0,3=609,45\left(g\right)\)
Nồng độ dung dịch của muối sau phản ứng là:
\(C_{\%ZnSO_4}=\dfrac{m_{ZnSO_{\text{4}}}}{m_{ddZnSO_4}}.100\%=\dfrac{24,15}{609,45}.100\%=3,9\%\)
Đúng 4 Bình luận (2) Gửi Hủy
Gửi Hủy  Nguyễn Ngọc Thiện Nhân
Nguyễn Ngọc Thiện Nhân  21 tháng 4 2023 lúc 20:38
21 tháng 4 2023 lúc 20:38 giỏi he
Đúng 1 Bình luận (1) Gửi Hủy
Gửi Hủy 
- Phuong Nguyen Minh
Hòa tan 6 gam dung dịch Magie oxit(MgO) vào 50ml dung dịch H2SO4 (có d=1,2g/ml) vừa đủ.
a. Tính khối lượng axit H2SO4 đã phản ứng.
b. Tính nồng độ % ủa dung dịch H2SO4 axit trên.
c. Tính nồng độ % của dung dịch muối sau phản ứng
Xem chi tiết Lớp 8 Hóa học Bài 42: Nồng độ dung dịch 1 2 Gửi Hủy
Gửi Hủy  Tài Nguyễn 16 tháng 6 2017 lúc 8:03
Tài Nguyễn 16 tháng 6 2017 lúc 8:03 a)\(n_{MgO}\)=6:40=0,15(mol)
Ta có PTHH:
MgO+\(H_2SO_4\)->MgS\(O_4\)+\(H_2O\)
0,15......0,15...........0,15..................(mol)
Theo PTHH:\(m_{H_2SO_4}\)=0,15.98=14,7g
b)Ta có:\(m_{ddH_2SO_4}\)=D.V=1,2.50=60(g)
=>Nồng độ % dd \(H_2SO_4\) là:
\(C_{\%ddH_2SO_4}\)=\(\dfrac{14,7}{60}\).100%=24,5%
c)Theo PTHH:\(m_{MgSO_4}\)=0,15.120=18(g)
Khối lượng dd sau pư là:
\(m_{ddsau}\)=\(m_{MgO}\)+\(m_{ddH_2SO_4}\)=6+60=66(g)
Vậy nồng độ % dd sau pư là:
\(C_{\%ddsau}\)=\(\dfrac{18}{66}\).100%=27,27%
Đúng 0 Bình luận (1) Gửi Hủy
Gửi Hủy 
- Trí Minh
Cho 32g NaOH vào nước được 400ml dd có khối lượng riêng D=1,2g/ml . Tính nồng độ mol và nồng độ phần trăm của dung dịch
Xem chi tiết Lớp 11 Toán Bài 3: Một số phương trình lượng giác thường gặp 2 0 Gửi Hủy
Gửi Hủy  Buddy
Buddy  10 tháng 9 2021 lúc 20:03
10 tháng 9 2021 lúc 20:03 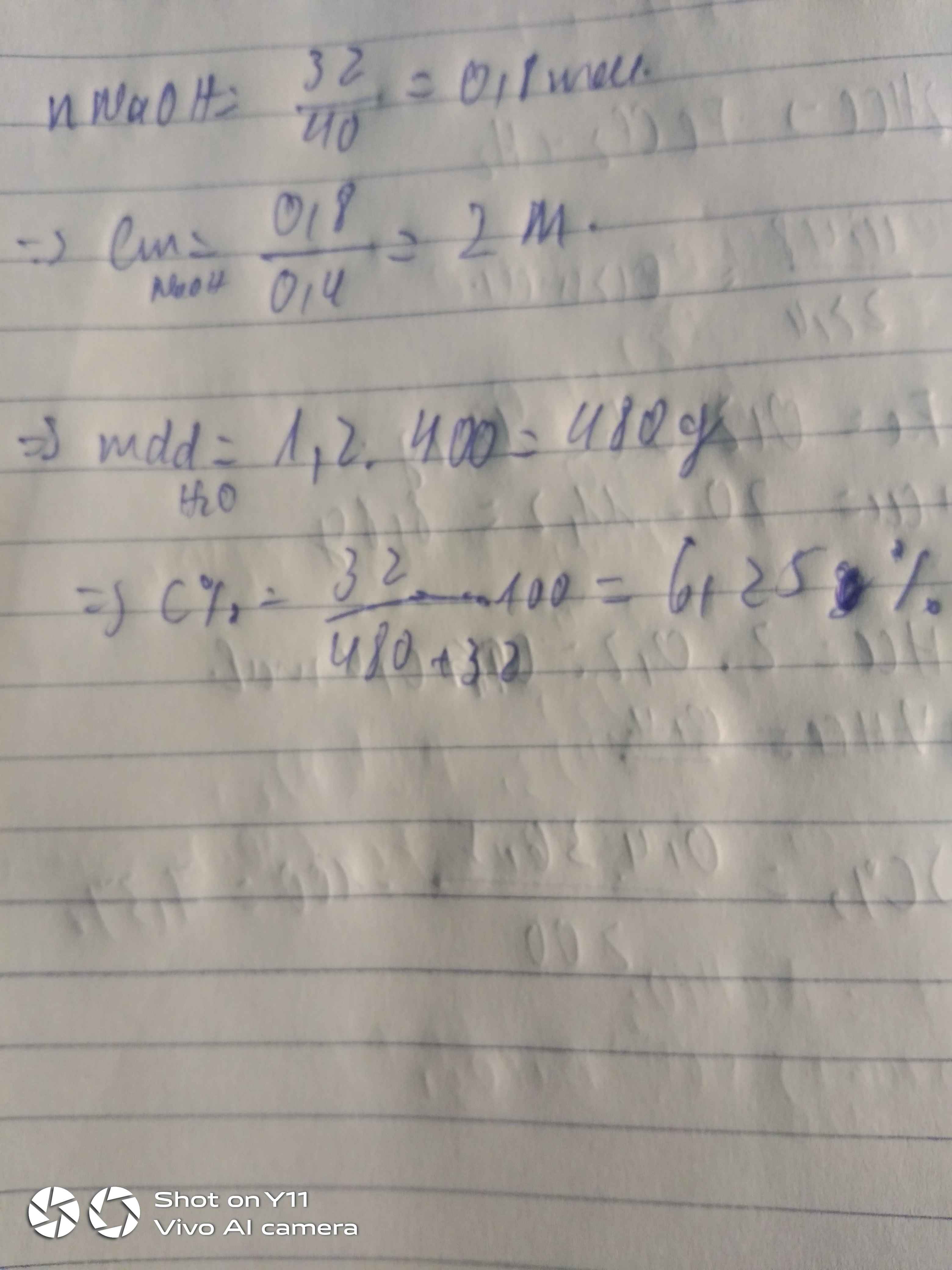
 Gửi Hủy
Gửi Hủy  Buddy
Buddy  10 tháng 9 2021 lúc 20:03
10 tháng 9 2021 lúc 20:03 Đây là.môn hoá nhé
Đúng 1 Bình luận (0) Gửi Hủy
Gửi Hủy 
- Hồ Vĩnh Phước
Trộn 200ml dd NaOH 1M vào 300 ml dd H2SO4 1,5M thu được dd D.a. Tính nồng độ mol/lít các chất trong dung dịch D.b. Tính thể tích dd Ca(OH)2 10% (d=1,2g/mL) để trung hoà dung dịch D.
Xem chi tiết Lớp 9 Hóa học 1 0 Gửi Hủy
Gửi Hủy  Gia Huy
Gia Huy  13 tháng 7 2023 lúc 18:45
13 tháng 7 2023 lúc 18:45 \(n_{NaOH}=0,2.1=0,2\left(mol\right)\\ n_{H_2SO_4}=0,3.1,5=0,45\left(mol\right)\)
\(2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\)
0,2------->0,1--------->0,1
Xét \(\dfrac{0,2}{2}< \dfrac{0,45}{1}\Rightarrow\) \(H_2SO_4\)dư
Trong dung dịch D có:
\(\left\{{}\begin{matrix}n_{H_2SO_4}=0,45-0,1=0,35\left(mol\right)\\n_{Na_2SO_4}=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}CM_{H_2SO_4}=\dfrac{0,35}{0,5}=0,7M\\CM_{Na_2SO_4}=\dfrac{0,1}{0,5}=0,2M\end{matrix}\right.\)
b
\(Ca\left(OH\right)_2+H_2SO_4\rightarrow CaSO_4+2H_2O\)
0,35<---------0,35
\(V_{Ca\left(OH\right)_2}=\dfrac{0,35.74}{1,2}=\dfrac{259}{12}\approx21,58\left(ml\right)\\ \Rightarrow V_{dd.Ca\left(OH\right)_2}=\dfrac{\dfrac{259}{12}.100\%}{10\%}=\dfrac{1295}{6}\approx215,83\left(ml\right)\)
Đúng 2 Bình luận (0) Gửi Hủy
Gửi Hủy 
- Nguyễn bảo châu
Tính nồng độ phần trăm của dung dịch sau khi pha 600ml dung dịch H3po4 2M(D=1,2g/mL) vào 200ml dung dịch h3po4 ( D=1,1 g/mL)
Xem chi tiết Lớp 9 Hóa học 2 0 Gửi Hủy
Gửi Hủy  Edogawa Conan
Edogawa Conan  13 tháng 9 2021 lúc 10:59
13 tháng 9 2021 lúc 10:59 \(n_{H_3PO_4}=0,6.2=1,2\left(mol\right)\Rightarrow m_{H_3PO_4}=1,2.98=117,6\left(g\right)\)
mdd sau khi pha = 600.1,2+200.1,1 = 940 (g)
\(C\%_{ddH_3PO_4}=\dfrac{117,6.100\%}{940}=12,51\%\)
Đúng 3 Bình luận (1) Gửi Hủy
Gửi Hủy  Nguyễn Trần Thành Đạt
Nguyễn Trần Thành Đạt  13 tháng 9 2021 lúc 10:59
13 tháng 9 2021 lúc 10:59 Cái 200ml dd H3PO4 có D=1,1g/ml thì cái đó có cho CM không? hay số mol gì đó
Đúng 2 Bình luận (1) Gửi Hủy
Gửi Hủy 
- Phan Bích
Hòa tan 5,85g NaCl vào 50g nước thu được sung dịch X (có d=1,2g/ml). Tính nồng độ phần trăm và nồng độ mol/l của dung dịch X.
cho mình xin lời giải chi tiết ạ.
Xem chi tiết Lớp 8 Hóa học Bài 42: Nồng độ dung dịch 0 0
 Gửi Hủy
Gửi Hủy Khoá học trên OLM (olm.vn)
- Toán lớp 8 (Kết nối tri thức với cuộc sống)
- Toán lớp 8 (Cánh Diều)
- Toán lớp 8 (Chân trời sáng tạo)
- Ngữ văn lớp 8 (Kết nối tri thức với cuộc sống)
- Ngữ văn lớp 8 (Cánh Diều)
- Ngữ văn lớp 8 (Chân trời sáng tạo)
- Tiếng Anh lớp 8 (i-Learn Smart World)
- Tiếng Anh lớp 8 (Global Success)
- Khoa học tự nhiên lớp 8 (Kết nối tri thức với cuộc sống)
- Khoa học tự nhiên lớp 8 (Cánh diều)
- Khoa học tự nhiên lớp 8 (Chân trời sáng tạo)
- Lịch sử và địa lý lớp 8 (Kết nối tri thức với cuộc sống)
- Lịch sử và địa lý lớp 8 (Cánh diều)
- Lịch sử và địa lý lớp 8 (Chân trời sáng tạo)
- Giáo dục công dân lớp 8 (Kết nối tri thức với cuộc sống)
- Giáo dục công dân lớp 8 (Cánh diều)
- Giáo dục công dân lớp 8 (Chân trời sáng tạo)
- Công nghệ lớp 8 (Kết nối tri thức với cuộc sống)
Từ khóa » Tính Nồng độ H2so4
-
Tính Nồng độ Phần Trăm Của Dung Dịch H2SO4 - Nguyễn Hoài Thương
-
Tính Nồng độ Phần Trăm Của Dd H2SO4 đã Dùng Và Nồng ... - HOC247
-
Tính Nồng độ Mol Của Dung Dịch H2SO4 Và Dung Dịch NaOH Biết: +) 3
-
Để Tính Nồng độ Phần Trăm Của Dung Dịch H2SO4, Người Ta Làm Thế N
-
Tính Nồng độ Phần Trăm Của Dung Dịch H2SO4 2M - Blog Của Thư
-
Tính Nồng độ Mol Của Dung Dịch H2SO4 - Vietjack.online
-
Tính Nồng độ Mol Của Dung Dịch H2SO4, Biết Rằng để Pha Một Dung ...
-
Tính Nồng độ Phần Trăm Của Một Dung Dịch H2SO4 Loãng Nếu Biết ...
-
2. Tính Nồng độ Mol Ban đầu Của Dung Dịch H2SO4 ... - MTrend
-
A, Tính Nồng độ Mol Của Dung Dịch NaOH 20% (D = 1,2 G ...
-
Nồng độ Mol/l Của Dung Dịch H2SO4 Có PH = 2 Là - Tự Học 365
-
Có Dung Dịch H2SO4 Với PH=10 Tính Nồng độ Mol/l Của Dung Dịc
-
Tính Nồng độ Phần Trăm Của Dung Dịch H2SO4 Sau Khi Pha Loãng
-
Một Dung Dịch H2SO4 Có Nồng độ Mol/l Của Ion H+ Là 0,01M. Tính ...