Etilen Là Gì? Điều Chế Etilen (c2h4) Và ứng Dụng - LabVIETCHEM
Etilen chắc không còn là cái tên xa lạ với chúng ta bởi nó xuất hiện rất nhiều trong cuộc sống hàng ngày, từ bộ môn Hóa học đến thực tiễn, đặc biệt là ngành nông nghiệp với ứng dụng kích thích quả chín nhanh và đều. Vậy Etilen là gì và được ứng dụng ra sao. Cùng chúng tôi đi tìm câu trả lời trong nội dung bài viết dưới đây nhé.
Mục lục- Etilen là gì?
- Etilen có ở đâu?
- Tính chất đặc trưng của Etilen
-
- 1. Tính chất vật lí
- 2. Tính chất hóa học
- Cách điều chế Etilen
- Các ứng dụng của Etilen
- 1. Trong nông nghiệp
- 2. Trong công nghiệp
- Cơ chế tác dụng của Etilen
- Mức độ nguy hiểm của khí Etilen
Etilen là gì?
Etilen (tên IUPAC là ethene) là một chất khí không màu, không mùi và hơi nhẹ hơn không khí. Đồng thời, nó là một trong các loại hidrocacbon và là một anken (alkene) đơn giản nhất với công thức hóa học là C2H4 hoặc CH2=CH2.
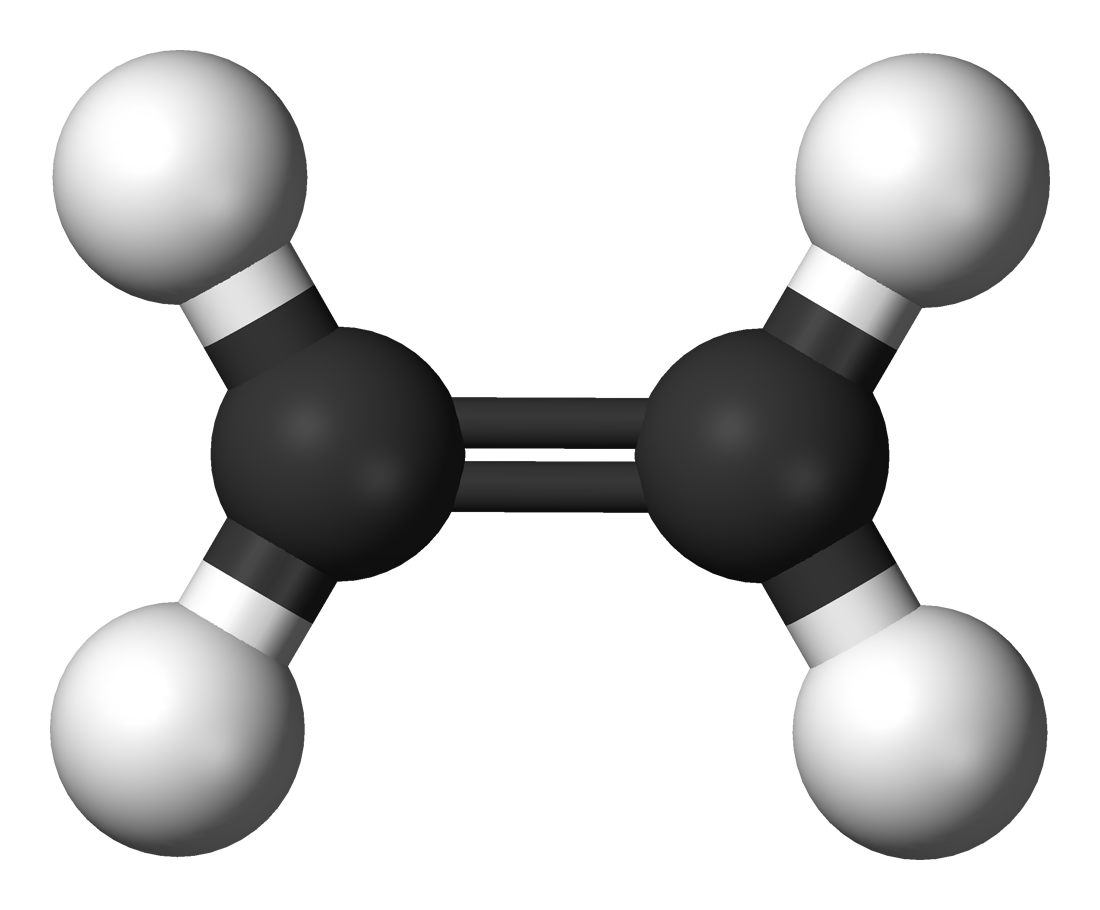
Cấu trúc phân tử của Etilen
Trong phân tử Etilen có một liên kết đôi giữa hai nguyên tử cacbon, bao gồm một liên kết kém bền, dễ dàng đứt gãy khi tiến hành phản ứng hóa học.
Etilen có ở đâu?
Nó được con người phát hiện lần đầu tiên vào năm 1917 và là một trong những chất khí sinh học đầu tiên mà con người biết đến, cũng chính là loại khí Olefin đơn giản nhất.
Bằng cách sử dụng các máy đo cực nhạy và các máy sắc ký khí, người ta đã xác định được rằng, khí Etilen không chỉ được sinh ra ở trái cây khi chín mà nó còn được sinh ra khi hạt đang nảy mầm, hoa nở hoặc lúc lá già đi… Chính vì vậy mà Etilen rất gần gũi với đời sống của con người.
Tính chất đặc trưng của Etilen
Etilen có những tính chất nào?
1. Tính chất vật lí
- Là chất khí không màu, không mùi, nhẹ hơn không khí.
- Khả năng hòa tan: Ít tan trong nước, 25 ml/100 ml (0 °C) và 12 ml/100 ml (25 °C).
- Nhiệt độ nóng chảy: -169,1 °C
- Nhiệt độ sôi: -103,7 °C
2. Tính chất hóa học
- Tác dụng với oxi:
Đốt cháy trong oxy tạo thành khí CO2 và H2O. Phản ứng tỏa nhiều nhiệt.
C2H4 + 3O2 → 2CO2 + 2H2O + Q
- Tác dụng với thuốc tím
3C2H4 + 2KMnO4 + 4H2O → 3C2H4(OH)2 + 2KOH + 2MnO2
- Phản ứng với khí clo, brom
Ở nhiệt độ cao, Etilen tham gia phản ứng thế nguyên tử H của liên kết đôi:
CH2=CH2 + Cl2 → CH2=CHCl + HCl
- Tác dụng với dung dịch brom
Làm mất màu dung dịch brom: CH2=CH2 + Br2 → Br – CH2- CH2 – Br
- Tham gia phản ứng cộng
Vì có các chất liên kết đôi nên etilen dễ tham gia phản ứng cộng vơi Halogen, hydro và axit.
C2H4 +Br2 → C2H4Br2
C2H4 +H2 → C2H6
C2H4 + HBr → C2H5Br
- Tham gia phản ứng trùng hợp
Với điều kiện nhiệt độ, phân tử etilen kết hợp với nhau tạo ra chất có phân tử lượng rất lớn gọi là PolyEtiten hay PE. Phương trình phản ứng.
….+ CH2=CH2 + CH2=CH2 +….→ ….- CH2– CH2 – CH2– CH2 -….
Cách điều chế Etilen
Trong công nghiệp, Etilen được sản xuất bằng bằng phản ứng cracking hoặc tách hydro từ ankan tương ứng.
Trong phòng thí nghiệm, Etilen được điều chế bằng phương pháp đun nóng etanol với axit sulfuric đậm đặc. CH3CH2OH → CH2=CH2 + H2O (H2SO4, to)
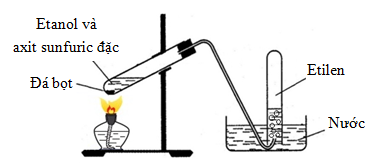
Điều chế Etilen trong phòng thí nghiệm
Các ứng dụng của Etilen
1. Trong nông nghiệp
- Khí Etilen kích thích tăng sinh trưởng của các tế bào thực vật, thúc đẩy quá trình ra hoa, làm chín quả và kích thích sự nảy mầm ở khoai tây, các loại hạt. So với các phương pháp giấm quả khác như sử dụng đất đèn thì Etilen kích thích trái cây nhanh chín hơn, đồng thời, độ chín cũng đều hơn.

Etilen giúp trái cây chín đều màu
- Tăng hiệu quả và chất lượng cho quá trình thu hoạch các loại cây lấy mủ như cao su, thông,…

Tăng hiệu quả quá trình lấy mủ cao su
2. Trong công nghiệp
- Dùng trong sản xuất bao bì, điện tử, dệt may
- Vận chuyển
- Nguyên liệu tạo ra chất phủ, chất kết dính
- Nguyên liệu trong sản xuất vật liệu xây dựng
- Tham gia nhiều phản ứng để sản xuất hóa chất
- Ứng dụng vào ngành hóa dầu, dẫn xuất
Cơ chế tác dụng của Etilen

Cơ chế làm chín trái cây của etilen
Etilen kích thích sự chín của trái cây bằng cách tăng tính thấm của màng trong các tế bào thịt quả, khiến cho các enzym vốn tách rời khỏi cơ chất do màng ngăn cách được giải phóng và có điều kiện tiếp xúc dễ dàng, gây nên những phản ứng có liên quan đến sự chín. Ngoài ra, Etilen cũng ảnh hưởng hoạt hóa lên sự tổng hợp mới các enzym, gây ra những biến đổi trong quá trình chín.
Với trường hợp kích thích sự rụng lá, có thể là do Etilen kích thích sự tổng hợp xenluloza phân hủy tế bào trong các tầng rời.
Mức độ nguy hiểm của khí Etilen
- Khí Etilen hoàn toàn không độc nếu con người hít vào nhưng nếu ở trong môi trường chật hẹp và có quá nhiều khí C2H4 thì sẽ bị ngạt thở do thiếu oxy. Nạn nhân sẽ dần dần bị mất nhận thức, hôn mê, ngạt thở, thậm chí tử vong. Vì Etilen là một chất không màu không mùi nên rất khó phát hiện nó có đang tích tụ trong phòng kín hay không.
- Tiếp xúc với C2H4 ở dạng lỏng mà không mang đồ bảo hộ, nạn nhân sẽ bị gây tê và các mô phơi nhiễm sẽ bị đông cứng.
- Nếu để khí Etilen lọt vào khu vực có lửa, cháy nổ rất dễ xảy ra do nó là khí dễ bắt cháy.
Trên đây là một số thông tin về khí Etilen là gì, cách điều chế và ứng dụng thực tế của Etilen. Hy vọng rằng, đây sẽ là những kiến thức bổ ích mà LabVIETCHEM có thể chia sẻ đến bạn đọc.
Xem thêm:
- Propylene Glycol - Tính chất, phương pháp sản xuất và ứng dụng trong cuộc sống
- Băng cháy là gì? Triển vọng khai thác và sử dụng nguồn năng lượng của băng cháy
Từ khóa » Cách đọc C2h4
-
Công Thức Cấu Tạo Của Etilen C2H4. Tính Chất Hoá ... - Soạn Bài Tập
-
Công Thức Cấu Tạo Của C 2 H 4 Và Gọi Tên
-
Công Thức Cấu Tạo Của C 2 H 4 Và Gọi Tên - Haylamdo
-
Công Thức Cấu Tạo Của C2H4 Và Gọi Tên
-
Etilen Là Gì? Công Thức, Tính Chất Hóa Học Của Etilen C2H4 - VietChem
-
Etilen C2H4 Cấu Tạo Phân Tử Tính Chất Hoá Học Của Etilen Và Bài Tập
-
Etilen Là Gì? Tính Chất Hóa Học Và ứng Dụng Etilen Như Thế Nào?
-
Etilen: Định Nghĩa, Cấu Tạo, Tính Chất, điều Chế Và ứng Dụng - Monkey
-
Cấu Tạo Phân Tử, Tính Chất Vật Lý Và Hóa Học Của Etilen (C2H4)
-
Etilen C2H4 Cấu Tạo Phân Tử Tính Chất Hoá Học Của Etilen Và Bài Tập
-
Etilen C2H4 Cấu Tạo Phân Tử Tính Chất Hoá Học Của Etilen Và Bài Tập
-
Etilen C2H4 Cấu Tạo Phân Tử Tính Chất Hoá Học Của Etilen Và Bài Tập
-
Etilen Là Gì? Công Thức, Tính Chất Hóa Học Của Etilen C2H4
-
Thông Tin Cụ Thể Về C2H4(OH)2 (etlilen Glicol) - Chất Hóa Học