Gân – Wikipedia Tiếng Việt
| Gân | |
|---|---|
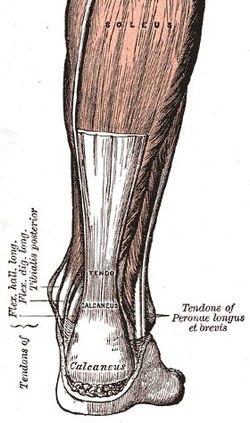 Gân gót, một trong những gân trong cơ thể con người Gân gót, một trong những gân trong cơ thể con người | |
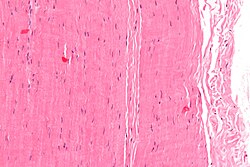 Ảnh hiển vi của một miếng gân; nhuộm H&E Ảnh hiển vi của một miếng gân; nhuộm H&E | |
| Chi tiết | |
| Định danh | |
| Latinh | tendo |
| MeSH | D013710 |
| TH | TH {{{2}}}.html HH3.03.00.0.00020 .{{{2}}}.{{{3}}} |
| FMA | 9721 |
| Thuật ngữ giải phẫu[Chỉnh sửa cơ sở dữ liệu Wikidata] | |
Gân là một dải cứng của mô liên kết sợi thường kết nối cơ với xương và có khả năng chịu đựng lực căng.
Gân tương tự như dây chằng; cả hai đều được tạo thành từ collagen. Dây chằng nối một xương với một xương khác, trong khi gân kết nối cơ với xương để hoạt động hài hòa của cơ thể. Ngoài ra cũng có một cấu trúc khác tương tự như gân và dây chằng là băng cơ, còn gọi là bao mô cơ. Băng cơ nối một cơ với một cơ khác.
Kết cấu
[sửa | sửa mã nguồn]Về mặt mô học, gân bao gồm các mô liên kết dày đặc thường được bọc trong các lớp mô liên kết dày đặc bất thường. Bộ gân khỏe mạnh bình thường bao gồm chủ yếu là các mảng collagen song song được đóng chặt chẽ với nhau. Chúng được neo vào xương bằng sợi Sharpey. Khối lượng khô của các gân bình thường, chiếm khoảng 30% tổng khối lượng của chúng, bao gồm khoảng 86% collagen, 2% elastin, 1-5% proteoglycan và 0,2% các thành phần vô cơ như đồng, mangan và calci.[1][2] Phần collagen được tạo thành từ 97-98% collagen loại I, với một lượng nhỏ các loại collagen khác. Chúng bao gồm collagen loại II trong vùng sụn, collagen loại III trong các sợi reticulin của thành mạch, collagen loại IX, collagen loại IV trong màng nền của các mao mạch, collagen loại V trong thành mạch máu và collagen loại X trong các xơ sụn hóa khoáng gần giao diện với xương.[1][3]
Sợi collagen coalesce vào macroaggregates. Sau khi tiết ra từ tế bào, được phân tách bởi procollagen N- và C-proteinases, và các phân tử tropocollagen tự động tập hợp thành các sợi không hòa tan. Một phân tử collagen dài khoảng 300 nm và rộng 1-2 nm, và đường kính của các sợi được hình thành có thể nằm trong khoảng từ 50 đến 500 nm. Trong gân, các sợi sau đó lắp ráp thêm để tạo thành các lớp fascicles, dài khoảng 10 mm với đường kính từ 50–300 μm, và cuối cùng thành sợi gân có đường kính từ 100–500 µm.[4] Fascicles bị ràng buộc bởi endotendineum, đó là một mô liên kết lỏng tinh có chứa các sợi collagen mỏng[5][6] và sợi đàn hồi.[7] Các nhóm fascicles được giới hạn bởi các epitenon. Chèn vào các khoảng gian bào trong màng cơ nơi dây chằng được đặt là paratenon một mô liên kết lỏng.[8]
Collagen trong gân được tổ chức cùng với các thành phần proteoglycan bao gồm decorin và, trong các vùng bị nén của gân, aggrecan, có khả năng liên kết với các sợi collagen ở những vị trí cụ thể.[9] Các proteoglycans được đan xen với các sợi collagen - các chuỗi bên glycosaminoglycan (GAG) của chúng có nhiều tương tác với bề mặt của các sợi - cho thấy rằng các proteoglycans có cấu trúc quan trọng trong sự kết nối của các sợi nhỏ.[10] Các thành phần GAG chính của gân là dermatan sulfat và chondroitin sulfat, liên kết với collagen và tham gia vào quá trình lắp ráp sợi nhỏ trong quá trình phát triển gân. Dermatan sulfat được cho là có trách nhiệm hình thành các mối liên hệ giữa các sợi, trong khi chondroitin sulfat được cho là có liên quan nhiều hơn đến việc chiếm khối lượng giữa các sợi để giữ chúng tách biệt và giúp chống lại biến dạng.[11] Các chuỗi bên datatan sulfat của decorin tổng hợp trong dung dịch, và hành vi này có thể hỗ trợ với việc lắp ráp các sợi collagen. Khi các phân tử decorin liên kết với một sợi collagen, các chuỗi sulfate dermata của chúng có thể mở rộng và liên kết với các chuỗi sulfat dermatan khác trên decorin, gắn với các sợi nhỏ, do đó tạo ra các cây cầu xen kẽ và cuối cùng gây ra sự liên kết song song của các sợi.[12]
Các tế bào tenocytes tạo ra các phân tử collagen, tổng hợp từ đầu đến cuối và từ bên này sang bên kia để tạo ra các sợi collagen. Các bó sợi được tổ chức để tạo thành các sợi với các tế bào tenon kéo dài được đóng gói chặt chẽ giữa chúng. Có một mạng lưới ba chiều của các quá trình tế bào liên kết với collagen trong gân. Các tế bào giao tiếp với nhau thông qua các điểm ngắt quãng, và tín hiệu này cho chúng khả năng phát hiện và phản ứng với tải cơ học.[13]
Các mạch máu có thể được hình dung trong gân endo chạy song song với các sợi collagen, với sự phân hủy ngang không thường xuyên.
Phần lớn gân bên trong được cho là không chứa các sợi thần kinh, nhưng epitenon và paratenon chứa các dây thần kinh, trong khi các cơ quan gân Golgi có mặt ở đường giao giữa gân và cơ.
Chiều dài gân thay đổi trong tất cả các nhóm chính và từ người này với người khác. Chiều dài gân, trên thực tế, yếu tố quyết định là về kích thước cơ bắp thực tế và tiềm năng. Ví dụ, tất cả các yếu tố sinh học có liên quan khác bằng nhau, một người có gân ngắn hơn và cơ bắp bắp tay dài hơn sẽ có tiềm năng lớn hơn về khối lượng cơ hơn một người có gân dài hơn và cơ ngắn hơn. Các vận động viên thể hình thành công nói chung sẽ có gân ngắn hơn. Ngược lại, trong các môn thể thao đòi hỏi vận động viên phải vượt trội trong các hành động như chạy hoặc nhảy, có lợi hơn là có gân Achilles dài hơn và cơ bắp chân ngắn hơn.[14]
Chiều dài gân được xác định bởi khuynh hướng di truyền, và không được chứng minh là tăng hoặc giảm phản ứng với môi trường, không giống như cơ bắp, có thể bị rút ngắn do chấn thương, mất cân bằng và thiếu hồi phục và kéo dài.[15]
Chức năng
[sửa | sửa mã nguồn]
Theo thông lệ, gân đã được coi là một cơ chế mà cơ bắp kết nối với xương cũng như cơ bắp, hoạt động để truyền lực. Kết nối này cho phép các dây chằng điều chỉnh lực thụ động trong quá trình vận động, cung cấp sự ổn định bổ sung mà không có công việc hoạt động. Tuy nhiên, trong hai thập kỷ qua, nhiều nghiên cứu tập trung vào tính chất đàn hồi của một số gân và khả năng hoạt động của chúng như lò xo. Không phải tất cả các sợi buộc đều được yêu cầu để thực hiện vai trò chức năng tương tự, với một số chân tay định vị chủ yếu, chẳng hạn như các ngón tay khi viết (gân vị trí) và những người khác hoạt động như lò xo để làm cho vận động hiệu quả hơn (sợi lưu trữ năng lượng).[16] Năng lượng lưu trữ gân có thể lưu trữ và phục hồi năng lượng ở hiệu quả cao. Ví dụ, trong một bước đi của con người, gân Achilles trải dài như khớp cánh chân khớp. Trong phần cuối cùng của sải chân, khi chân cây bị uốn cong (chỉ các ngón chân xuống), năng lượng đàn hồi được lưu trữ được giải phóng. Hơn nữa, bởi vì gân trải dài, cơ có thể hoạt động với ít hoặc thậm chí [[Co cơ|không có thay đổi về chiều dài]], cho phép cơ tạo ra lực lớn hơn.
Các tính chất cơ học của gân phụ thuộc vào đường kính và hướng của sợi collagen. Các sợi collagen là song song với nhau và đóng chặt chẽ, nhưng cho thấy một làn sóng giống như xuất hiện do uốn lượn phẳng, hoặc xếp nếp, trên quy mô của một vài micromet.[17] Trong gân, các sợi collagen có một số tính linh hoạt do thiếu hydroxyproline và dư lượng proline tại các vị trí cụ thể trong trình tự amino acid, cho phép hình thành các sự phù hợp khác như uốn cong hoặc vòng trong xoắn ba và dẫn đến sự phát triển của lắn xếp nếp.[18] Những sợi nhỏ trong các sợi collagen cho phép các dây chằng có độ dẻo dai cũng như độ cứng nén thấp. Ngoài ra, bởi vì gân là một cấu trúc đa sợi được tạo thành từ nhiều sợi nhỏ và fascicles độc lập một phần, nó không hoạt động như một thanh duy nhất, và tính chất này cũng góp phần vào tính linh hoạt của nó.[19]
Các thành phần proteoglycan của gân cũng quan trọng đối với các tính chất cơ học. Trong khi các sợi collagen cho phép các dây chằng chống lại ứng suất kéo, các proteoglycans cho phép chúng chống lại ứng suất nén. Các phân tử này rất ưa nước, có nghĩa là chúng có thể hấp thụ một lượng lớn nước và do đó có tỷ lệ sưng cao. Vì chúng không liên kết với các sợi nhỏ, chúng có thể liên kết ngược lại và tách rời nhau để các cầu nối giữa các sợi nhỏ có thể bị phá vỡ và cải cách. Quá trình này có thể liên quan đến việc cho phép sợi fibril kéo dài và giảm đường kính dưới sự căng.[20] Tuy nhiên, các proteoglycans cũng có thể có vai trò trong tính chất kéo của gân. Cấu trúc của gân có hiệu quả là một vật liệu sợi tổng hợp, được xây dựng như một loạt các cấp độ phân cấp. Ở mỗi cấp của hệ thống phân cấp, các đơn vị collagen được liên kết với nhau bởi các liên kết collagen hoặc các proteoglycan, để tạo ra một cấu trúc có khả năng chống chịu tải trọng cao.[21] Độ giãn dài và sự căng thẳng của các sợi collagen một mình đã được chứng minh là thấp hơn nhiều so với tổng độ giãn dài và căng thẳng của toàn bộ gân dưới cùng một mức độ căng, chứng minh rằng ma trận giàu proteoglycan cũng phải trải qua biến dạng, và làm cứng của ma trận xảy ra ở tốc độ biến dạng cao.[22] Biến dạng của ma trận không collagen này xảy ra ở tất cả các cấp của hệ thống phân cấp gân, và bằng cách điều chỉnh tổ chức và cấu trúc của ma trận này, các đặc tính cơ học khác nhau theo yêu cầu của các gân khác nhau có thể đạt được.[23] Năng lượng lưu trữ gân đã được hiển thị để sử dụng số lượng đáng kể trượt giữa fascicles để cho phép các đặc tính căng cao mà chúng yêu cầu, trong khi gân vị trí dựa nhiều hơn vào trượt giữa sợi collagen và sợi.[24] Tuy nhiên, các dữ liệu gần đây cho thấy rằng các gân lưu trữ năng lượng cũng có thể chứa các hạt xoắn bị xoắn hoặc xoắn ốc - một sự sắp xếp có lợi cho việc cung cấp hành vi giống như lò xo cần thiết trong các gân này.[25]
Cơ học
[sửa | sửa mã nguồn]Bó gân có cấu trúc nhớt đàn hồi, có nghĩa là chúng thể hiện cả hai hành vi đàn hồi và nhớt. Khi kéo dài, gân biểu hiện hành vi "mô mềm" điển hình. Đường cong lực kéo giãn hoặc căng thẳng bắt đầu với một vùng có độ cứng rất thấp, khi cấu trúc uốn thẳng và các sợi collagen sắp xếp cho thấy tỷ lệ Poisson âm trong các sợi của gân.[26] Gần đây hơn, các xét nghiệm được thực hiện trong cơ thể (qua MRI) và ex vivo (thông qua thử nghiệm cơ học của các mô gân khác nhau) đã chỉ ra rằng gân khỏe mạnh có tính dị hướng cao và biểu hiện tỷ lệ Poisson âm (auxetic) trong một số mặt phẳng khi kéo dài đến 2 % dọc theo chiều dài của chúng, tức là trong phạm vi chuyển động bình thường của chúng.[27] Sau khu vực 'chân' này, cấu trúc trở nên cứng hơn đáng kể và có đường cong ứng suất tuyến tính cho đến khi nó bắt đầu thất bại. Các tính chất cơ học của gân rất khác nhau, vì chúng phù hợp với các yêu cầu chức năng của dây chằng. Các gân chứa năng lượng có xu hướng đàn hồi hơn, hoặc ít cứng hơn, vì vậy chúng có thể dễ dàng lưu trữ năng lượng hơn, trong khi các gân định vị cứng hơn có khuynh hướng dẻo hơn và ít co giãn hơn, do đó chúng có thể điều khiển chuyển động tốt hơn. Một gân lưu trữ năng lượng điển hình sẽ thất bại trong khoảng 12-15% căng thẳng, và một sự căng thẳng trong khu vực 100-150 MPa, mặc dù một số gân đáng chú ý là có thể mở rộng hơn điều này, ví dụ như kỹ thuật uốn cong trên con ngựa, trải dài trong vượt quá 20% khi phi nước đại.[28] Các gân có thể thất bại ở các chủng thấp tới 6-8%, nhưng có thể có giá trị tuyệt đối trong khoảng 700-1000 MPa.[29]
Một số nghiên cứu đã chứng minh rằng gân phản ứng với những thay đổi trong tải cơ học với quá trình tăng trưởng và tu sửa, giống như xương. Đặc biệt, một nghiên cứu cho thấy rằng việc sử dụng gân Achilles ở chuột làm giảm độ dày trung bình của các bó sợi collagen bao gồm gân. Ở người, một thí nghiệm trong đó mọi người phải chịu một môi trường vi mô mô phỏng đã thấy rằng độ cứng gân giảm đáng kể, ngay cả khi các đối tượng được yêu cầu thực hiện các bài tập hồi sức.[30] Những tác động này có ý nghĩa trong các lĩnh vực khác nhau, từ điều trị bệnh nhân nằm liệt giường đến việc thiết kế các bài tập hiệu quả hơn cho các phi hành gia.
Chữa bệnh
[sửa | sửa mã nguồn]Xã hội và văn hoá
[sửa | sửa mã nguồn]Gân được sử dụng rộng rãi trong suốt thời kỳ tiền công nghiệp như một loại sợi bền và bền. Một số công dụng cụ thể bao gồm việc sử dụng gân làm chỉ khâu, gắn lông vũ vào mũi tên, lưỡi dao để trục, vv. cấu trúc sống. Gân phải được xử lý theo những cách cụ thể để hoạt động hữu ích cho những mục đích này. Người Inuit và những người lưỡng cực khác đã sử dụng gân làm chất độn duy nhất cho tất cả các mục đích trong nước do thiếu các nguồn chất xơ thích hợp khác trong môi trường sống sinh thái của chúng. Các tính chất đàn hồi của các gân đặc biệt cũng được sử dụng trong các cung recurved tổng hợp được ưa thích bởi các du mục thảo nguyên của Eurasia. Viên pháo ném đá đầu tiên cũng sử dụng tính đàn hồi của gân.
Gân là một vật liệu tuyệt vời cordage vì ba lý do: Nó là cực kỳ mạnh mẽ, nó chứa keo tự nhiên, và nó co lại khi nó khô, làm mất đi sự cần thiết cho nút.
Sử dụng trong ẩm thực
[sửa | sửa mã nguồn]Gân (đặc biệt là gân bò) được sử dụng làm thực phẩm trong một số món ăn châu Á (thường được phục vụ tại nhà hàng yum cha hoặc điểm sấm). Một món ăn phổ biến là suan bao niu jin, trong đó gân được ướp tỏi. Nó cũng đôi khi được tìm thấy trong phở Việt.
Ý nghĩa lâm sàng
[sửa | sửa mã nguồn]Chấn thương
[sửa | sửa mã nguồn]Gân chịu nhiều loại chấn thương. Có nhiều dạng viêm gân hoặc chấn thương gân do lạm dụng. Những loại chấn thương này thường dẫn đến viêm và thoái hóa hoặc làm suy yếu các gân, mà cuối cùng có thể dẫn đến vỡ gân.[31] Tendinopathies có thể được gây ra bởi một số yếu tố liên quan đến ma trận ngoại bào gân (ECM), và phân loại của họ đã được khó khăn bởi vì các triệu chứng và mô bệnh học của họ thường là tương tự.
Tham khảo
[sửa | sửa mã nguồn]- ^ a b Jozsa, L., and Kannus, P., Human Tendons: Anatomy, Physiology, and Pathology. Human Kinetics: Champaign, IL, 1997.
- ^ Lin, T. W.; Cardenas, L.; Soslowsky, L. J. (2004). “Biomechanics of tendon injury and repair”. Journal of Biomechanics. 37 (6): 865–877. doi:10.1016/j.jbiomech.2003.11.005. PMID 15111074.
- ^ Fukuta, S.; Oyama, M.; Kavalkovich, K.; Fu, F. H.; Niyibizi, C. (1998). “Identification of types II, IX and X collagens at the insertion site of the bovine achilles tendon”. Matrix Biology. 17 (1): 65–73. doi:10.1016/S0945-053X(98)90125-1. PMID 9628253.
- ^ Fratzl, P. (2009). “Cellulose and collagen: from fibres to tissues”. Current Opinion in Colloid & Interface Science. 8 (1): 32–39. doi:10.1016/S1359-0294(03)00011-6.
- ^ Dorlands Medical Dictionary, page 602
- ^ Caldini, E. G.; Caldini, N.; De-Pasquale, V.; Strocchi, R.; Guizzardi, S.; Ruggeri, A.; Montes, G. S. (1990). “Distribution of elastic system fibres in the rat tail tendon and its associated sheaths”. Cells Tissues Organs. 139 (4): 341–348. doi:10.1159/000147022. PMID 1706129.
- ^ Grant, T. M.; Thompson, M. S.; Urban, J.; Yu, J. (2013). “Elastic fibres are broadly distributed in tendon and highly localized around tenocytes”. Journal of Anatomy. 222 (6): 573–579. doi:10.1111/joa.12048. PMC 3666236. PMID 23587025.
- ^ Dorlands Medical Dictionary 2012.Page 1382
- ^ Zhang, G. E., Y.; Chervoneva, I.; Robinson, P. S.; Beason, D. P.; Carine, E. T.; Soslowsky, L. J.; Iozzo, R. V.; Birk, D. E. (2006). “Decorin regulates assembly of collagen fibrils and acquisition of biomechanical properties during tendon development”. Journal of Cellular Biochemistry. 98 (6): 1436–1449. doi:10.1002/jcb.20776. PMID 16518859.Quản lý CS1: nhiều tên: danh sách tác giả (liên kết)
- ^ Raspanti, M.; Congiu, T.; Guizzardi, S. (2002). “Structural Aspects of the Extracellular Matrix of the Tendon: An Atomic Force and Scanning Electron Microscopy Study”. Archives of Histology and Cytology. 65 (1): 37–43. doi:10.1679/aohc.65.37. PMID 12002609.
- ^ Scott, J. E. O., C. R.; Hughes, E. W. (1981). “Proteoglycan-collagen arrangements in developing rat tail tendon. An electron microscopical and biochemical investigation”. Biochemical Journal. 195 (3): 573–581. PMC 1162928. PMID 6459082.Quản lý CS1: nhiều tên: danh sách tác giả (liên kết)
- ^ Scott, J. E. (2003). “Elasticity in extracellular matrix 'shape modules' of tendon, cartilage, etc. A sliding proteoglycan-filament model”. Journal of Physiology. 553 (2): 335–343. doi:10.1113/jphysiol.2003.050179. PMC 2343561. PMID 12923209.
- ^ McNeilly, C. M.; Banes, A. J.; Benjamin, M.; Ralphs, J. R. (1996). “Tendon cells in vivo form a three dimensional network of cell processes linked by gap junctions”. Journal of Anatomy. 189 (Pt 3): 593–600. PMC 1167702. PMID 8982835.
- ^ “Having a short Achilles tendon may be an athlete's Achilles heel”. Bản gốc lưu trữ ngày 21 tháng 10 năm 2007. Truy cập ngày 26 tháng 10 năm 2007.
- ^ Young, Michael. “A Review on Postural Realignment and its Muscular and Neural Components” (PDF). Bản gốc (PDF) lưu trữ ngày 6 tháng 4 năm 2019. Truy cập ngày 2 tháng 8 năm 2018.
- ^ Thorpe C.T., Birch H.L., Clegg P.D., Screen H.R.C. (2013). The role of the non-collagenous matrix in tendon function. Int J ExpPathol. 94;4: 248-59.
- ^ Hulmes, D. J. S. (2002). “Building Collagen Molecules, Fibrils, and Suprafibrillar Structures”. Journal of Structural Biology. 137 (1–2): 2–10. doi:10.1006/jsbi.2002.4450. PMID 12064927.
- ^ Silver, F. H.; Freeman, J. W.; Seehra, G. P. (2003). “Collagen self-assembly and the development of tendon mechanical properties”. Journal of Biomechanics. 36 (10): 1529–1553. doi:10.1016/S0021-9290(03)00135-0. PMID 14499302.
- ^ Ker, R. F. (2002). “The implications of the adaptable fatigue quality of tendons for their construction, repair and function”. Comparative Biochemistry and Physiology A. 133 (4): 987–1000. doi:10.1016/S1095-6433(02)00171-X. PMID 12485688.
- ^ Cribb, A. M.; Scott, J.E. (1995). In Tendon response to tensile-stress - an ultrastructural investigation of collagen - proteoglycan interactions in stressed tendon,1995; Cambridge Univ Press.pp 423-428.
- ^ Screen H.R., Lee D.A., Bader D.L., Shelton J.C. (2004). “An investigation into the effects of the hierarchical structure of tendon fascicles on micromechanical properties”. Proc Inst Mech Eng H. 218: 109–119.Quản lý CS1: nhiều tên: danh sách tác giả (liên kết)
- ^ Puxkandl, R.; Zizak, I.; Paris, O.; Keckes, J.; Tesch, W.; Bernstorff, S.; Purslow, P.; Fratzl, P. (2002). “Viscoelastic properties of collagen: synchrotron radiation investigations and structural model”. Philosophical Transactions of the Royal Society B. 357 (1418): 191–197. doi:10.1098/rstb.2001.1033. PMC 1692933. PMID 11911776.
- ^ Gupta H.S., Seto J., Krauss S., Boesecke P.& Screen H.R.C. (2010). In situ multi-level analysis of viscoelastic deformation mechanisms in tendon collagen. J. Struct. Biol. 169(2):183-191.
- ^ Thorpe C.T; Udeze C.P; Birch H.L.; Clegg P.D.; Screen H.R.C. (2012). “Specialisation of tendon mechanical properties results from inter-fascicular differences”. J Roy Soc Int. 76: 3108–3117.
- ^ Thorpe C.T.; Klemt C; Riley G.P.; Birch H.L.; Clegg P.D.; Screen H.R.C. (2013). “Helical sub-structures in energy-storing tendons provide a possible mechanism for efficient energy storage and return”. Acta Biomater. 8: 7948–56.
- ^ Herchenhan, Andreas; Kalson, Nicholas S.; Holmes, David F.; Hill, Patrick; Kadler, Karl E.; Margetts, Lee (ngày 7 tháng 7 năm 2011). “Tenocyte contraction induces crimp formation in tendon-like tissue”. Biomechanics and Modeling in Mechanobiology. 11 (3–4): 449–459. doi:10.1007/s10237-011-0324-0. ISSN 1617-7959. PMC 3822867. PMID 21735243.
- ^ Gatt R, Vella Wood M, Gatt A, Zarb F, Formosa C, Azzopardi KM, Casha A, Agius TP, Schembri-Wismayer P, Attard L, Chockalingam N, Grima JN (2015). “Negative Poisson's ratios in tendons: An unexpected mechanical response”. Acta Biomater. 24: 201–208. doi:10.1016/j.actbio.2015.06.018.
- ^ Batson EL, Paramour RJ, Smith TJ, Birch HL, Patterson-Kane JC, Goodship AE. (2003). Equine Vet J. |volume=35 |issue=3 |pages=314-8. Are the material properties and matrix composition of equine flexor and extensor tendons determined by their functions?
- ^ ScreenH.R.C., Tanner, K.E. (2012). Structure & Biomechanics of Biological Composites. In: Encyclopaedia of Composites 2nd Ed. Nicolais & Borzacchiello.Pub. John Wiley & Sons, Inc. ISBN 978-0-470-12828-2 (pages 2928-39)
- ^ Reeves, N. D. (2005). “Influence of 90-day simulated micro-gravity on human tendon mechanical properties and the effect of restiveness countermeasures”. Applied Physiology. 98 (6): 2278–2286. doi:10.1152/japplphysiol.01266.2004. PMID 15705722.
- ^ Sharma, P. M., N. (2006). “Biology of tendon injury: healing, modeling and remodeling”. Journal of Musculoskeletal and Neuronal Interactions. 6 (2): 181–190. PMID 16849830.Quản lý CS1: nhiều tên: danh sách tác giả (liên kết)CS1 maint: Multiple names: authors list (link)
| Tiêu đề chuẩn |
|
|---|
| |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Tự nhiên |
| ||||||||
| Sợi tổng hợp |
| ||||||||
| |||||||||
| |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Sinh lý học |
| ||||||||||||
| Thành phần |
| ||||||||||||
| Các loại |
| ||||||||||||
Từ khóa » Dây Gân Và Dây Chằng
-
Cấu Tạo Và Chức Năng Của Gân & Dây Chằng đối Với Hệ Vận động.
-
Sự Khác Biệt Giữa Gân Và Dây Chằng - Strephonsays
-
Giãn Dây Chằng: Nguyên Nhân, Dấu Hiệu Và Cách điều Trị
-
Tại Sao điều Trị Bệnh Lý Gân, Dây Chằng Dai Dẳng Và Hay Tái Phát?
-
Tổng Quan Về Bong Gân Và Các Tổn Thương Phần Mềm Khác
-
Đứt Dây Chằng Khớp Gối Và Tổn Thương Sụn Chêm - MSD Manuals
-
Dây Chằng – Wikipedia Tiếng Việt
-
Bong Gân Và đứt Dây Chằng Cổ Chân - Vinmec
-
Giãn Dây Chằng: Dấu Hiệu, Nguyên Nhân Và Cách Chữa Trị | ACC
-
Viên Uống Hỗ Trợ Nuôi Dưỡng Gân Và Dây Chằng Tendoactive ...
-
Viêm Dây Chằng: Nguyên Nhân, Triệu Chứng Và Cách điều Trị • Hello ...
-
Sự Khác Biệt Giữa Gân Và Dây Chằng
-
Những Thông Tin Về Chấn Thương Dây Chằng đầu Gối Mà Bạn Nên Biết!
-
Giãn Dây Chằng Vai: Nguyên Nhân, Biểu Hiện Và Cách Xử Lý - Medlatec
-
Hỗ Trợ Phục Hồi Gân Và Dây Chằng Từ Tây Ban Nha - Videos | Facebook
-
TENDOACTIVE – Hỗ Trợ Hồi Phục Sau Chấn Thương Gân Và Dây Chằng.