Giải Hóa Học 8 Bài 21: Tính Theo Công Thức Hóa Học
Có thể bạn quan tâm
I. Xác định thành phần phần trăm các nguyên tố trong hợp chất
Bước 1: Tính khối lượng mol của hợp chất.
Bước 2: Tìm số mol nguyên tử mỗi nguyên tố trong 1 mol hợp chất rồi quy về khối lượng.
Bước 3: Tìm thành phần phần trăm các nguyên tố trong hợp chất.
Ví dụ: Xác định thành phần phần trăm theo khối lượng của các nguyên tố có trong hợp chất KNO3
Lời giải
+ MKNO3= 39 + 14 + 16.3 = 101 gam/mol
+ Trong 1 mol KNO3 có: 1 mol nguyên tử K; 1 mol nguyên tử N và 3 mol nguyên tử O
+) %K=39.100%101=38,6%
+) %N=14.100%101=13,8%
+) %O=16.3.100%101=47,6% hoặc %O=100% - (38,6% + 13,8%) = 47,6%
II. Xác định công thức hoá học của hợp chất khi biết thành phần các nguyên tố
Bước 1: Tìm khối lượng mỗi nguyên tố có trong 1 mol hợp chất.
Bước 2: Tìm số mol nguyên tử mỗi nguyên tố trong 1 mol hợp chất.
Bước 3: Lập công thức hóa học của hợp chất.
Ví dụ: Một hơp chất có thành phần các nguyên tố là 40%Cu; 20% S và 40%O. Hãy xác định công thức hoá học của hợp chất (biết khối lượng mol là 160)
Lời giải
- Khối lượng của mỗi nguyên tố trong 1 mol hợp chất là:
mCu = 40.160100=64 gam
mS = 20.160100=32 gam
mO = 40.160100=64 gam
- Số mol nguyên tử của mỗi nguyên tố trong một mol hợp chất là:
nCu = 6464 = 1 mol
nS = 3232 = 1 mol
nO = 6416 = 4 mol
Vậy công thức hoá học của hợp chất là: CuSO4
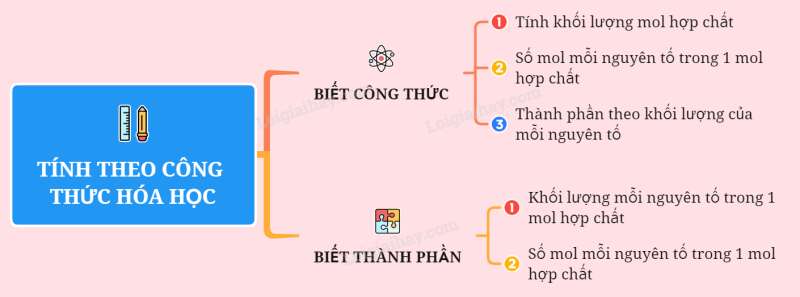
Sơ đồ tư duy: Tính theo công thức hóa học
Từ khóa » Hóa Lớp 8 Bài 21 Trang 70
-
Giải Hóa 8 Bài 21: Tính Theo Công Thức Hóa Học
-
Bài 21. Tính Theo Công Thức Hóa Học
-
Giải Hóa 8 Bài 21: Tính Theo Công Thức Hóa Học
-
Hóa Học Lớp 8 - Bài 21 - Tính Theo Công Thức Hóa Học ( Tiết 1)
-
Hoá Học 8 Bài 21: Tính Theo Công Thức Hóa Học - Hoc247
-
Giải Bài 21 Hóa Học 8: Tính Theo Công Thức Hóa Học - Tech12h
-
Hoá Học 8 Bài 21: Tính Theo Công Thức Hóa Học
-
Giải Bài Tập Hóa Học 8 - Bài 21: Tính Theo Công Thức Hóa Học
-
Lý Thuyết Hóa 8: Bài 21. Tính Theo Công Thức Hóa Học - TopLoigiai
-
Giải Bài 1,2,3, 4,5 Trang 71 SGK Hóa 8: Tính Theo Công Thức Hóa Học
-
Giải Vở Bài Tập Hóa 8 Bài 21: Tính Theo Công Thức Hóa Học - Haylamdo
-
Tóm Tắt Và Giải Bài Tập Hóa Lớp 8 Bài 21: Tính Theo Công Thức Hóa Học
-
Hướng Dẫn Trả Lời Câu Hỏi 1 2 3 4 Bài 21 Trang 70 Sgk Sinh Học 8
-
Giải Hóa 8 Bài 21: Tính Theo Công Thức Hóa Học