Glucose – Wikipedia Tiếng Việt
Có thể bạn quan tâm
Nội dung
chuyển sang thanh bên ẩn- Đầu
- Bài viết
- Thảo luận
- Đọc
- Sửa đổi
- Sửa mã nguồn
- Xem lịch sử
- Đọc
- Sửa đổi
- Sửa mã nguồn
- Xem lịch sử
- Các liên kết đến đây
- Thay đổi liên quan
- Liên kết thường trực
- Thông tin trang
- Trích dẫn trang này
- Tạo URL rút gọn
- Tải mã QR
- Tạo một quyển sách
- Tải dưới dạng PDF
- Bản để in ra
- Wikimedia Commons
- Khoản mục Wikidata
| D-Glucose | |||
|---|---|---|---|
| |||
| |||
| |||
| Danh pháp IUPAC | - Dạng mạch thẳng: Pentahidroxihexanal - Dạng mạch vòng: L-Glucose | ||
| Tên khác | Glucozơ, Dextrose | ||
| Nhận dạng | |||
| Viết tắt | Glc | ||
| Số CAS | 50-99-7 | ||
| PubChem | 5793 | ||
| Số EINECS | 200-075-1 | ||
| Mã ATC | B05CX01,V04CA02 (WHO) , V06DC01 (WHO) | ||
| Ảnh Jmol-3D | ảnhảnh 2 | ||
| SMILES | đầy đủ
| ||
| Thuộc tính | |||
| Công thức phân tử | C6H12O6 | ||
| Khối lượng mol | 180.16 g/mol | ||
| Khối lượng riêng | 1.54 g/cm³ | ||
| Điểm nóng chảy | α-D-glucose: 146 °Cβ-D-glucose: 150 °C | ||
| Điểm sôi | |||
| Độ hòa tan trong nước | 91 g/100 ml (25 °C) | ||
| Độ hòa tan trong methanol | 0.037 M | ||
| Độ hòa tan trong ethanol | 0.006 M | ||
| Độ hòa tan trong tetrahydrofuran | 0.016 M | ||
| Nhiệt hóa học | |||
| Enthalpyhình thành ΔfHo298 | −1271 kJ/mol | ||
| DeltaHc | −2805 kJ/mol | ||
| Entropy mol tiêu chuẩn So298 | 209.2 J K−1 mol−1 | ||
| Các nguy hiểm | |||
| MSDS | ICSC 0865 | ||
| Chỉ mục EU | not listed | ||
| Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |||
Glucose còn gọi là đường glucô, đường glu là một loại monosaccharide với công thức phân tử C6H12O6 và phổ biến nhất. Glucose chủ yếu được tạo ra bởi thực vật và hầu hết các loại tảo trong quá trình quang hợp từ nước và CO2, sử dụng năng lượng từ ánh sáng mặt trời. Ở đó, nó được sử dụng để tạo ra cellulose trong thành tế bào và tinh bột. Trong chuyển hóa năng lượng, glucose là nguồn nguyên liệu quan trọng nhất trong tất cả các sinh vật để tạo ra năng lượng trong quá trình hô hấp tế bào. Trong thực vật nó được lưu trữ chủ yếu ở dạng cellulose và tinh bột (hỗn hợp gồm thành phần chính là amilose mạch đơn và amylopectin ở dạng mạch phân nhánh), còn ở động vật nó được lưu trữ trong glycogen. Dạng glucose xuất hiện trong tự nhiên là D-glucose, trong khi đó L-glucose được sản xuất tổng hợp với số lượng tương đối nhỏ và có tầm quan trọng thấp hơn.
Dung dịch Glucose 5% là dung dịch đường tiêm tĩnh mạch, nằm trong Danh sách các loại thuốc thiết yếu của Tổ chức Y tế Thế giới (WHO) và là loại thuốc quan trọng nhất cần thiết trong hệ thống y tế cơ bản. Tên glucose bắt nguồn từ tiếng Pháp từ tiếng Hy Lạp ('glukos'), có nghĩa là "ngọt" từ rượu chưa lên men, giai đoạn đầu tiên trong quá trình sản xuất rượu vang. Hậu tố " -ose " là một phân loại hóa học, biểu thị nó là một loại đường. Ngoài ra nó còn phân cực
Lịch sử
[sửa | sửa mã nguồn]Glucose lần đầu tiên được phân lập từ nho khô vào năm 1747 bởi nhà hóa học người Đức Andreas Marggraf. Glucose được phát hiện trong nho bởi Johann Tobias Lowitz vào năm 1792 và được công nhận là khác với đường mía (saccarozo). Glucose là thuật ngữ được đặt ra bởi Jean Baptiste Dumas vào năm 1838, đã chiếm ưu thế trong các tài liệu hóa học. Friedrich August Kekulé đã đề xuất thuật ngữ dextrose (từ Latin: dexter = bên phải), bởi vì trong dung dịch D-glucose của nước, mặt phẳng của ánh sáng phân cực tuyến tính được quay sang phải, còn L-glucose chuyển ánh sáng phân cực tuyến tính sang trái.

Glucose là một trong những nhu cầu cầu thiết yếu của nhiều sinh vật, nên sự hiểu biết chính xác về công thức phân tử và cấu trúc hóa học của nó đã góp phần rất lớn vào sự tiến bộ chung trong hóa học hữu cơ. Sự hiểu biết này phần lớn là nhờ vào kết quả các nghiên cứu của Emil Fischer, một nhà hóa học người Đức đã nhận được giải thưởng Nobel về hóa học năm 1902 cho những phát hiện của ông. Từ năm 1891 đến 1894, Fischer đã thiết lập cấu hình hóa học lập thể của tất cả các loại đường đã biết và dự đoán chính xác các đồng phân có thể có của chúng, áp dụng lý thuyết về các nguyên tử carbon không đối xứng của van 't Hoff.
Nhờ vào phát hiện ra sự chuyển hóa glucose, Otto Meyerhof đã nhận được giải thưởng Nobel về sinh lý học hoặc y học năm 1922. Hans von Euler-Chelpin đã được trao giải thưởng Nobel về hóa học cùng với Arthur Harden năm 1929 do "Nghiên cứu về quá trình lên men của họ đường và các enzyme trong quá trình này ". Năm 1947, Bernardo Houssay (phát hiện ra vai trò của tuyến yên trong quá trình chuyển hóa glucose và carbohydrate) cũng như Carl và Gerty Cori (phát hiện ra sự chuyển đổi glycogen từ glucose) đã nhận được giải thưởng Nobel về sinh lý học hoặc y học. Năm 1970, Luis Leloir đã được trao giải thưởng Nobel về hóa học nhờ khám phá về các nucleotite đường và vai trò của chúng trong tổng hợp các cacbonhidrat.
Tính chất vật lý và trạng thái tự nhiên
[sửa | sửa mã nguồn]Tính chất vật lý
[sửa | sửa mã nguồn]Glucose là chất kết tinh không màu, vị ngọt nhưng không ngọt bằng đường mía, dễ tan trong nước, nóng chảy ở 146 °C (dạng α của vòng pyranose) và 150 °C (dạng β của vòng pyranose).

Trạng thái tự nhiên
[sửa | sửa mã nguồn]Glucose có trong hầu hết các bộ phận của cây như hoa, lá, rễ,...và nhất là trong quả chín. Đặc biệt có nhiều trong quả nho chín (khoảng 18.33%) nên cũng có thể gọi là đường nho. Trong mật ong có nhiều glucose (khoảng 30%). Glucose cũng có trong cơ thể người và động vật. Trong máu người có một lượng nhỏ glucose với nồng độ hầu như không đổi khoảng 0,1%.

Cấu trúc phân tử
[sửa | sửa mã nguồn]Glucose có công thức phân tử là C6H12O6, tồn tại ở cả hai dạng: mạch hở và mạch vòng.
Dạng mạch hở
[sửa | sửa mã nguồn]Các dữ kiện thực nghiệm
[sửa | sửa mã nguồn]- Khử hoàn toàn glucose thì thu được hexan. Vậy 6 nguyên tử Carbon của phân tử glucose tạo thành mạch hở không phân nhánh.
- Glucose có phản ứng tráng bạc, khi tác dụng với nước brom tạo thành acid gluconic, chứng tỏ trong phân tử có nhóm CH=O
- Glucose tạo este chứa 5 gốc acid chứng tỏ phân tử có 5 nhóm hydroxil -OH.
(Ac2O là (CH3CO)2O)
- Glucose tác dụng với Cu(OH)2 tạo thành dung dịch màu xanh lam, chứng tỏ phân tử glucose có nhiều nhóm OH kề nhau.
b) Kết luận
Glucose là hợp chất hữu cơ tạp chức, ở dạng mạch hở phân tử có cấu tạo của một aldehyde đơn chức và alcohol 5 chức. Công thức cấu tạo của glucose mạch hở như sau:

Hoặc viết gọn hơn là:
Dạng mạch vòng
[sửa | sửa mã nguồn]Việc xem xét các cấu trúc của glucose ở trên là các hợp chất mạch hở không phù hợp với một số tính chất hóa học và vật lý của glucose. Thí dụ như sự xuất hiện tính chất đặc biệt của một trong nhiều nhóm hydroxyl, nhóm cacbonyl không cho tính chất điển hình của một andehit như không cộng hợp NaHSO4, phản ứng màu với acid fuchsinsunfurous (thuốc thử Sip) không xảy ra, dải hấp thụ trên phổ hồng ngoại của dao động hóa trị C=O của D-glucose không xuất hiện, các monosacrit được ester hóa hoàn toàn (thí dụ tạo các acetate), độ quay cực của các dung dịch mới điều chế của các monosacarit tinh thể bị thay đổi theo thời gian. Một hiện tượng đáng ngạc nhiên hơn là các monosacarit và một số dẫn xuất của chúng (các acetal và các ester) tồn tại ít nhất ở hai dạng đồng phân lập thể.
Hemiacetal và lý giải mạch vòng
[sửa | sửa mã nguồn]Khi cho andehit tác dụng với alcohol ta có thể thu được hemiacetal. Phản ứng này có ý nghĩa rất quan trọng trong trường hợp của glucose, khi cả hai nhóm CH=O và OH cùng thuộc về một phân tử. Nhóm OH tham gia vào phản ứng này với nhóm CH=O trên cùng một phân tử glucose có thể là nhóm OH ở carbon vị trí số 4 (tạo vòng furanose-5 cạnh) hoặc nhóm OH ở carbon vị trí số 5 (tạo vòng pyranose-6 cạnh). Trong đó tạo vòng pyranose chiếm ưu thế hơn cả. Việc tạo từ dạng mạch hở sang dạng mạch vòng sẽ giải phóng bớt năng lượng giúp phân tử glucose trở nên bền hơn.

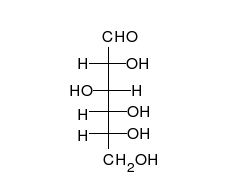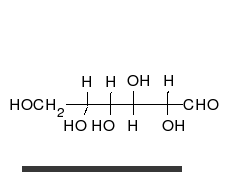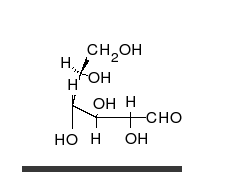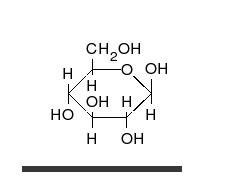
Dạng mạch hở và các dạng mạch vòng của của glucose trong cân bằng tồn tại với lượng không bằng nhau, mà đồng phân nào bền hơn thì sẽ chiếm ưu thế. Như vậy, theo nguyên tắc thì các vòng chiếm ưu thế sẽ là vòng pyranose. Thí dụ, D-glucose trong nước trung hòa ở nhiệt độ phòng được biểu hiện chủ yếu ở dạng pyranose (α-D-glucopyranose: 36%, β-D-glucopyranose: 64%). Các dạng hở và vòng furanose tồn tại với lượng rất nhỏ (mạch hở: <0,03%, α-D-glucofuranose: <0,1%, β-D-glucofuranose:<0,1%), không đáng kể, nhưng quan trọng là phải chú ý rằng sự chuyển hóa lẫn nhau ở các dạng mạch vòng đều được thực hiện qua dạng hở.
-
 α-D-Glucofuranose
α-D-Glucofuranose -
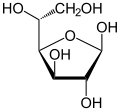 β-D-Glucofuranose
β-D-Glucofuranose -
 β-D-glucose
β-D-glucose -
 α-D-glucose
α-D-glucose
.
Tính chất hoá học
[sửa | sửa mã nguồn]Dạng mạch vòng
[sửa | sửa mã nguồn]Khi cho một lượng nhỏ khí HCl đi qua dung dịch D-glucose trong methanol(CH3OH) sẽ xảy ra phản ứng tạo Methyl-D-glucoside.
Dạng mạch hở
[sửa | sửa mã nguồn]Tính chất của alcohol đa chức
[sửa | sửa mã nguồn]Tác dụng với Cu(OH)2
[sửa | sửa mã nguồn]Trong dung dịch, ở nhiệt độ thường glucose hòa tan Cu(OH)2 cho dung dịch phức đồng-glucose có màu xanh lam:
Phản ứng tạo ester
[sửa | sửa mã nguồn]Khi tác dụng với anhydride acetic, glucose có thể tạo ester 5 gốc acetate trong phân tử.
Tính chất của aldehyde
[sửa | sửa mã nguồn]Thể hiện tính khử của nhóm CHO
[sửa | sửa mã nguồn]Phản ứng tráng bạc: cho vào ống nghiệm sạch 1ml dung dịch AgNO3 1%, sau đó nhỏ từng giọt dung dịch NH3 5% và lắc đều đến khi kết tủa vừa tan hết. Thêm tiếp 1 ml dung dịch glucose. Đun nóng nhẹ ống nghiệm. Trên thành ống nghiệm xuất hiện một lớp bạc sáng như gương.
Ngoài ra nhóm CHO của glucose còn có các phản ứng khác như:
Với dung dịch brom cho acid gluconic:
(dung dịch nhạt màu dần do mất bớt đi Br2)
Với kết tủa Cu(OH)2 trong môi trường dung dịch base mạnh:
(xuất hiện kết tủa đỏ gạch của Cu2O)
Với dung dịch HNO3 với tính oxy hóa mạnh hơn còn oxy hóa cả nhóm HOCH2 ở vị trí C6 thành nhóm COOH cho acid glucaric:
Thể hiện tính oxy hóa của nhóm CHO
[sửa | sửa mã nguồn]Khi dẫn khí hydro vào dung dịch glucose đun nóng (xúc tác Ni), thu được một polialcohol có tên là sobitol:
Ngoài ra còn có thể dùng tác nhân khử mạnh hơn như NaBH4
Phản ứng lên men
[sửa | sửa mã nguồn]Dưới tác dụng của các enzym khác nhau, phân tử glucose tham gia vào một số phản ứng lên men tạo thành các sản phẩm cuối cùng như ethanol, acid butyric, acid lactic, acid citric,... Thí dụ:
Lên men rượu:
Lên men butyric:
Lên men lactic:
Lên men citric:
Phản ứng thoái biến giảm mạch glucose
[sửa | sửa mã nguồn]Thoái biến Ruff
[sửa | sửa mã nguồn]Trong phương pháp này D-glucose bị giảm mất một carbon cho đường D-Arabinose:

Điều chế và ứng dụng
[sửa | sửa mã nguồn]Điều chế
[sửa | sửa mã nguồn]Trong công nghiệp, glucose được điều chế bằng cách thủy phân tinh bột nhờ xúc tác acid chlohidric (HCl) loãng, hoặc enzim. Người ta cũng thủy phân cellulose (có trong vỏ bào, mùn cưa) nhờ xúc tác acid chlohidric đặc thành glucose để làm nguyên liệu sản xuất ethanol. Hai phương pháp đó đều được tóm tắt bằng phương trình phản ứng như sau:
Trong tự nhiên, glucose được tổng hợp trong cây xanh nhờ quá trình quang hợp phức tạp có thể được viết đơn giản bằng phương trình hóa học sau:
Ứng dụng và chức năng của glucose trong cơ thể
[sửa | sửa mã nguồn]Glucose là chất dinh dưỡng có giá trị của con người, nhất là đối với trẻ em, người già. Trong y học, glucose được dùng làm thuốc tăng lực. Trong công nghiệp, glucose được dùng để tráng gương, tráng ruột phích và là sản phẩm trung gian trong sản xuất ethanol từ các nguyên liệu có chứa tinh bột và cellulose.
Glucose giúp các hỗn hợp có pha đường không bị hiện lên những hạt đường nhỏ khi để lâu (hiện tượng hồi đường hay lại đường). Đồng thời nó cũng giúp bánh kẹo lâu bị khô và giữ được độ mềm. Nó cũng được sử dụng trong quá trình làm kem để giữ hỗn hợp nước và đường mịn, không bị hồi đường. Nó còn giúp chúng ta sản xuất Vitamin C và pha huyết thanh. Nói chung, trong công nghiệp thực phẩm, glucose được sử dụng làm chất bảo quản
Glucose là nguồn năng lượng chủ yếu và trực tiếp của cơ thể, được dự trữ ở gan dưới dạng glycogen.
Thành phần tham gia vào cấu trúc của tế bào (RNA và DNA) và một số chất đặc biệt khác (Mucopolysaccharid, héparin, acid hyaluronic,chondroitin ...).
Glucose được sử dụng để tạo năng lượng cần thiết cho sự sống, quá trình này diễn ra trong tế bào. Việc sử dụng glucose của tế bào phụ thuộc vào hoạt động của màng tế bào dưới tác dụng của Insuline (ngoại trừ các tế bào não, tổ chức thần kinh, tế bào máu, tủy thận và thủy tinh thể).
3. Sinh học và sự liên quan
- Glucose giúp các tế bào trong cơ thể hoạt động: Các tế bào hồng duy trì năng lượng cho cơ thể rất cần glucose. Gan có nhiệm vụ giữ glucose thành một nguồn năng lượng có tên là glycogen sau đó phân phối đều đến cơ thể. Song song với đó là giữ cho lượng máu trong cơ thể luôn ở trạng thái ổn định.
Tham khảo
[sửa | sửa mã nguồn]- What is Glucose
| |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Chung |
|    | |||||||||||||
| Hình học |
| ||||||||||||||
| Monosaccharide |
| ||||||||||||||
| Nhiều saccharide |
| ||||||||||||||
| |||||||||||||||
- Hợp chất hữu cơ
- Dinh dưỡng
- Chất ngọt
- Đái tháo đường
- Thuốc thiết yếu của WHO
Từ khóa » C6h12o6 Ra C
-
C6H12O6 = C + H2O - Trình Cân Bằng Phản ứng Hoá Học
-
C6H12O6 H2O = C2H5OH CO2 | Cân Bằng Phương Trình Hóa Học
-
C6H12O6 = C2H5OH CO2 | Cân Bằng Phương Trình Hóa Học
-
C6H12O6 → C2H5OH + CO2 - Lên Men Glucozo
-
C6H12O6 H2O = C2H5OH CO2 | Chemical Equation Balancer
-
Viết Phản ứng Hóa Học (C6H10O5)n Tạo Ra C6h12o6 Tạo Ra C2h5oh ...
-
C6H12O6 + O2 | H2O + CO2 | Cân Bằng Phương Trình Hóa Học
-
Rac-2-hydroxypropanoic Acid | C6H12O6 - PubChem
-
Tổng Quan Về đường Gluco C6H12O6 - Công Ty Hóa Chất Hanimex
-
C6H12O6 → X → YZ → CH3COOHBiết Rằng Y, Z Không Tan Trong ...
-
Cho Sơ đồ Phản ứng (theo đúng Tỉ Lệ Mol) C6H12O6 → 2X + 2CO2 ...
-
Giải Thích Về Quang Hợp (đồng Hóa Carbon) - BAC Fertilizers
-
[PDF] Writing Half Reactions – Example
-
C6H12O6 Là Chất điện Li Mạnh Hay Yếu - Phương Trình Hóa Học ...






![{\displaystyle {\mathrm {HOCH} {\vphantom {A}}_{\smash[{t}]{2}}(\mathrm {CHOH} ){\vphantom {A}}_{\smash[{t}]{4}}\mathrm {CHO} {}+{}2\,[\mathrm {Ag} (\mathrm {NH} {\vphantom {A}}_{\smash[{t}]{3}}){\vphantom {A}}_{\smash[{t}]{2}}]\mathrm {NO} {\vphantom {A}}_{\smash[{t}]{3}}{}\mathrel {\longrightarrow } {}\mathrm {HOCH} {\vphantom {A}}_{\smash[{t}]{2}}(\mathrm {CHOH} ){\vphantom {A}}_{\smash[{t}]{4}}\mathrm {COONH} {\vphantom {A}}_{\smash[{t}]{4}}{}+{}2\,\mathrm {Ag} {}+{}\mathrm {NH} {\vphantom {A}}_{\smash[{t}]{3}}{}+{}2\,\mathrm {NH} {\vphantom {A}}_{\smash[{t}]{4}}\mathrm {NO} {\vphantom {A}}_{\smash[{t}]{3}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4c7cd1c92be6c69d832dc603bc2f4f6f6b3ebd9b)
![{\displaystyle {\mathrm {HOCH} {\vphantom {A}}_{\smash[{t}]{2}}(\mathrm {CHOH} ){\vphantom {A}}_{\smash[{t}]{4}}\mathrm {CHO} {}+{}\mathrm {Br} {\vphantom {A}}_{\smash[{t}]{2}}{}+{}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} {}\mathrel {\longrightarrow } {}\mathrm {HOCH} {\vphantom {A}}_{\smash[{t}]{2}}(\mathrm {CHOH} ){\vphantom {A}}_{\smash[{t}]{4}}\mathrm {COOH} {}+{}2\,\mathrm {HBr} }}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e68c9a772ab222ecfe4e709a3173722b632d9166)
![{\displaystyle {\mathrm {HOCH} {\vphantom {A}}_{\smash[{t}]{2}}(\mathrm {CHOH} ){\vphantom {A}}_{\smash[{t}]{4}}\mathrm {CHO} {}+{}5\,\mathrm {Ac} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} {}\mathrel {\longrightarrow } {}\mathrm {AcOCH} {\vphantom {A}}_{\smash[{t}]{2}}(\mathrm {CHOAc} ){\vphantom {A}}_{\smash[{t}]{4}}\mathrm {CHO} {}+{}5\,\mathrm {CH} {\vphantom {A}}_{\smash[{t}]{3}}\mathrm {COOH} }}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fc17d7228cdb56dc63108dfbddd51ae09adb09b0)
![{\displaystyle {\mathrm {CH} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {OH} {}-{}\mathrm {CHOH} {}-{}\mathrm {CHOH} {}-{}\mathrm {CHOH} {}-{}\mathrm {CHOH} {}-{}\mathrm {CH} {=}\mathrm {O} }}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6b5bf6ed33651dca3aa2eff2e26ab5970d046ed6)
![{\displaystyle {\mathrm {CH} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {OH} ~[\mathrm {CHOH} ]{\vphantom {A}}_{\smash[{t}]{4}}~\mathrm {CHO} }}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7343d5f9591f7cc139685330adb2758a1a4fe0b1)




![{\displaystyle {2\,\mathrm {C} {\vphantom {A}}_{\smash[{t}]{6}}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{12}}\mathrm {O} {\vphantom {A}}_{\smash[{t}]{6}}{}+{}\mathrm {Cu} (\mathrm {OH} ){\vphantom {A}}_{\smash[{t}]{2}}{}\mathrel {\longrightarrow } {}(\mathrm {C} {\vphantom {A}}_{\smash[{t}]{6}}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{11}}\mathrm {O} {\vphantom {A}}_{\smash[{t}]{6}}){\vphantom {A}}_{\smash[{t}]{2}}\mathrm {Cu} {}+{}2\,\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} }}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d01bcd8dd7aecedb63cb2f180d49cd231197fe5d)
![{\displaystyle {\mathrm {HOCH} {\vphantom {A}}_{\smash[{t}]{2}}{-}(\mathrm {CHOH} ){\vphantom {A}}_{\smash[{t}]{4}}{-}\mathrm {CHO} {}+{}5\,\mathrm {Ac} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} {}\mathrel {\longrightarrow } {}\mathrm {AcOCH} {\vphantom {A}}_{\smash[{t}]{2}}{-}(\mathrm {CHOAc} ){\vphantom {A}}_{\smash[{t}]{4}}{-}\mathrm {CHO} {}+{}5\,\mathrm {CH} {\vphantom {A}}_{\smash[{t}]{3}}\mathrm {COOH} }}](https://wikimedia.org/api/rest_v1/media/math/render/svg/235c2411372a78da9a4428fc4f84bf674ab2d629)
![{\displaystyle {\mathrm {HOCH} {\vphantom {A}}_{\smash[{t}]{2}}{-}(\mathrm {CHOH} ){\vphantom {A}}_{\smash[{t}]{4}}{-}\mathrm {CHO} {}+{}2\,[\mathrm {Ag} (\mathrm {NH} {\vphantom {A}}_{\smash[{t}]{3}}){\vphantom {A}}_{\smash[{t}]{2}}]\mathrm {OH} {}\mathrel {\longrightarrow } {}\mathrm {HOCH} {\vphantom {A}}_{\smash[{t}]{2}}{-}(\mathrm {CHOH} ){\vphantom {A}}_{\smash[{t}]{4}}{-}\mathrm {COONH} {\vphantom {A}}_{\smash[{t}]{4}}{}+{}2\,\mathrm {Ag} {}+{}3\,\mathrm {NH} {\vphantom {A}}_{\smash[{t}]{3}}{}+{}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} }}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e7974137566f8cf891f046386ab6d5475dd3976e)
![{\displaystyle {\mathrm {HOCH} {\vphantom {A}}_{\smash[{t}]{2}}{-}(\mathrm {CHOH} ){\vphantom {A}}_{\smash[{t}]{4}}{-}\mathrm {CHO} {}+{}\mathrm {Br} {\vphantom {A}}_{\smash[{t}]{2}}{}+{}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} {}\mathrel {\longrightarrow } {}\mathrm {HOCH} {\vphantom {A}}_{\smash[{t}]{2}}{-}(\mathrm {CHOH} ){\vphantom {A}}_{\smash[{t}]{4}}{-}\mathrm {COOH} {}+{}2\,\mathrm {HBr} }}](https://wikimedia.org/api/rest_v1/media/math/render/svg/41535813fa4d43447372363c02a08f287259de44)
![{\displaystyle {\mathrm {HOCH} {\vphantom {A}}_{\smash[{t}]{2}}{-}(\mathrm {CHOH} ){\vphantom {A}}_{\smash[{t}]{4}}{-}\mathrm {CHO} {}+{}2\,\mathrm {Cu} (\mathrm {OH} ){\vphantom {A}}_{\smash[{t}]{2}}{}+{}\mathrm {NaOH} {}\mathrel {\longrightarrow } {}\mathrm {HOCH} {\vphantom {A}}_{\smash[{t}]{2}}{-}(\mathrm {CHOH} ){\vphantom {A}}_{\smash[{t}]{4}}{-}\mathrm {COONa} {}+{}\mathrm {Cu} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} {}+{}3\,\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} }}](https://wikimedia.org/api/rest_v1/media/math/render/svg/90678c9d85a3cffd2ddf354525ea9eb1685897f6)
![{\displaystyle {\mathrm {HOCH} {\vphantom {A}}_{\smash[{t}]{2}}{-}(\mathrm {CHOH} ){\vphantom {A}}_{\smash[{t}]{4}}{-}\mathrm {CHO} {}\mathrel {\xrightarrow {\text{HNO3}} } {}\mathrm {HOOC} {-}(\mathrm {CHOH} ){\vphantom {A}}_{\smash[{t}]{4}}{-}\mathrm {COOH} }}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ebde366ce2be3efd418e9667a45d819f972dc38b)
![{\displaystyle {\mathrm {HOCH} {\vphantom {A}}_{\smash[{t}]{2}}{-}(\mathrm {CHOH} ){\vphantom {A}}_{\smash[{t}]{4}}{-}\mathrm {CHO} {}+{}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}{}\mathrel {\xrightarrow[{\text{t°}}]{\text{Ni}}} {}\mathrm {HOCH} {\vphantom {A}}_{\smash[{t}]{2}}{-}(\mathrm {CHOH} ){\vphantom {A}}_{\smash[{t}]{4}}{-}\mathrm {CH} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {OH} }}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a6dd7d1f68ab8f6d20dd99f756efbe41eb7d3c8e)
![{\displaystyle {\mathrm {HOCH} {\vphantom {A}}_{\smash[{t}]{2}}{-}(\mathrm {CHOH} ){\vphantom {A}}_{\smash[{t}]{4}}{-}\mathrm {CHO} {}\mathrel {\xrightarrow[{\text{H2O}}]{\text{NaBH4}}} {}\mathrm {HOCH} {\vphantom {A}}_{\smash[{t}]{2}}{-}(\mathrm {CHOH} ){\vphantom {A}}_{\smash[{t}]{4}}{-}\mathrm {CH} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {OH} }}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a71b20c56d1dcc402825932c75948e4a967ea159)
![{\displaystyle {\mathrm {C} {\vphantom {A}}_{\smash[{t}]{6}}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{12}}\mathrm {O} {\vphantom {A}}_{\smash[{t}]{6}}{}\mathrel {\longrightarrow } {}2\,\mathrm {C} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{5}}\mathrm {OH} {}+{}2\,\mathrm {CO} {\vphantom {A}}_{\smash[{t}]{2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/10391a36810f20c44605c0ed6c868b8b95ecebe6)
![{\displaystyle {\mathrm {C} {\vphantom {A}}_{\smash[{t}]{6}}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{12}}\mathrm {O} {\vphantom {A}}_{\smash[{t}]{6}}{}\mathrel {\longrightarrow } {}\mathrm {CH} {\vphantom {A}}_{\smash[{t}]{3}}\mathrm {CH} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {CH} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {COOH} {}+{}2\,\mathrm {CO} {\vphantom {A}}_{\smash[{t}]{2}}{}+{}2\,\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e420e2d0b0d1a35f21a1827e286885e1bc6184c9)
![{\displaystyle {\mathrm {C} {\vphantom {A}}_{\smash[{t}]{6}}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{12}}\mathrm {O} {\vphantom {A}}_{\smash[{t}]{6}}{}\mathrel {\longrightarrow } {}2\,\mathrm {CH} {\vphantom {A}}_{\smash[{t}]{3}}{-}\mathrm {CHOH} {-}\mathrm {COOH} }}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bb22aa76f4c5fb1937c3e6b5258a8a1895199772)
![{\displaystyle {\mathrm {C} {\vphantom {A}}_{\smash[{t}]{6}}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{12}}\mathrm {O} {\vphantom {A}}_{\smash[{t}]{6}}{}\mathrel {\longrightarrow } {}\mathrm {HOOC} {-}\mathrm {CH} {\vphantom {A}}_{\smash[{t}]{2}}{-}\mathrm {C} (\mathrm {OH} )(\mathrm {COOH} ){-}\mathrm {CH} {\vphantom {A}}_{\smash[{t}]{2}}{-}\mathrm {COOH} {}+{}2\,\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} }}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ad6d553727f59892fb52fc35fa85c031d01793a8)
![{\displaystyle {(\mathrm {C} {\vphantom {A}}_{\smash[{t}]{6}}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{10}}\mathrm {O} {\vphantom {A}}_{\smash[{t}]{5}})\mathrm {n} {}\mathrel {\xrightarrow[{\text{t°}}]{\text{H+}}} {}n\,\mathrm {C} {\vphantom {A}}_{\smash[{t}]{6}}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{12}}\mathrm {O} {\vphantom {A}}_{\smash[{t}]{6}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4aeadee11234eb7c3d702075e6daa47b408654d4)
![{\displaystyle {6\,\mathrm {CO} {\vphantom {A}}_{\smash[{t}]{2}}{}+{}12\,\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} {}\mathrel {\xrightarrow[{\text{sunlight}}]{\text{chlorophyll}}} {}\mathrm {C} {\vphantom {A}}_{\smash[{t}]{6}}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{12}}\mathrm {O} {\vphantom {A}}_{\smash[{t}]{6}}{}+{}6\,\mathrm {O} {\vphantom {A}}_{\smash[{t}]{2}}{}+{}6\,\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} }}](https://wikimedia.org/api/rest_v1/media/math/render/svg/07e914a59d666c55aaa88d81d0eb720c9503ae29)