Hiệu Suất Trong Tổng Hợp NH3 - Bài Tập Amoniac
Có thể bạn quan tâm
Nâng cấp gói Pro để trải nghiệm website VnDoc.com KHÔNG quảng cáo, và tải file cực nhanh không chờ đợi.
Tìm hiểu thêm » Mua ngay Từ 79.000đ Hỗ trợ ZaloDạng bài hiệu suất trong tổng hợp NH3
- I. Phương pháp giải dạng bài Hiệu suất trong tổng hợp NH3
- II. Bài tập vận dụng liên quan
- III. Bài tập luyện tập hiệu suất tổng hợp NH3
Chuyên đề Hóa học lớp 11: Hiệu suất trong tổng hợp NH3 được VnDoc sưu tầm và giới thiệu tới các bạn học sinh cùng quý thầy cô tham khảo. Nội dung tài liệu sẽ giúp các bạn học sinh biết cách giải bài tập hiệu suất của NH3. Từ đó vận dụng thành thạo vào các dạng bài tập, câu hỏi liên quan, học tốt môn Hóa học lớp 11 hiệu quả hơn. Mời các bạn tham khảo.
I. Phương pháp giải dạng bài Hiệu suất trong tổng hợp NH3
Phương pháp
Thực tế, do một số nguyên nhân, một số phản ứng hóa học xảy ra không hoàn toàn, nghĩa là hiệu suất phản ứng (H%) dưới 100%. Có các cách tính sau:
Nếu là chất tham gia: H% = mpư/mbđ . 100%
Nếu là sản phẩm: H% = mtt/mltđ . 100%
II. Bài tập vận dụng liên quan
Bài 1: Để điều chế 68 gam NH3 cần lấy bao nhiêu lít N2 và H2 ở đktc. Biết hiệu suất phản ứng là 20%.
Đáp án hướng dẫn giải bài tập
N2 + 3H2 ⇌ 2NH3
Vì hiệu suất phản ứng (1) là 20% nên thực tế cần:
Thể tích N2 (đktc) là: 2.22,4/20% = 22,4 lít
Thể tích H2 (đktc) là: 6.22,4/20% = 672 lít
Bài 2: Trong bình phản ứng có chứa hỗn hợp khí A gồm 10 mol N2 và 40 mol H2 ở nhiệt đô 00C và 10 atm. Sau khi Phản ứng tổng hợp NH3, lại đưa bình về 00C. Biết rằng có 60% hidro tham gia phản ứng
a) Tính số mol các khí trong bình sau phản ứng.
b) Tính áp suất trong bình sau phản ứng
Đáp án hướng dẫn giải bài tập
Phản ứng tổng hợp NH3 xảy ra theo tỉ lệ:
nN2: nH2 = 1 : 3
Bài cho: nN2 : nH2 = 10 : 40 = 1 : 4. Vậy H2 dư nhiều hơn.
Phải dựa vào số mol N2 phản ứng để tính số mol NH3:
a) Phương trình phản ứng:
N2 + 3H2 ⇌ 2NH3
Số mol ban đầu: 10 40 0 mol
Số mol phản ứng: 8 24 16 mol
Số mol sau pư: 2 16 16 mol
Vậy số mol các khi trong bình sau phản ứng là: 4 mol N2; 16 mol H2; 12 mol NH3.
2 + 16 + 16 = 34 mol
b) Tổng số mol khí trong bình ban đầu: 10 + 40 = 50 mol
Vì PV + nRT mà ở đây VB, TB không đổi, nên ta có
Ps/Pđ = ns/nđ => ps = 34.10/50 = 6,8 atm
Bài 3: Cho 4 lít N2; 14 lít H2 vào bình phản ứng hỗn hợp thu được sau phản ứng có thể tích 16,4 lít (đktc). Hiệu suất của phản ứng tổng hợp NH3 bao nhiêu
Đáp án ướng dẫn giải bài tập
N2+ 3H2 ⇌ 2NH3
Ở cùng điều kiện thì tỉ lệ về thể tích chính là tỉ lệ về số mol
Do ![]() \(\frac{4}{1}\) <
\(\frac{4}{1}\) <![]() \(\frac{14}{3}\) →Hiệu suất tính theo N2
\(\frac{14}{3}\) →Hiệu suất tính theo N2
Đặt thể tích N2 phản ứng là x lít
→VH2 pứ= 3x lít, VNH3 sinh ra = 2xlít
VN2 dư= 4-x (lít), VH2 dư = 14-3x (lít)
Sau phản ứng thu được N2 dư, H2 dư, NH3
Tổng thể tích khí thu được là
V khí= VH2 dư + VN2 dư + VNH3 = 14-3x + 4-x+ 2x = 16,4
→ x = 0,8 lít
 \(H\ =\ \frac{V_{N_2pứ}}{V_{N_2bđ}}.100\%=\frac{0,8}{4}.100\%\ =20\%\)
\(H\ =\ \frac{V_{N_2pứ}}{V_{N_2bđ}}.100\%=\frac{0,8}{4}.100\%\ =20\%\)
Bài 4: Từ 34 tấn NH3 sản xuất 160 tấn HNO3 63%. Hiệu suất của phản ứng điều chế HNO3
Đáp án hướng dẫn giải bài tập
Phương trình hóa học
4NH3 + 5O2 → 4NO + 6H2O
2NO + O2 → 2NO2
4NO2 + 2H2O + O2 → 4HNO3
m(HNO3) = 160.63% = 100,8 (tấn)
n(NH3) = 34/17 = 2 mol
=> m(HNO3 thực tế) = 2.63 = 126 (tấn)
Vậy H = 100,8/126 = 80%.
Bài 5: Điều chế 17 gam NH3 cần dùng thể tích khí N2 và H2 lần lượt là (biết H = 25%, các khí đo được ở đktc)
Đáp án hướng dẫn giải bài tập
N2 + 3H2 ⇔ 2NH3
0,5 1,5 1
=> Thể tích N2 cần: ![]() \(V_{N_2}=\frac{n_{N_2}.22,4}{H}.100=44,8\ lit\)
\(V_{N_2}=\frac{n_{N_2}.22,4}{H}.100=44,8\ lit\)
![]() \(V_{H_2}=\frac{n_{H_2}.22,4}{H}.100=134,4\ lit\)
\(V_{H_2}=\frac{n_{H_2}.22,4}{H}.100=134,4\ lit\)
Bài 6. Một hỗn hợp khí gồm N2 và H2 có tỉ khối đối với hidro là 3,6. Đun nóng hỗn hợp 1 thời gian rồi đưa về được ban đầu thì hồn hợp mới có tỉ khối với hidro là 4,5.
a. Tính thành phần % về thể tích của mõi khí trong hỗn hợp trước và sau phản ứng
b. Tính hiệu suất
Hướng dẫn giải bài tập
Áp dụng phương pháp đường chéo, ta có
28 52
36.2
2 20.8
nN2/nH2 = 1/4
Phương trình hóa học: N2 + 3H2 → 2NH3
Ban đầu: 1 4 0
Phản ứng x 3 x 2x
Sau 1- x 4-3x 2x
Ta có: m trước = msau => 7,2.nt = 8 ns
=> nt/ns = 10/9
=> x = 0,25
Vậy H% = x/1 = 0,25% (tính theo N2 vì tỉ lệ ban đầu so với hệ số tỉ lượng thì H2 dư nhiều hơn N2)
III. Bài tập luyện tập hiệu suất tổng hợp NH3
Bài 1: Thực hiện tổng hợp amoniac từ N2 + 3H2 ⇔ 2NH3. Nồng độ ban đầu các chất: [N2] = 1M, [H2] = 1,2 M. Khi phản ứng đạt cân bằng [NH3] = 0,2M. Hiệu suất phản ứng tổng hợp
Đáp án hướng dẫn giải bài tập
N2 + 3H2 ⇔ 2NH3
Ban đầu 1mol/l 1,2 mol.l
Cân bằng 0,3 mol/l 0,2 mol/lit
Theo phương trình hóa học thì 1 mol N2 cần 3 mol H2. Ở đây chỉ có 1,2 mol H2, vì H2 thiếu nên tác dụng hết. Hiệu suất phải tính theo lượng chất tác dụng hết. Số mol H2 đã tác dụng là 0,3 mol.
Vậy H = (0,3 : 1,2). 100 = 25%
Bài 2: Hỗn hợp X gồm N2 và H2 có tỉ khối so với He là 1,8. Đun nóng X một thời gian trong bình kín có bột Fe làm xúc tác, thu được hỗn hợp Y có tỉ khối so với He là 2. Hiệu suất phản ứng tổng hợp là
Đáp án hướng dẫn giải bài tập

Giả sử số mol N2 là 1mol, số mol H2 là 4 mol
Phương trình: N2 + 3H2 ⇔ 2NH3
Ban đầu 1 4
Phản ứng x 3x 2x
sau 1-x 4-3x 2x
nsau= 5-2x, ntrước= 5
Bảo toàn khối lượng msau = mtrước
Msau.nsau =Mtrước. ntrước
=> 2.4.(5-2x) =7,2.5
=> x=0,25
Tính hiệu suất theo N2
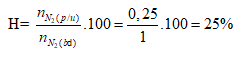
Câu 3. Điều chế NH3 từ đơn chất. Thể tích NH3 tạo ra là 67,2 lit. Biết hiệu suất phản ứng là 25%. Thể tích N2 (lit) cần là:
A. 13,44
B. 134,4
C. 403,2
D. 8,4 lít
Đáp án hướng dẫn giải bài tập
Phương trình hóa học
N2 + 3H2 ⇌ 2NH3
1 2
x 3
Ta có: nNH3 = 3 mol
Theo phương trình hóa học: nN2 = 1/2nNH3 = 1,5 mol
=> VH2 = 1,5.22,4 = 33,6 lít
Mà hiệu suất H% = 25%
VN2 = 33,6/25% = 8,4 lít
Câu 4. Cho 2 lít N2 và 7,5 lít H2 vào bình phản ứng, hỗn hợp thu được sau phản ứng có thể tích bằng 8,2 lít (các thể tích khí được đo trong cùng điều kiện). Hiệu suất phản ứng là bao nhiêu?
A. 20%
B. 30%
C. 15 %
D. 40%
Đáp án hướng dẫn giải chi tiết
Phương trình phản ứng hóa học xảy ra
N2+ 3H2 ⇌ 2NH3 (1)
Ở cùng điều kiện thì tỉ lệ về thể tích chính là tỉ lệ về số mol
Do 2/1 > 7,5/3 → Hiệu suất tính theo H2
Đặt thể tích N2 phản ứng là x lít
→VH2 pứ = 3x lít, VNH3 sinh ra =2x lít
VN2 dư= 2 - x (lít), VH2 dư= 7,5 - 3x (lít)
Sau phản ứng thu được N2 dư, H2 dư, NH3
Tổng thể tích khí thu được là
Vkhí = VH2 dư + VN2 dư + VNH3 = 7,5 - 3x + 2 - x + 2x = 8,2
→ x = 0,8 lít => H = VN2 pư/VN2 bd .100% = 0,8/4.100% = 20%
Câu 5. Cho hỗn hợp N2 và H2 vào bình phản ứng có nhiệt độ không đổi. Sau thời gian phản ứng, áp suất khí trong bình giảm 5% so với áp suất ban đầu. Biết ti lệ số mol của nitơ đã phản ứng là 10%. Thành phần phần trăm về số mol của N2 và H2 trong hỗn hợp đầu là:
A. 15% và 85%
B. 82,35% và 77,5%
C. 25% và 75%
D. 22,5% và 77,5%.
Đáp án hướng dẫn giải chi tiết
Giả sử số mol ban đầu của N2 = 1 mol; số mol của H2 ban đầu là x mol
Ta có nN2 pư = 1.10/100 = 0,1 mol
Phương trình phản ứng: N2 + 3H2 ⇌ 2NH3
Ban đầu: 1 x
Phản ứng: 0,1 0,3 0,2
Sau phản ứng: 0,9 x − 0,3 0,2
n ban đầu = 1 + x (mol)
nsau = 0,8 + x (mol)
nbđ /ns = pđầu/ps => (1 + x)/(0,8 + x) = 100/95 => x = 3 mol
%VN2 = 1/(1+3).100% = 25%
%VH2 = 75%
Câu 6. Dẫn 2,24 lít NH3 (đktc) đi qua ống đựng 32 gam CuO nung nóng thu được chất rắn A và khí B. Ngâm chất rắn A trong dung dịch HCl 2M dư. Tính thể tích dung dịch axit đã tham gia phản ứng ? Coi hiệu suất quá trình phản ứng là 100%
A. 0,10 lít.
B. 0,52 lít.
C. 0,25 lít.
D. 0,35 lít.
Đáp án hướng dẫn giải chi tiết
nNH3 = 0,1 mol, nCuO = 0,4 mol.
Phương trình phản ứng:
2NH3 + 3CuO → 3Cu + N2 + 3H2O (1)
mol: 0,1 0,4 → 0,15
=> nCuO dư = 0,4 - 0,15 = 0,25 mol
A gồm Cu (0,15 mol) và CuO dư (0,25 mol)
Phản ứng của A với dung dịch HCl :
CuO + 2HCl → CuCl2 + H2O (2)
mol: 0,25 → 0,5
Theo (2) và giả thiết ta suy ra:
VHCl = 0,5/2 = 0,25 lít.
......................................
Từ khóa » Cách Tính Khối Lượng Nh3
-
1)Tính Khối Lượng NH3 Thu được Khi Cho 56 Gam N2 Td Với H2 Dư ...
-
NH3 (Amoniac) Khối Lượng Mol - ChemicalAid
-
Tính Thể Tích NH3 Tạo Thành Và Hiệu Suất Của Phản ứng - Hoc247
-
Tính Khối Lượng Của Mol Của NH3, CO, CO2, N2? - Long Lanh
-
Hãy Tính Khối Lượng Của 11,2 Lít Khí Amoniac NH3 (đktc) - Hoc24
-
Hãy Tính Khối Lượng Của 11,2 Lít Khí Amoniac NH3 (đktc) - Hoc24
-
NH3 Là Gì? Tính Chất, Nguồn Gốc, ứng Dụng, Cách điều Chế & Lư ý Khi ...
-
Khối Lượng Của NH3 Có Trong 2,24 Lít NH3 điều Kiện Tiêu Chuẩn
-
Amonia – Wikipedia Tiếng Việt
-
1)Tính Khối Lượng NH3 Thu được Khi Cho 56 Gam N2 Td Với H2 ...
-
Các Công Thức Tính Thể Tích Hóa Học Và Khối Lượng ... - Marathon
-
Phương Pháp Giải Bài Toán Về Hiệu Xuất Tổng Hợp Amoniắc ở Lớp 11 ...
-
Khối Lượng NH3 Và Dung Dịch HNO3 45% đủ để điều Chế 100 Kg ...
-
Tính Thể Tích Khí N2 Và H2 (đktc) Cần để điều Chế được 34g NH3 Nếu ...