HNO3 Là Gì? Những Lưu Ý Của Axit Nitric
Có thể bạn quan tâm
Axit Nitric – HNO3 là gì? Đặc tính Lý hóa của Axit nitric – HNO3 như thế nào? Và quy trình điều chế axit nitric HNO3 cũng như Ứng dụng của axit nitric trong thực tiễn. Bên cạnh đó, liệu axit nitric có độc hại hay không, biện pháp xử lý sự cố do axit nitric gây ra và Những lưu ý khi sử dụng axit nitric. Cuối cùng là nơi mua axit nitric chất lượng và an toàn.
Có lẽ chúng ta đã không quá xa lạ với cái tên này. Và hôm nay, trong bài viết hôm nay, Trung Sơn sẽ giúp bạn hiểu rõ hơn nữa Axit Nitric – HNO3 là gì? Hãy cùng theo dõi bài viết dưới đây.
AXIT NITRIC – HNO3 LÀ GÌ?
Axit Nitric – HNO3 là gì?

Axit nitric là hợp chất vô cơ có công thức hóa học HNO3 – được xem làm một dung dịch nitrat hidro hay còn được gọi là axit nitric khan. Loại axit này được hình thành trong tự nhiên, do trong những cơn mưa do sấm và sét tạo thành. Axit nitric tinh khiết là chất lỏng không màu, bốc khói mạnh trong không khí ẩm và là một chất axit độc và ăn mòn và dễ gây cháy.
Nếu một dung dịch có hơn 86% axit nitric, nó được gọi là axit nitric bốc khói. Axit nitric bốc khói có đặc trưng axit nitric bốc khói trắng và axit nitric bốc khói đỏ, tùy thuộc vào số lượng nitơ đioxit hiện diện.
 +
+Hóa chất Nitric acid 65% – Merck
Tư vấn ngay- Điểm sôi: 121 ° C (1013 hPa)
- Tỉ trọng: 1,39 g / cm3 (20 ° C)
- Độ nóng chảy: -32 ° C
- Giá trị pH: <1 (H₂O, 20 ° C) axit mạnh
- Áp suất hơi: 9,4 hPa (20 ° C)
- Cấp Thuốc thử: Ph Eur, ISO
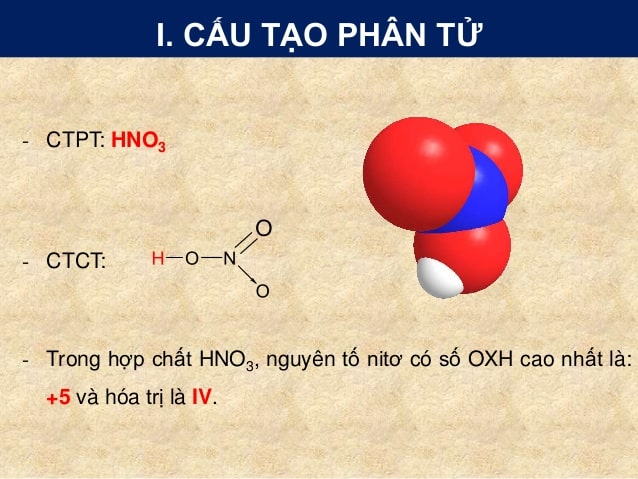
Cấu tạo phân tử Axit Nitric – HNO3
ĐẶC TÍNH LÝ HOA CỦA AXIT NITRIC – HNO3
Tính chất vật lý của axit nitric
| Tính chất | |
|---|---|
| Công thức hóa học | H N O 3 |
| Khối lượng phân tử | 63.012 g · mol −1 |
| Ngoại quan | Chất lỏng bốc khói không màu, vàng hoặc đỏ |
| Mùi | vị chát, ngột ngạt |
| Tỉ trọng | 1,51 g cm 3 , 1,41 g cm 3 [68% w / w] |
| Độ nóng chảy | −42 ° C (−44 ° F; 231 K) |
| Điểm sôi | 83 ° C (181 ° F; 356 K) dung dịch 68% sôi ở 121 ° C (250 ° F; 394 K) |
| độ hòa tan trong nước | Hoàn toàn có thể trộn được |
| đăng nhập P | .130,13 |
| Áp suất hơi | 48 mmHg (20 ° C) |
| Độ axit (p K a ) | −1.4 |
| Cơ sở liên hợp | Nitrat |
| Nhạy cảm từ (χ) | 1,99 × 10 −5 cm 3 / mol |
| Chỉ số khúc xạ ( n D ) | 1.394 (16,5 ° C) |
| Khoảnh khắc lưỡng cực | 2,17 ± 0,02 D |
| Nhiệt hóa học | |
| Entropy mol std ( S o 298 ) | 146 J · mol · 1 · K 1 |
| Entanpy Std của hình (Δ f H ⦵ 298 ) | −207 kJ · mol 1 |
 +
+Hóa chất Nitric Acid Ar – HNO3 – 500ml – Xilong – 7697-37-2.500 – TQ
Tư vấn ngay- Thương hiệu: Xilong – Trung Quốc
- Quy cách: 500gram/ lọ
- Khối lượng riêng: 1,52 g/cm3
- Điểm nóng chảy: -42 °C
- Khối lượng phân tử: 63,01 g/mol
- Điểm sôi: 83 °C
Tính chất hóa học của HNO3
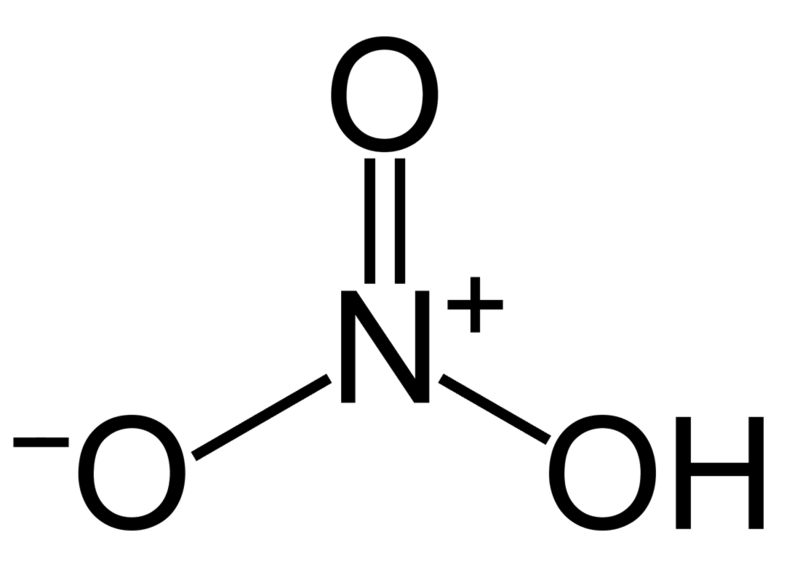
Axit nitric là một dung dịch nitrat hydro có công thức hóa học HNO3 . Đây là một axit khan, là một monoaxit mạnh, có tính oxy hóa mạnh có thể nitrat hóa nhiều hợp chất vô cơ, có hằng số cân bằng axit (pKa) = −2.
Axit nitric là một monoproton chỉ có một sự phân ly nên trong dung dịch, nó bị điện ly hoàn toàn thành các ion nitrat NO3− và một proton hydrat, hay còn gọi là ion hiđroni.
H3O+ HNO3 + H2O → H3O+ + NO3-
– Axit nitric có tính chất của một axit bình thường nên nó làm giấy quỳ tím chuyển sang màu đỏ.
– Tác dụng với bazo, oxit bazo, muối cacbonat tạo thành các muối nitrat
2HNO3 + CuO → Cu(NO3)2 + H2O
2HNO3 + Mg(OH)2 → Mg(NO3)2 + 2H2O
2HNO3 + CaCO3 → Ca(NO3)2 + H2O + CO2
– Axit nitric tác dụng với kim loại: Tác dụng với hầu hết các kim loại trừ Au và Pt tạo thành muối nitrat và nước .
Kim loại + HNO3 đặc → muối nitrat + NO + H2O ( to)
Kim loại + HNO3 loãng → muối nitrat + NO + H2O
Kim loại + HNO3 loãng lạnh → muối nitrat + H2
Mg(rắn) + 2HNO3 loãng lạnh → Mg(NO3)2 + H2 (khí)
– Nhôm, sắt, crom thụ động với axit nitric đặc nguội do lớp oxit kim loại được tạo ra bảo vệ chúng không bị oxy hóa tiếp.
– Tác dụng với phi kim (các nguyên tố á kim, ngoại trừ silic và halogen) tạo thành nito dioxit nếu là axit nitric đặc và oxit nito với axit loãng và nước, oxit của phi kim.
C + 4HNO3 đặc → 4NO2 + 2H2O + CO2
P + 5HNO3 đặc → 5NO2 + H2O + H3PO4
3C + 4HNO3 loãng → 3CO2 + 4NO + 2H2O
– Tác dụng với oxit bazo, bazo, muối mà kim loại trong hợp chất này chưa lên hóa trị cao nhất:
FeO + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O
FeCO3 + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O + CO2
– Tác dụng với hợp chất:
3H2S + 2HNO3 (>5%) → 3Skết tủa + 2NO + 4H2O
PbS + 8HNO3 đặc → PbSO4 kết tủa + 8NO2 + 4H2O
Ag3PO4 tan trong HNO3, HgS không tác dụng với HNO3.
– Tác dụng với nhiều hợp chất hữu cơ: Axit nitric có khả năng phá hủy nhiều hợp chất hữu cơ, nên sẽ rất nguy hiểm nếu để axit này tiếp xúc với cơ thể người.
QUY TRÌNH ĐIỀU CHẾ AXIT NITRIC – HNO3

Điều chế axit nitric trong phòng thí nghiệm
Người ta cho muối natri nitrat tinh thể tác dụng với axit sunfuric đặc, chưng cất hỗn hợp này tại nhiệt độ sôi của axit nitric là 83 °C cho đến khi còn lại chất kết tinh màu trắng theo phương trình như sau:
H2SO4 đặc + NaNO3 (tinh thể) → HNO3 + NaHSO4
Axit nitric bốc khói đỏ thu được có thể chuyển thành axit nitric màu trắng. Khi thực hiện thí nghiệm , các dụng cụ phải làm từ thủy tinh, đặc biệt là bình cổ cong nguyên khối do axit nitric khan.
Hoặc:
Axit nitric có thể được tạo ra bằng cách phân hủy nhiệt của đồng (II) nitrat , tạo ra khí nitơ dioxide và khí oxy, sau đó được truyền qua nước để tạo ra axit nitric.
2Cu(NO3) 2 → 2 CuO + 4 NO 2 + O 2
4 NO 2 + O2 →HNO2 +HNO3
Điều chế HNO3 trong công nghiệp
Axit nitric loãng có thể cô đặc đến 68% axit với một hỗn hợp azeotropic với 32% nước. Để thu được axit có nồng độ cao hơn, tiến hành chưng cất với axit sunfuric H2SO4. H2SO4 đóng vai trò là chất khử sẽ hấp thụ lại nước.
4NH3 + 5O2 → 4NO + 6H2O (Pt, 850oC)
2NO + O2 → NO2
4NO2 + O2 + 2H2O → 4HNO3
Dung dịch axit nitric công nghiệp thường có nồng độ 52% và 68%. Việc sản xuất axit nitric được thực hiện bằng công nghệ Ostwald do Wilhelm Ostwald phát minh.
Tham khảo thêm bài viết khác: Thuốc tím KMNO4 là gì? Tìm hiểu chi tiết về thuốc tím KMN04
 +
+Hóa chất Nitric acid 68% – Prolabo
Tư vấn ngay- Thương hiệu: Prolabo
- Sản phẩm chính hãng
- Giá cả cạnh tranh
- Có đầy đủ COA
- Giao hàng tận nơi, nhanh chóng
ỨNG DỤNG CỦA AXIT NITRIC – HNO3
Trong phòng thí nghiệm
– Axit nitric là thuốc thử chính được sử dụng cho quá trình nitrat hóa – việc bổ sung một nhóm nitro, điển hình là một phân tử hữu cơ. Và nó cũng thường được sử dụng như một tác nhân oxy hóa mạnh.
– Axit nitric cũng được sử dụng trong phòng thí nghiệm trường học để tiến hành các thí nghiệm liên quan đến việc thử clorit. Cho axit nitric tác dụng với mẫu thử, sau đó cho dung dịch bạc nitrat vào để tìm kết tủa trắng của bạc clorua.
Trong công nghiệp
– Axit nitric 68% được sử dụng để chế tạo thuốc nổ bao gồm nitroglycerin, trinitrotoluen (TNT) và cyclotrimethylenetrinitramin (RDX).
– Axit nitric có nồng độ 0,5-2% được sử dụng làm hợp chất nền nhằm xác định trong dung dịch có tồn tại kim loại không. Người ta gọi đó là kỹ thuật ICP-MS và ICP-AES.
– Đồng thời axit còn ứng dụng trong ngành luyện kim, xi mạ và tinh lọc. Khi cho axit này kết hợp với axit clorua, ta được dung dịch nước cường toan có khả năng hòa tan bạch kim và vàng.
– Sử dụng axit nitric để sản xuất các chất hữu cơ, bột màu, sơn, thuốc nhuộm vải và thuốc tẩy màu.
– Axit nitric được dùng để sản xuất nitrobenzen – tiền chất để sản xuất anilin và các dẫn xuất anilin với những ứng dụng then chốt trong sản xuất bọt xốp polyuretan, sợi aramit và dược phẩm.
– Trong một nồng độ thấp (khoảng 10%), axit nitric thường được dùng để nhân tạo thông và maple . Màu sắc được tạo ra là một màu vàng xám rất giống như gỗ cũ hoặc gỗ hoàn thiện
– Axit nitric cũng là hợp chất trung gian dùng trong sản xuất bọt xốp polyuretan mềm và các sản phẩm polyuretan khác, ví dụ các chất kết dính, các chất bịt kín, các chất bọc phủ và các chất đàn hồi, đi từ nguyên liệu toluen diisoxyanat.
– Dùng làm chất tẩy rửa các đường ống, bề mặt kim loại trong các nhà máy sữa.
– Axit nitric được dùng để loại bỏ các tạp chất, cân bằng lại độ tiêu chuẩn của nước.
– Sử dụng trong sản xuất phân bón, được sử dụng chủ yếu để sản xuất phân đạm, các muối nitrate ngành phân bón như KNO3, Ca(NO3)2,…
 +
+Hóa chất Nitric acid 65% – Prolabo
Tư vấn ngay- Thương hiệu: Prolabo
- Sản phẩm chính hãng
- Giá cả cạnh tranh
- Có đầy đủ COA
- Giao hàng tận nơi, nhanh chóng
CẢNH BÁO NGUY HIỂM CỦA AXIT NITRIC

Những tổn thương khi tiếp xúc HNO3
– Tiếp xúc theo đường mắt: Gây kích ứng có thể gây bỏng làm mù lòa.
– Tiếp xúc theo đường thở: Gây kích ứng nghiêm trọng. Hít phải có thể gây khó thở và dẫn đến viêm phổi và tử vong. Triệu chứng khác bao gồm: Ho, nghẹt thở, kích ứng mũi và đường hô hấp.
– Tiếp xúc theo đường da: Gây kích ứng, mẫn đỏ, đau và bỏng nặng.
– Tiếp xúc theo đường tiêu hóa: nếu nuốt phải có thể gây cháy miệng, dạ dày.
– Phơi nhiễm lâu có thể dẫn tới ung thư.
Biện pháp xử lý sự cố do axit nitric gây ra?
– Hít phải: tìm kiếm không khí trong lành và chăm sóc y tế ngay lập tức.
– Tiếp xúc mắt: ngay lập tức rửa mắt bằng nhiều nước trong ít nhất 15 phút để ngăn ngừa tổn thương thêm, sau đó lập tức tìm kiếm sự chăm sóc y tế.
– Tiếp xúc với da: ngay lập tức rửa sạch vùng bị ảnh hưởng với nhiều nước trong ít nhất 15 phút. Loại bỏ quần áo bị ô nhiễm và rửa bằng xà bông. Chăm sóc y tế ngay lập tức khi được yêu cầu.
– Nuốt phải: súc miệng bằng nước hoặc sữa. Lưu ý rằng không được phép cho bất cứ thứ gì vào miệng của nạn nhân khi họ đã bất tỉnh để tránh những trường hợp kích ứng. Tìm kiếm sự chăm sóc y tế nhanh nhất có thể.
Chính vì vây, bạn nên trang bị đầy đủ những thiết bị bảo hộ an toàn như kính mắt, khẩu trang, mũ, găng tay, quần áo dài tay, giày,…và thường xuyên giữ cho nơi làm việc được sạch sẽ, thông thoáng, để xa những đồ dễ cháy nổ.
NHƯNG LƯU Ý KHI SỬ DỤNG AXIT NITRIC
– Axit nitric là chất oxy hóa mạnh, khi tác dụng với cyanit, bột kim có thể phát nổ và tự bốc cháy khi phản ứng với turpentine.
– Ở nồng độ đậm đặc, nó gây bỏng da do phản ứng với protein keratin, khiến da chuyển sang màu vàng. Khi được trung hòa sẽ chuyển thành màu cam.
– Có thể phản ứng mạnh với kim loại tạo thành khí hydro dễ cháy trong không khí.
– Khi pha loãng, tuyệt đối không được đổ nước vào axit mà phải cho axit vào nước.
NƠI LƯU TRỮ HOÁ CHẤT AN TOÀN
– Lưu trữ axit nitric trong một khu vực an toàn cách xa các vật liệu không tương thích như hợp chất hữu cơ, kim loại, rượu hoặc hơi ẩm.
– Nền nhà phải chống được axit.
– Khu vực lưu trữ phải thoáng mát, tránh xa các nguồn nhiệt.
– Các thùng chứa phải đậy nắp kín, tránh ánh nắng mặt trời.
– Sử dụng các thùng chứa bằng nhựa thay cho kim loại vì axit nitric không tác dụng với chất liệu này.
MUA AXIT NITRIC CHẤT LƯỢNG VÀ AN TOÀN

Nếu bạn đang muốn tìm mua sản phẩm Axit nitric trên thị trường thì đừng nên bỏ qua Công ty TRUNG SƠN. Chúng tôi là một trong những địa chỉ tin cậy chuyên cung cấp các loại hóa chất công nghiệp, hóa chất tinh khiết uy tín.
Bạn sẽ không tìm được nơi nào cung cấp sản phẩm chất lượng và nguồn gốc uy tín giống như công ty của chúng tôi. Ngoài ra bạn còn nhận được sự tư vấn nhiệt tình từ đội ngũ nhân viên lành nghề và vô cùng nhiệt tình.
Có lẽ sau khi theo dõi bài viết này của Công ty Trung Sơn thì các bạn đã trả lời được những câu hỏi ở đầu bài như Axit Nitric – HNO3 là gì? Axit Nitric – HNO3 có cấu tạo phân tử như thế nào? Các tính chất lý hóa của HNO3 ra sao? Axit Nitric – HNO3 được điều chế bằng cách nào? Và những ứng dụng vượt bật của axit hno3 cũng như cách sử dụng, bảo quản Axit Nitric – HNO3 đúng cách?
Nếu còn bất kỳ thắc mắc nào hoặc có nhu cầu mua sản phẩm thì hãy liên hệ trực tiếp tại website Trung Sơn hoặc bình luận ngay bên dưới bài viết này để được nhân viên chúng tôi hổ trợ.
Thông tin liên hệ:
- CÔNG TY TNHH CÔNG NGHỆ TRUNG SƠN
- Địa chỉ: 403 Nguyễn Thái Bình, P. 12, Q. Tân Bình, Tp.HCM
- MST: 0311835273
- Điện thoại: (028) 3811 9991 – Fax: (028) 3811 9993
- Email: [email protected]
- Website: https://tschem.com.vn
Tham khảo thêm: Natri Bicacbonat Là Gì? Những Điều Thú Vị Xoay Quanh Hoá Chất Này
YÊU CẦU CỦA KHÁCH HÀNG
Từ khóa » Viết Cthh Của Axit Nitric
-
Axit Nitric (HNO3) Là Gì? Tính Chất, ứng Dụng, Lưu ý - Vietchem
-
Bài 1 Viết CTHH Của: A) Axit Nitric (gồm 1H; 1N - Hoc24
-
Bài 1 Viết CTHH Của: A) Axit Nitric (gồm 1H; 1N; 3O) B) Khí ... - Hoc24
-
Viết Công Thức Hóa Học Của
-
Acid Nitric – Wikipedia Tiếng Việt
-
Viết CTHH Của: A) Axit Nitric (gồm 1H; 1N; 3O) B) Khí Gas (gồm 3C; 8H)
-
Bài 1: Viết CTHH Của: A) Axit Nitric (gồm 1H; 1N; 3O) B) Khí Gas (gồm ...
-
Viết Công Thức Hóa Học Của Axit Nitric (phân Tử ... - Trắc Nghiệm Online
-
Viết Công Thức Hóa Học Của Axit Nitric (phân Tử Gồm 1H, 1N ... - Hoc247
-
Công Thức Hóa Học Của Axit Nitric( Biết Trong Phân Tử Có 1H, 1N, 3O) Là:
-
Khái Niệm, CTHH, Phân Loại Và Cách Gọi Tên Axit - Bazo - Muối
-
Câu Hỏi Công Thức Hóa Học Của Axit Nitric Là Biết Trong Phân Tử
-
Công Thức Cấu Tạo Của HNO3 - TopLoigiai
-
Axit Là Gì? Công Thức Hóa Học Của Axit Là Gì? Tác Dụng - Tính Chất