Hoá Học 12 Bài 38: Luyện Tập Tính Chất Hóa Học Của Crom, đồng Và ...
Nội dung bài học lí giải cấu hình electron bất thường của nguyên tử Crom, đồng và các số oxi hóa thường gặp của chúng. Ngoài ra, các em sẽ được rèn luyện kĩ năng giải các bài tập, dạng toán quan trọng liên quan đến Crom, Đồng.
ATNETWORK YOMEDIA1. Video bài giảng
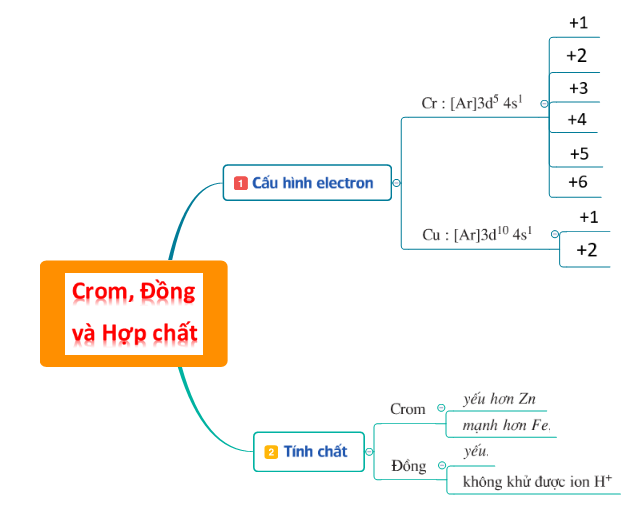
2. Tóm tắt lý thuyết
3. Bài tập minh hoạ
3.1. Bài tập Cơ bản
3.2. Bài tập Nâng cao
4. Luyện tập bài 38 Hóa học 12
4.1. Trắc nghiệm
4.2. Bài tập SGK & Nâng cao
5. Hỏi đáp về Bài 38 Chương 7 Hoá học 12

Tóm tắt lý thuyết
Kiến thức cần nắm
Bài tập minh họa
3.1. Bài tập Tính chất hóa học của crom, đồng và hợp chất của chúng - Cơ bản
Bài 1:
Hoàn thành sơ đồ phản ứng sau:
a. \(C{r_2}{O_3} \to Cr \to C{r_2}{(S{O_4})_3} \to Cr{\left( {OH} \right)_3} \to Na\left[ {Cr{{\left( {OH} \right)}_4}} \right]\)
b. \(CrC{l_3} \to {K_2}Cr{O_4} \to {K_2}C{r_2}{O_7} \to C{r_2}{\left( {S{O_4}} \right)_3} \to CrS{O_4} \to Cr{\left( {OH} \right)_2}\)
Hướng dẫn:
a. Chuỗi phản ứng như sau:
Cr2O3 + 2Al \(\overset{t^{0}}{\rightarrow}\) 2Cr + Al2O3
2Cr + 6H2SO4 \(\overset{t^{0}}{\rightarrow}\) Cr2(SO4)3 + 3SO2 + 6H2O
Cr2(SO4)3 + 6NaOH → 2Cr(OH)3 + 3Na2SO4
Cr(OH)3 + NaOH → Na[Cr(OH)4]
b. Chuỗi phản ứng như sau:
2CrCl3 + 3Cl2 + 16KOH → 2K2CrO4 + 12KCl + 8H2O
2K2CrO4 + H2SO4 → K2Cr2O7 + K2SO4 + H2O
K2Cr2O7 + 6FeSO4 + 7H2SO4 → 3Fe2(SO4)3 + K2SO4 + Cr2(SO4)3 + 7H2O
Cr2(SO4)3 + Zn → 2CrSO4 + ZnSO4
CrSO4 + 2NaOH → Cr(OH)2 + Na2SO4
Bài 2:
Cho dãy các phản ứng hóa học sau:
Cu + O2 → Chất A
Chất A + HCl→ Chất B + Nước
Chất B + Chất C → Tủa D + NaCl
Tủa D + HCl → Chất B
Các chất A, B, C, D trong các phản ứng trên là các chất nào?
Hướng dẫn:
2Cu + O2 → 2CuO
CuO + 2HCl→ CuCl2 + H2O
CuCl2 + 2NaOH → Cu(OH)2 + 2NaCl
Cu(OH)2 + 2HCl → CuCl2 + 2H2O
Vậy các chất A, B, C, D lần lượt là: CuO, CuCl2, NaOH,Cu(OH)2
Bài 3:
Dung dịch X gồm CuCl2 0,2M; FeCl2 0,3M; FeCl3 0,3M. Cho m (g) bột Mg vào 100ml dung dịch X khuấy đều đến khi phản ứng kết thúc thu được dung dịch B. Thêm dung dịch KOH dư vào B được kết tủa D. Nung D trong không khí đến khối lượng không đổi thu được 5,4 g chất rắn E. Giá trị của m là:
Hướng dẫn:
Nếu không có kim loại thoát ra ⇒ Chất rắn gồm Fe2O3; MgO, CuO Lại có: \(m_{Fe2O3} + m_{CuO} = 0,03 \times 160 + 0,02 \times 80 = f6,4g >5,4\) ⇒ Cu2+ giả sử phản ứng mất x mol Mg + 2Fe3+ → Mg2+ + 2Fe2+ Mg + Cu2+ → Mg2+ + Cu ⇒ nMg pứ = (0,015 + x) mol ⇒ chất rắn gồm: 0,03 mol Fe2O3; (0,02 - x) mol CuO; (0,015 + x) mol MgO ⇒ x = 0,04 mol ⇒ nFe pứ = 0,055 mol ⇒ m = 1,32 g
Bài 4:
Hòa tan hỗn hợp gồm 0,1 mol Zn; 0,05 mol Cu; 0,3 mol Fe trong dung dịch HNO3. Sau khi các kim loại tan hết thu được dung dịch không chứa NH4NO3 và khí NO là sản phẩm khử duy nhất, Số mol HNO3 tối thiểu cần dùng là:
Hướng dẫn:
Bảo toàn e ta được: 0,1 x 2 + 0,05 x 2 + 0,3x 2 = 3x ⇒ x = 0,3(mol). Ta có \(n_{HNO_3}= 4n_{NO} \Rightarrow n_{HNO_3} = 1,2 \ (mol)\). Cách khác: Tư duy: Hòa tan hết với lượng axit min khi các muối sinh ra đều là muối X(NO3)2. Vậy mol NO3− trong này bằng 2 lần tổng số mol kim loại. Mà các kim loại đều nhường 2e. Vậy mol khí NO = \(\frac{2}{3}\) tổng số mol kim loại ⇒ n NO3− = 2 tổng nKL +23 tổng nKL = naxit
3.2. Bài tập Tính chất hóa học của crom, đồng và hợp chất của chúng - Nâng cao
Bài 1:
Dung dịch X chứa m gam hỗn hợp CuSO4 và NaCl. Thực hiện điện phân dung dịch X cho đến khi nước bắt đầu điện phân ở cả 2 điện cực thì dừng lại, khi đó ở anot thoát ra 4,48 lít khí (đktc). Dung dịch sau điện phân có thể hòa tan tối đa 2,7 gam Al. Giá trị lớn nhất của m là:
Hướng dẫn:
Catot: Cu2+ + 2e → Cu Anot: 2Cl- → Cl2 + 2e 2H2O → 4H+ + O2 + 4e Khi 2 điện cực cùng thoát khí thì dừng ⇒ catot chưa điện phân nước Mà dung dịch sau điện phân phản ứng với Al ⇒ anot có điện phân nước ⇒ nH+ = 3nAl = 0,3 mol ⇒ \(n_{O_{2}}\) = 0,075 mol ⇒ \(n_{Cl_{2}}\) = nkhí – \(n_{O_{2}}\) = 0,125 mol Bảo toàn e: ne = 2nCu = \(2n_{Cl_{2}}+ 4n_{O_{2}}\) ⇒ nCu = 0,275 mol Ban đầu có: 0,275 mol CuSO4; 0,25 mol NaCl ⇒ m = 58,625g
Bài 2:
Thực hiện các phản ứng nhiệt nhôm hỗn hợp gồm m gam Al và 4,56 gam Cr2O3 (trong điều kiện không có O2), sau khi phản ứng kết thúc, thu được hỗn hợp X. Cho toàn bộ X vào một lượng dư dung dịch HCl (loãng, nóng), sau khi các phản ứng xảy ra hoàn toàn, thu được 2,016 lít H2 (đktc). Còn nếu cho toàn bộ X vào một lượng dư dung dịch NaOH (đặc, nóng), sau khi phản ứng kết thúc thì số mol NaOH đã phản ứng là:
Hướng dẫn:
Cr2O3: 0,03 mol
\(\begin{array}{l} 2Al + C{r_2}{O_3}\mathop \to \limits^{{t^0}} A{l_2}{O_3} + 2Cr\\ \begin{array}{*{20}{c}} {\begin{array}{*{20}{c}} {}&{} \end{array}}&{0,03 \to 0,03 \leftarrow 0,06} \end{array} \end{array}\)
X không có Al
\(\\ Cr\rightarrow H_2 \\ 0,06\rightarrow 0,6\)
nH2 (đề) = 0,09 > 0,06
\(\Rightarrow\) Al dư
\(\\ Al_{du}\rightarrow \frac{3}{2}H_2 \\ 0,02\leftarrow 0,03\)
X gồm:
Al dư: 0,02;
Al2O3: 0,03;
Cr: 0,06 (không phản ứng NaOH)
sản phẩm nhiệt nhôm tác dụng OH-
nOH- = nAl(ban đầu)
\(\Rightarrow\) NaOH(phản ứng) = 0,08
4. Luyện tập Bài 38 Hóa học 12
Sau bài học cần nắm: Tính chất hóa học của crom, đồng và hợp chất của chúng
4.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hoá học 12 Bài 38 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
Câu 1:
Bốn kim loại Na, Al, Fe và Cu được ấn định không theo thứ tự X, Y, Z, T. Biết: X, Y được điều chế bằng phương pháp điện phân nóng chảy; X đẩy được kim loại T ra khỏi dung dịch muối; Z tác dụng được với dung dịch H2SO4 đặc nóng nhưng không tác dụng được với dung dịch H2SO4 đặc nguội. X, Y, Z, T lần lượt là:
- A. Na; Fe; Al; Cu.
- B. Na; Al; Fe; Cu.
- C. Al; Na; Cu; Fe.
- D. Al; Na; Fe; Cu.
-
Câu 2:
Một mẫu khí thải ra được cho qua dung dịch CuSO4, thấy xuất hiện kết tủa màu đen. Hiện tượng này do khí thải có:
- A. SO2
- B. H2S
- C. CO2
- D. NO2
-
Câu 3:
Cho các dãy chất Cr2O3, Cr, Al, Al2O3, CuO, CrO3, NaH2PO4. Số chất trong dãy phản ứng được với dung dịch NaOH loãng là:
- A. 7.
- B. 4.
- C. 6.
- D. 5.
-
Câu 4:
Cặp kim loại nào sau đây bền trong không khí và nước do có màng oxit bảo vệ?
- A. Fe và Al.
- B. Fe và Cr.
- C. Mn và Cr.
- D. Al và Cr.
-
Câu 5:
Hòa tan hoàn toàn 3,84 gam Cu trong dung dịch HNO3 dư, thu được khí NO (sản phẩm khử duy nhất). Trộn lượng NO trên với O2 dư, thu được hỗn hợp khí Y. Sục Y vào nước dư, thu được dung dịch Z và còn lại khí O2 duy nhất. Tổng thể tích O2 (đktc) đã phản ứng là:
- A. 0,896 lít.
- B. 0,672 lít.
- C. 0,504 lít.
- D. 0,784 lít.
-
Câu 6:
Cho m gam bột Cu vào 400 ml dung dịch AgNO3 0,2M, sau một thời gian phản ứng thu được 7 gam hỗn hợp chất rắn (X) và dung dịch (Y). Lọc tách (X), rồi thêm 3,9 gam bột Zn vào dung dịch (Y), sau khi phản ứng xảy ra hoàn toàn thu được 6,14 gam chất rắn. Giá trị của m là:
- A. 6,40.
- B. 5,76.
- C. 3,20.
- D. 3,84.
-
Câu 7:
Thực hiện các phản ứng nhiệt nhôm hỗn hợp gồm m gam Al và 4,56 gam Cr2O3 (trong điều kiện không có O2), sau khi phản ứng kết thúc, thu được hỗn hợp X. Cho toàn bộ X vào một lượng dư dung dịch HCl (loãng, nóng), sau khi các phản ứng xảy ra hoàn toàn, thu được 2,016 lít H2 (đktc). Còn nếu cho toàn bộ X vào một lượng dư dung dịch NaOH (đặc, nóng), sau khi phản ứng kết thúc thì số mol NaOH đã phản ứng là:
- A. 0,06 mol
- B. 0,14 mol
- C. 0,08 mol
- D. 0,16 mol
Câu 8-20: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
4.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hoá học 12 Bài 38.
Bài tập 1 trang 166 SGK Hóa học 12
Bài tập 2 trang 166 SGK Hóa học 12
Bài tập 3 trang 167 SGK Hóa học 12
Bài tập 4 trang 167 SGK Hóa học 12
Bài tập 5 trang 167 SGK Hóa học 12
Bài tập 6 trang 167 SGK Hóa học 12
Bài tập 1 trang 225 SGK Hóa 12 Nâng cao
Bài tập 2 trang 225 SGK Hóa 12 Nâng cao
Bài tập 3 trang 225 SGK Hóa 12 Nâng cao
Bài tập 4 trang 126 SGK Hóa học 12 nâng cao
Bài tập 5 trang 226 SGK Hóa học 12 nâng cao
Bài tập 6 trang 226 SGK Hóa 12 Nâng cao
Bài tập 7 trang 226 SGK Hóa 12 Nâng cao
Bài tập 8 trang 226 SGK Hóa 12 Nâng cao
Bài tập 9 trang 226 SGK Hóa 12 Nâng cao
Bài tập 38.1 trang 93 SBT Hóa học 12
Bài tập 38.2 trang 93 SBT Hóa học 12
Bài tập 38.3 trang 93 SBT Hóa học 12
Bài tập 38.4 trang 93 SBT Hóa học 12
Bài tập 38.5 trang 93 SBT Hóa học 12
Bài tập 38.6 trang 94 SBT Hóa học 12
Bài tập 38.7 trang 94 SBT Hóa học 12
Bài tập 38.8 trang 94 SBT Hóa học 12
Bài tập 38.9 trang 94 SBT Hóa học 12
Bài tập 38.10 trang 94 SBT Hóa học 12
Bài tập 38.11 trang 94 SBT Hóa học 12
Bài tập 38.12 trang 94 SBT Hóa học 12
Bài tập 38.13 trang 94 SBT Hóa học 12
5. Hỏi đáp về Bài 38 Chương 7 Hoá học 12
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
 NONE
NONE Bài học cùng chương
 Hoá học 12 Bài 31: Sắt
Hoá học 12 Bài 31: Sắt  Hoá học 12 Bài 32: Hợp chất của sắt
Hoá học 12 Bài 32: Hợp chất của sắt  Hoá học 12 Bài 33: Hợp kim của sắt
Hoá học 12 Bài 33: Hợp kim của sắt  Hoá học 12 Bài 34: Crom và hợp chất của Crom
Hoá học 12 Bài 34: Crom và hợp chất của Crom  Hoá học 12 Bài 35: Đồng và hợp chất của Đồng
Hoá học 12 Bài 35: Đồng và hợp chất của Đồng  Hoá học 12 Bài 36: Sơ lược về niken, kẽm, chì, thiếc ADSENSE TRACNGHIEM
Hoá học 12 Bài 36: Sơ lược về niken, kẽm, chì, thiếc ADSENSE TRACNGHIEM  Bộ đề thi nổi bật
Bộ đề thi nổi bật  UREKA AANETWORK
UREKA AANETWORK 
XEM NHANH CHƯƠNG TRÌNH LỚP 12
Toán 12
Lý thuyết Toán 12
Giải bài tập SGK Toán 12
Giải BT sách nâng cao Toán 12
Trắc nghiệm Toán 12
Ôn tập Toán 12 Chương 3
Ngữ văn 12
Lý thuyết Ngữ Văn 12
Soạn văn 12
Soạn văn 12 (ngắn gọn)
Văn mẫu 12
Soạn bài Rừng xà nu
Tiếng Anh 12
Giải bài Tiếng Anh 12
Giải bài Tiếng Anh 12 (Mới)
Trắc nghiệm Tiếng Anh 12
Unit 11 Lớp 12 Books
Tiếng Anh 12 mới Review 2
Vật lý 12
Lý thuyết Vật Lý 12
Giải bài tập SGK Vật Lý 12
Giải BT sách nâng cao Vật Lý 12
Trắc nghiệm Vật Lý 12
Ôn tập Vật lý 12 Chương 4
Hoá học 12
Lý thuyết Hóa 12
Giải bài tập SGK Hóa 12
Giải BT sách nâng cao Hóa 12
Trắc nghiệm Hóa 12
Ôn tập Hóa học 12 Chương 5
Sinh học 12
Lý thuyết Sinh 12
Giải bài tập SGK Sinh 12
Giải BT sách nâng cao Sinh 12
Trắc nghiệm Sinh 12
Sinh Học 12 Chương 2 Sinh thái học
Lịch sử 12
Lý thuyết Lịch sử 12
Giải bài tập SGK Lịch sử 12
Trắc nghiệm Lịch sử 12
Lịch Sử 12 Chương 4 Lịch Sử VN
Địa lý 12
Lý thuyết Địa lý 12
Giải bài tập SGK Địa lý 12
Trắc nghiệm Địa lý 12
Địa Lý 12 PT và PB nông nghiệp
GDCD 12
Lý thuyết GDCD 12
Giải bài tập SGK GDCD 12
Trắc nghiệm GDCD 12
GDCD 12 Học kì 2
Công nghệ 12
Lý thuyết Công nghệ 12
Giải bài tập SGK Công nghệ 12
Trắc nghiệm Công nghệ 12
Công nghệ 12 Chương 4
Tin học 12
Lý thuyết Tin học 12
Giải bài tập SGK Tin học 12
Trắc nghiệm Tin học 12
Tin học 12 Chương 3
Cộng đồng
Hỏi đáp lớp 12
Tư liệu lớp 12
Xem nhiều nhất tuần
Video: Vợ nhặt của Kim Lân
Video ôn thi THPT QG môn Vật lý
Video ôn thi THPT QG Tiếng Anh
Video ôn thi THPT QG môn Hóa
Video ôn thi THPT QG môn Toán
Video ôn thi THPT QG môn Văn
Video ôn thi THPT QG môn Sinh
Đất Nước- Nguyễn Khoa Điềm
Vợ Nhặt
Chiếc thuyền ngoài xa
Rừng xà nu
Việt Bắc
Vợ chồng A Phủ
Những đứa con trong gia đình
Tuyên Ngôn Độc Lập
Khái quát văn học Việt Nam từ đầu CMT8 1945 đến thế kỉ XX
YOMEDIA YOMEDIA ×Thông báo
Bạn vui lòng đăng nhập trước khi sử dụng chức năng này.
Bỏ qua Đăng nhập ×Thông báo
Bạn vui lòng đăng nhập trước khi sử dụng chức năng này.
Đồng ý ATNETWORK ON QC Bỏ qua >>
QC Bỏ qua >> 
Từ khóa » Hoá Bài 38 Lớp 12
-
Giải Hóa 12 Bài 38: Luyện Tập: Tính Chất Hóa Học Của Crom, đồng Và ...
-
Bài 38. Luyện Tập: Tính Chất Hóa Học Của Crom, đồng Và Hợp Chất ...
-
Giải Bài Tập Hóa 12 Bài 38: Luyện Tập Tính Chất Hóa Học Của Crom ...
-
Bài 38: Luyện Tập: Tính Chất Hóa Học Của Crom, đồng Và Hợp Chất ...
-
Lý Thuyết Hóa 12: Bài 38. Luyện Tập. Tính Chất Hóa Học Của Crom ...
-
Giải Bài Tập Hóa 12 Bài 38: Luyện Tập: Tính Chất Hóa Học Của Crôm ...
-
Giải Bài 38 Hóa Học 12: Luyện Tập Tính Chất Hóa Học Của Crom, đồng ...
-
Giải Hóa 12 Bài 38: Luyện Tập SGK Trang 166, 167 đầy đủ Nhất
-
Luyện Tập: Tính Chất Hóa Học Của Crom, đồng Và Hợp Chất Của Chúng
-
Sách Giáo Khoa Hóa Học Lớp 12 Cơ Bản - Bài 38: Luyện Tập: Tính ...
-
Hướng Dẫn Giải Bài Tập SGK Hoá Học Lớp 12 Bài 38 - Ôn Thi HSG
-
Giải Câu 1 Trang 166 – Bài 38 – SGK Môn Hóa Học Lớp 12
-
Bài Tập Trắc Nghiệm Hóa Học Lớp 12 Bài 38