Hoá Học 9 Bài 32: Luyện Tập Chương 3
Có thể bạn quan tâm
- Trang chủ
- Học tập
- Bài học
- Bài học lớp 9
Nội dung bài giảng giúp học sinh hệ thống hoá lại các kiến thức trong chương như: tính chất của phi kim, muối cacbonat. Cấu tạo bảng tuần hoàn và sự biến đổi tuần hoàn tính chất của các nguyên tố trong chu kì, nhóm và ý nghĩa của bảng tuần hoàn.
Mục lục nội dung
1. Tóm tắt lý thuyết
1.1. Tính chất hóa học của phi kim
1.2. Tính chất hóa học của phi kim (cụ thể)
1.3. Bảng tuần hoàn các nguyên tố hóa học
2. Bài tập minh họa
2.1. Dạng 1: Xác định nguyên tố
2.2. Dạng 2: Tính chất muối cacbonat
2.3. Dạng 3: Tính chất của nguyên tố
3. Luyện tập
3.1. Bài tập tự luận
3.2. Bài tập trắc nghiệm
4. Kết luận

1. Tóm tắt lý thuyết
1.1. Tính chất hóa học của phi kim
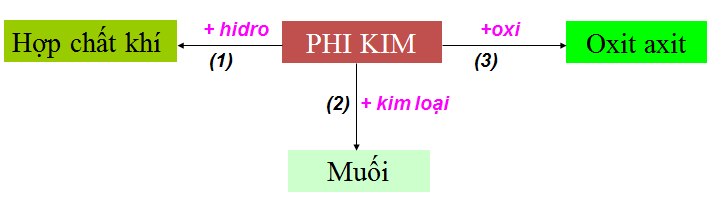
1.2. Tính chất hóa học của phi kim (cụ thể)
a. Tính chất hóa học của Clo
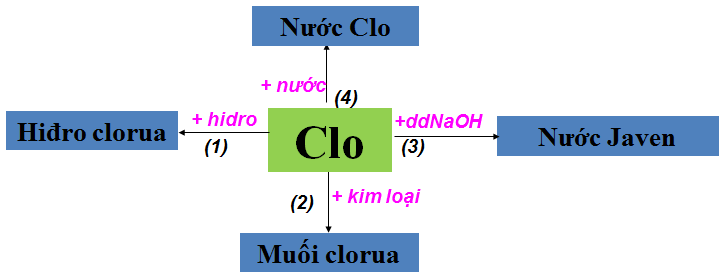
b. Tính chất hóa học của cacbon và hợp chất của cacbon
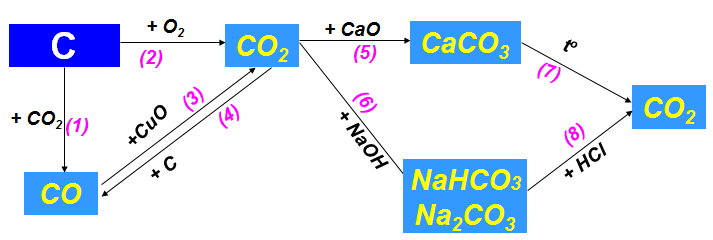
1.3. Bảng tuần hoàn các nguyên tố hóa học
a. Cấu tạo bảng tuần hoàn
- Ô nguyên tố cho biết:
- Số hiệu nguyên tử = số đơn vị điện tích hạt nhân = số e = vị trí.
- Ký hiệu hóa học.
- Tên nguyên tố.
- Nguyên tử khối.
-
Chu kì: Có 7 chu kì gồm chu kì nhỏ (1, 2, 3) và chu kì lớn (4, 5, 6, 7)
-
Nhóm: Có 8 nhóm
b. Sự biến đổi tính chất của các nguyên tố trong bảng tuần hoàn
- Trong một chu kỳ đi từ trái sang phải tính kim loại của các nguyên tố giảm dần, tính phi kim của các nguyên tố tăng dần.
- Trong một nhóm đi từ trên xuống tính kim loại của các nguyên tố tăng dần, tính phi kim của các nguyên tố giảm dần.
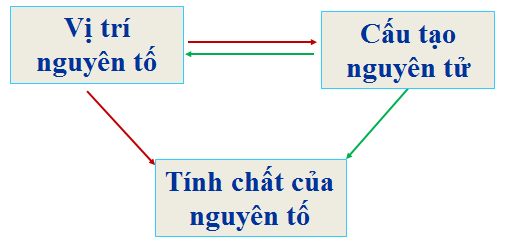
c. Ý nghĩa của bảng tuần hoàn
- Biết vị trí của nguyên tố → cấu tạo nguyên tử và tính chất của nguyên tố.
- Biết cấu tạo nguyên tử → vị trí và tính chất của nguyên tố.
2. Bài tập minh họa
2.1. Dạng 1: Xác định nguyên tố
Thể tích khí clo cần phản ứng với kim loại M bằng 1,5 lần lượng khí sinh ra khi cho cùng lượng kim loại đó tác dụng hoàn toàn với dung dịch axit HCl dư trong cùng điều kiện. Khối lượng muối clorua sinh ra trong phản ứng với clo gấp 1,2886 lần lượng sinh ra trong phản ứng với axit HCl. Xác định kim loại M
Hướng dẫn giải
Phương trình hóa học của phản ứng:
M + n/2HCl → MCln
M + mHCl → MClm + m/2H2
Theo đề bài, ta có:
\(\left\{ \begin{array}{l} \frac{n}{2} = 1,5.\frac{m}{2}\\ n,m = 1,2,3 \end{array} \right. \to \left\{ \begin{array}{l} n = 3\\ m = 2 \end{array} \right.\)
và M + 106,5 = 1,2886.(M+71)
Giải ra, ta có M = 52 (Cr)
Vậy kim loại M là crom.
2.2. Dạng 2: Tính chất muối cacbonat
Hoà tan 10 gam hỗn hợp 2 muối cacbonat của kịm loại hoá trị II và III bằng dung dịch HCl, ta thu được dung dịch X và 0,672 lít khí bay ra (ở đktc). Tính khối lượng muối thu được khi cô cạn dung dịch X.
Hướng dẫn giải
Áp dụng phương pháp tăng giảm khối lượng
Viết phương trình hoá học của XCO3 và Y2(CO3)3 với dung dịch HCl, ta nhận thấy khi chuyển từ muối cacbonat thành muối clorua thì cứ 1 mol CO2 bay ra thì khối lượng tăng : 71 - 60 = 11 (gam)
0,03 mol CO2 bay ra thì khối lượng tăng: 0,03 . 11 gam
Tổng khối lượng muối clorua tạo thành: 10 + (0,03 . 11)= 10,33 (gam)
2.3. Dạng 3: Tính chất của nguyên tố
Nguyên tố A có số hiệu nguyên tử là 11, chu kì 3, nhóm I trong bảng hệ thống tuần hoàn. Hãy cho biết:
- Cấu tạo nguyên tử của A.
- Tính chất hóa học đặc trưng của A.
- So sánh tính chất hóa học của A với các nguyên tố lân cận.
Hướng dẫn giải
- Số hiệu nguyên tử của A là 11 cho biết: Natri ở ô số 11, điện tích hạt nhân nguyên tử natri là 11+ , có 11 electron trong nguyên tử natri, ở chu kì 3, nhóm I.
- Tính chất hóa học đặc trưng của natri:
Nguyên tố natri là kim loại mạnh, trong phản ứng hóa học, natri là chất khử mạnh.
- Tác dụng với phi kim:
4Na + O2 → 2Na2O
2Na + Cl2 → 2NaCl
- Tác dụng với dung dịch axit:
2Na + 2HCl → 2NaCl + H2↑
- Tác dụng với nước:
2Na + 2H2O → 2NaOH + H2↑
- Tác dụng với dung dịch muối:
2Na + 2H2O → 2NaOH +H2↑
2NaOH + CuSO4 → Cu(OH)2↓ +Na2SO4
- So sánh tính chất hóa học của Na với các nguyên tố lân cận: Na có tính chất hóa học mạnh hơn Mg (nguyên tố đứng sau Na trong cùng chu kì) và mạnh hơn nguyên tố Li (nguyên tố đứng trên Na trong cùng một nhóm) nhưng yếu hơn nguyên tố K (nguyên tố đứng dưới Na trong cùng một nhóm).
3. Luyện tập
3.1. Bài tập tự luận
Câu 1: X, Y là hai nguyên tố halogen thuộc hai chu kì liên tiếp trong bảng tuần hoàn. Hỗn hợp A chứa 2 muối X, Y với natri. Để kết tủa hoàn toàn 2,2 gam hỗn hợp A phải dùng 150 ml dung dịch AgNO3 0,2M. Xác định hai nguyên tố X và Y.
Câu 2: Hai nguyên tố X và Y ở hai chu kì kế tiếp nhau trong bảng tuần hoàn các nguyên tố hoá học và có tổng số điện tích hạt nhân là 16.
a) Xác định tên các nguyên tố X và Y
b) Cho biết vị trí của 2 nguyên tố trong bảng tuần hoàn.
Câu 3: Cho hỗn hợp 2 kim loại Fe và Cu tác dụng với khí clo dư thu được 59,5 gam hỗn hợp muối. Cũng lượng hỗn hợp trên cho tác dụng với lượng dư dung dịch HCl 10% thu được 25,4 gam một muối.
a) Tính phần trăm khối lượng mỗi muối trong hỗn hợp muối thu được.
b) Tính thể tích dung dịch HCl 10% (D = 1,0 g/ml) cần dùng.
3.2. Bài tập trắc nghiệm
Câu 1: Sản phẩm của phản ứng khi đốt cháy hoàn toàn lần lượt lưu huỳnh, hiđro, cacbon, photpho, trong khí oxi dư là:
A. SO2, H2O, CO2, P2O5
B. SO3, H2O, CO2, P2O5
C. SO2, H2O, CO, P2O5
D. SO3, H2O, CO, P2O5
Câu 2: Sục khí clo vào dung dịch KOH ở nhiệt độ thường, sản phẩm của phản ứng gồm:
A. KCl, H2O, K2O
B. KCl, KClO, H2O
C. KCl, KClO3, H2O
D. KClO, KClO3, H2O
Câu 3: Một nguyên tố X tạo được các hợp chất sau: XH3, X2O5. Trong bảng tuần hoàn các nguyên tố hoá học, nguyên tố X cùng nhóm với
A. agon
B. nitơ
C. oxi
D. flo
Câu 4: Trong luyện kim, người ta sử dụng cacbon và hoá chất nào để điều chế kim loại?
A. Một số oxit kim loại như PbO, ZnO, CuO, ...
B. Một số bazơ như NaOH, Ca(OH)2, Cu(OH)2, ...
C. Một số axit như HNO3; H2SO4; H3PO4, ....
D. Một số muối như NaCl, CaCl2, CuCl2, ...
4. Kết luận
Sau bài học cần nắm:
-
Tính chất hóa học của phi kim.
-
Bảng tuần hoàn các nguyên tố hóa học.
Tham khảo thêm
- doc Hoá học 9 Bài 25: Tính chất của phi kim
- doc Hóa học 9 Bài 26: Clo
- doc Hóa học 9 Bài 27: Cacbon
- doc Hoá học 9 Bài 28: Các oxit của cacbon
- doc Hoá học 9 Bài 29: Axit cacbonic và muối cacbonat
- doc Hoá học 9 Bài 30: Silic và công nghiệp silicat
- doc Hoá học 9 Bài 31: Sơ lược về bảng tuần hoàn các nguyên tố hóa học
- doc Hoá học 9 Bài 33: Thực hành: Tính chất hóa học của phi kim và hợp chất của chúng
CÓ THỂ BẠN QUAN TÂM
- Sinh học 7 Bài 63: Ôn tập
- Chương trình địa phương (phần tiếng Việt) Ngữ văn 7
- Sinh học 7 Bài 60: Động vật quý hiếm
- Ôn tập phần tiếng Việt (tiếp theo) Ngữ văn 7
- Sinh học 7 Bài 59: Biện pháp đấu tranh sinh học
- Công nghệ 7 Ôn tập phần IV: Thủy sản
- Công nghệ 8 Bài 59: Thực hành: Thiết kế mạch điện
- Ôn tập tác phẩm trữ tình (tiếp theo) Ngữ văn 7
- Sinh học 7 Bài 58: Đa dạng sinh học (tiếp theo)
- Công nghệ 7 Bài 56: Bảo vệ môi trường và nguồn lợi thủy sản
Chương 1: Các Loại Hợp Chất Vô Cơ
- 1 Bài 1: Tính chất hóa học của oxit và Khái quát về sự phân loại oxit
- 2 Bài 2: Một số oxit quan trọng
- 3 Bài 3: Tính chất hóa học của axit
- 4 Bài 4: Một số axit quan trọng
- 5 Bài 5: Luyện tập tính chất hóa học của oxit và axit
- 6 Bài 6: Thực hành: Tính chất hóa học của oxit và axit
- 7 Bài 7: Tính chất hóa học của bazơ
- 8 Bài 8: Một số bazơ quan trọng
- 9 Bài 9: Tính chất hóa học của muối
- 10 Bài 10: Một số muối quan trọng
- 11 Bài 11: Phân bón hóa học
- 12 Bài 12: Mối quan hệ giữa các loại hợp chất vô cơ
- 13 Bài 13: Luyện tập chương 1 Các loại hợp chất vô cơ
- 14 Bài 14: Thực hành: Tính chất hóa học của bazơ và muối
Chương 2: Kim loại
- 1 Bài 15: Tính chất vật lí của kim loại
- 2 Bài 16: Tính chất hóa học của kim loại
- 3 Bài 17: Dãy hoạt động hóa học của kim loại
- 4 Bài 18: Nhôm
- 5 Bài 19: Sắt
- 6 Bài 20: Hợp kim sắt: Gang, thép
- 7 Bài 21: Sự ăn mòn kim loại và bảo vệ kim loại không bị ăn mòn
- 8 Bài 22: Luyện tập chương 2 Kim loại
- 9 Bài 23: Thực hành: Tính chất hóa học của nhôm và sắt
- 10 Bài 24: Ôn tập học kì 1
Chương 3: Phi kim. Sơ lược về bảng tuần hoàn các nguyên tố hóa học
- 1 Bài 25: Tính chất của phi kim
- 2 Bài 26: Clo
- 3 Bài 27: Cacbon
- 4 Bài 28: Các oxit của cacbon
- 5 Bài 29: Axit cacbonic và muối cacbonat
- 6 Bài 30: Silic và Công nghiệp silicat
- 7 Bài 31: Sơ lược về bảng tuần hoàn các NTHH
- 8 Bài 32: Luyện tập chương 3
- 9 Bài 33: Thực hành: Tính chất hóa học của phi kim và hợp chất của chúng
Chương 4: Hidrocacbon. Nhiên liệu
- 1 Bài 34: Khái niệm về hợp chất hữu cơ và hóa học hữu cơ
- 2 Bài 35: Cấu tạo phân tử hợp chất hữu cơ
- 3 Bài 36: Metan
- 4 Bài 37: Etilen
- 5 Bài 38: Axetilen
- 6 Bài 39: Benzen
- 7 Bài 40: Dầu mỏ và khí thiên nhiên
- 8 Bài 41: Nhiên liệu
- 9 Bài 42: Luyện tập chương 4 Hiđrocacbon - Nhiên liệu
- 10 Bài 43: Thực hành: Tính chất của Hiđrocacbon
Chương 5: Dẫn xuất của hidrocacbon. Polime
- 1 Bài 44: Rượu etylic
- 2 Bài 45: Axit axetic
- 3 Bài 46: Mối liên hệ giữa etilen, rượu etylic và axit axetic
- 4 Bài 47: Chất béo
- 5 Bài 48: Luyện tập Rượu etylic, axit axetic và chất béo
- 6 Bài 49: Thực hành: Tính chất của rượu và axit
- 7 Bài 50: Glucozơ
- 8 Bài 51: Saccarozơ
- 9 Bài 52: Tinh bột và xenlulozơ
- 10 Bài 53: Protein
- 11 Bài 54: Polime
- 12 Bài 55: Thực hành: Tính chất của gluxit
- 13 Bài 56: Ôn tập cuối năm
Thông báo
Bạn vui lòng đăng nhập trước khi sử dụng chức năng này Bỏ qua Đăng nhập ATNETWORK ATNETWORK
Từ khóa » Hóa 9 Bài 32 Lý Thuyết
-
Hóa Học 9 Bài 32: Luyện Tập Chương 3: Phi Kim - Lý Thuyết Hóa Học 9
-
Hoá Học 9 Bài 32: Luyện Tập Chương 3 Phi Kim - Hoc247
-
Lý Thuyết Hóa Học 9 Bài 32: Luyện Tập Chương 3: Phi Kim - Haylamdo
-
Hóa Học 9 Bài 32: Luyện Tập Chương 3 Phi Kim
-
Giải Hóa 9 Bài 32: Luyện Tập Chương 3: Phi Kim
-
Lý Thuyết Phi Kim – Sơ Lược Về Bảng Tuần Hoàn (mới 2022 + Bài Tập)
-
Bài 32: Luyện Tập Chương 3: Phi Kim - Sơ Lược Về Bảng Tuần ...
-
Giải Bài 32 Hóa Học 9: Luyện Tập Chương 3: Phi Kim Sơ Lược Về ...
-
Giải Vở Bài Tập Hóa 9 Bài 32: Luyện Tập Chương 3
-
Soạn Hóa 9 Bài 32: Luyện Tập Chương 3 Trang 103 (Ngắn Gọn)
-
Giải Bài Tập Hóa Học Lớp 9 - Bài 32: Luyện Tập Chương III: Phi Kim, Sơ ...
-
Hóa Học 9 - Bài 32 - Luyện Tập Chương 3 Phi Kim Sơ Lược Bảng Tuần ...
-
Giải Bài Tập Hóa Học 9 - Bài 32: Luyện Tập Chương 3: Phi Kim