Lý Thuyết Phi Kim – Sơ Lược Về Bảng Tuần Hoàn (mới 2022 + Bài Tập)
Có thể bạn quan tâm
Lý thuyết Hóa 9 Bài 32: Luyện tập chương 3: phi kim – Sơ lược về bảng tuần hoàn
Bài giảng Hóa 9 Bài 32: Luyện tập chương 3: phi kim – Sơ lược về bảng tuần hoàn
Kiến thức cần nắm vững
1. Tính chất hóa học của phi kim
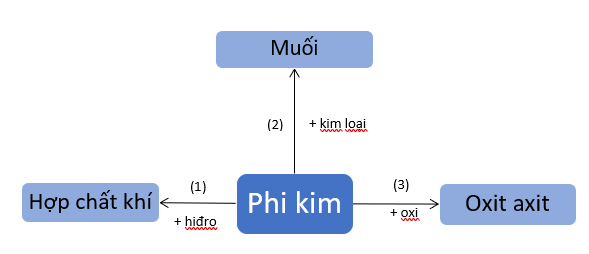
Phương trình hóa học minh họa cho sơ đồ, ứng với phi kim là lưu huỳnh:
(1) S + H2 →to H2S
(2) S + Fe →to FeS
(3) S + O2 →to SO2
2. Tính chất hóa học của 1 số phi kim cụ thể
a. Tính chất hóa học của clo
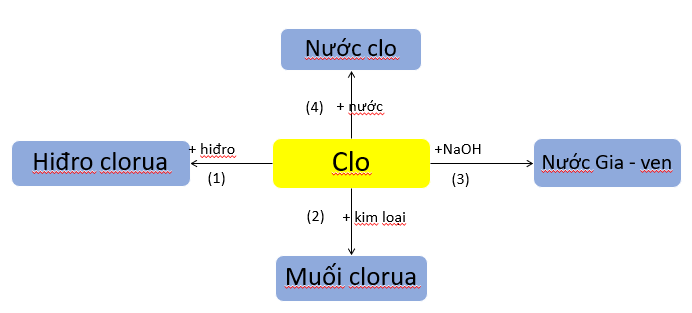
Các phương trình hóa học minh họa cho sơ đồ:
(1) Cl2 + H2 →to 2HCl
(2) 3Cl2 + 2Fe →to 2FeCl3
(3) Cl2 + 2NaOH → NaCl + NaClO + H2O
(4) Cl2 + H2O ⇄ HCl + HClO
b. Tính chất hóa học các hợp chất của cacbon
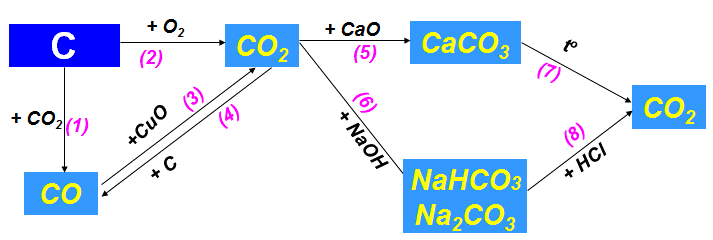
Phương trình hóa học minh họa cho sơ đồ:
(1) C + CO2 →to 2CO
(2) C + O2 →to CO2
(3) CO + CuO →to Cu + CO2 ↑
(4) CO2 + C →to 2CO
(5) CaO + CO2 →to CaCO3
(6) CO2 + 2NaOH (dư) → Na2CO3 + H2O
CO2 dư + NaOH → NaHCO3
(7) CaCO3 →to CaO + CO2
(8) Na2CO3 + 2HCl → 2NaCl + CO2 + H2O
NaHCO3 + HCl → NaCl + CO2 + H2O
3. Bảng tuần hoàn các nguyên tố hóa học
a. Cấu tạo của bảng tuần hoàn
- Ô nguyên tố
- Chu kỳ
- Nhóm
b. Sự biến đổi tính chất của các nguyên tố trong bảng tuần hoàn
- Trong một chu kỳ, khi đi từ đầu đến cuối chu kỳ theo chiều tăng của điện tích hạt nhân:
+) Số electron lớp ngoài cùng của nguyên tử tăng dần từ 1 đến 8 electron.
+) Tính kim loại của các nguyên tố giảm dần, đồng thời tính phi kim của các nguyên tố tăng dần.
- Trong một nhóm, khi đi từ trên xuống dưới theo chiều tăng của điện tích hạt nhân:
+) Số lớp electron của nguyên tử tăng dần.
+) Tính kim loại của các nguyên tố tăng dần, đồng thời tính phi kim của các nguyên tố giảm dần.
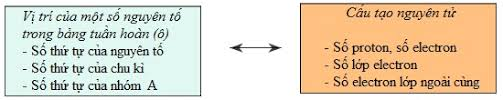
c. Ý nghĩa bảng tuần hoàn
Biết vị trí của nguyên tố trong bảng tuần hoàn ta có thể suy đoán cấu tạo nguyên tử và ngược lại.
Trắc nghiệm Hóa học 9 Bài 32: Luyện tập chương 3: Phi kim – Sơ lược về bảng tuần hoàn các nguyên tố hóa học
Câu 1:Cho 0,4 gam khí hidro tác dụng vừa đủ với khí clo, sau phản ứng thu được m gam HCl. Giá trị của m là
A. 10,9 gam
B. 12,8 gam
C. 13,5 gam
D. 14,6 gam
Hiển thị đáp ánCâu 2:Để phân biệt CO2và SO2người ta dùng dịch nào sau đây?
A. Nước brom
B. Dung dịch HCl
C. Dung dịch NaOH
D. Dung dịch Ca(OH)2
Hiển thị đáp ánCâu 3:Chất nào sau đây là muối cacbonat trung hòa?
A. NaHCO3
B. Ca(HCO3)2
C. Ba(HCO3)2
D. CaCO3
Hiển thị đáp ánCâu 4:Đốt cháy 24,8 gam photpho bình chứa khí oxi, thu được m gam điphotpho pentaoxit. Giá trị của m là
A. 56,8 gam
B. 57,2 gam
C. 54,4 gam
D. 55,4 gam
Hiển thị đáp ánCâu 5: Phương trình phản ứng nào sau đây đúng?
A. K2CO3 + Ca(OH)2 → 2KOH + CaCO3
B. K2CO3 + Ca(OH)2 → 2K2O + CaCO3
C. K2CO3 + Ca(OH)2 → 2KOH + CaO +CO2
D. K2CO3 + Ca(OH)2 → 2K2O + CaCO3 +H2O
Hiển thị đáp ánCâu 6:Cho 34,8 gam MnO2tác dụng với dung dịch HCl đặc, nóng, dư. Thể tích khí ở đktc thu được là
A. 6,56 lít
B. 4,48 lít
C. 8,96 lít
D. 17,92 lít
Hiển thị đáp ánCâu 7:Để có thể khắc chữ và hình trên thuỷ tinh người ta dùng dung dịch nào dưới đây?
A. Dung dịch HF
B. Dung dịch HCl
C. Dung dịch HBr
D. Dung dịch HI
Hiển thị đáp ánCâu 8:Công đoạn chính để sản xuất thủy tinh theo thứ tự lần lượt là
A. Trộn, nung, làm nguội, ép, thổi
B. Trộn, ép, thổi, làm nguội, nung
C. Trộn, thổi, làm nguội, nung, ép
D. Nung, thổi, trộn, làm nguội, ép
Hiển thị đáp ánCâu 9:Cho 16,8 gam NaHCO3vào lượng dư dung dịch HCl, sau phản ứng thu được V lít khí CO2ở đktc. Giá trị của V là
A. 2,24 lít
B. 3,36 lít
C. 4,48 lít
D. 5,60 lít
Hiển thị đáp ánCâu 10:Dãy kim loại nào sau đây được sắp xếp theo chiều tính kim loại tăng dần
A. K, Na, Li, Rb
B. Li, K, Rb, Na
C. Na, Li, Rb, K
D. Li, Na, K, Rb
Hiển thị đáp ánXem thêm các bài tổng hợp lý thuyết Hóa lớp 9 đầy đủ, chi tiết khác:
Lý thuyết Bài 34: Khái niệm về hợp chất hữu cơ và hóa học hữu cơ
Lý thuyết Bài 35: Cấu tạo phân tử hợp chất hữu cơ
Lý thuyết Bài 36: Metan
Lý thuyết Bài 37: Etilen
Lý thuyết Bài 38: Axetilen
Từ khóa » Hóa 9 Bài 32 Lý Thuyết
-
Hóa Học 9 Bài 32: Luyện Tập Chương 3: Phi Kim - Lý Thuyết Hóa Học 9
-
Hoá Học 9 Bài 32: Luyện Tập Chương 3 Phi Kim - Hoc247
-
Lý Thuyết Hóa Học 9 Bài 32: Luyện Tập Chương 3: Phi Kim - Haylamdo
-
Hóa Học 9 Bài 32: Luyện Tập Chương 3 Phi Kim
-
Giải Hóa 9 Bài 32: Luyện Tập Chương 3: Phi Kim
-
Bài 32: Luyện Tập Chương 3: Phi Kim - Sơ Lược Về Bảng Tuần ...
-
Giải Bài 32 Hóa Học 9: Luyện Tập Chương 3: Phi Kim Sơ Lược Về ...
-
Giải Vở Bài Tập Hóa 9 Bài 32: Luyện Tập Chương 3
-
Soạn Hóa 9 Bài 32: Luyện Tập Chương 3 Trang 103 (Ngắn Gọn)
-
Giải Bài Tập Hóa Học Lớp 9 - Bài 32: Luyện Tập Chương III: Phi Kim, Sơ ...
-
Hóa Học 9 - Bài 32 - Luyện Tập Chương 3 Phi Kim Sơ Lược Bảng Tuần ...
-
Giải Bài Tập Hóa Học 9 - Bài 32: Luyện Tập Chương 3: Phi Kim
-
Hoá Học 9 Bài 32: Luyện Tập Chương 3