Hướng Dẫn Tìm Loại Nguyên Tố (s, P, D, F); Viết Cấu Hình Electron
Có thể bạn quan tâm
Cấu hình electron rất dễ nếu bạn chịu khó học và thực hành!
Nội dung bài viết
- 1. Tìm phân lớp (AO, electron) có mức năng lượng cao nhất
- 1.1. Bạn cần phải thuộc nằm lòng
- 1.2. Bé tập đọc
- 1.3. Hướng dẫn tìm mức năng lượng cao nhất
- 2. Xác định loại nguyên tố từ mức năng lượng cao nhất
- 2.1. Nếu mức năng lượng cao nhất là
- 2.2. Thực hành
- 3. Cấu hình electron nguyên tử
- 3.1. Hướng dẫn viết cấu hình electron
- 3.2. Thực hành viết cấu hình electron
- 4. Liên kết nhanh
- Viết bởi Đỗ Trọng Toan từ W3chem.com
- Mình cảm ơn bạn rất nhiều ⤵
1. Tìm phân lớp (AO, electron) có mức năng lượng cao nhất
1.1. Bạn cần phải thuộc nằm lòng
Từ qui tắc đường chéo của Klechkowski ở bài trước, chúng mình có dãy thứ tự mức năng lượng tăng dần như sau:

1.2. Bé tập đọc
- Khi ghi 1s : phân lớp s của lớp thứ 1 ; phân lớp 1s.
- Khi ghi 3p : phân lớp p của lớp thứ 3 ; phân lớp 3p. SAI nếu nói: 3 phân lớp p.
- Khi ghi 1s2 : có 2 electron nằm ở phân lớp s của lớp thứ 1 ; có 2 elecron ở phân lớp 1s.
- Khi ghi 3p6 : có 6 electron nằm ở phân lớp p của lớp thứ 3 ; có 6 elecron ở phân lớp 3p.
- Khi ghi 1s2 2s2 2p6 :
- Có 10 electron (lấy các số mũ cộng lại).
- Có 3 phân lớp là 1s, 2s và 2p.
- Có 2 lớp (hay sai!), lớp thứ 2 có 2 phân lớp (2s và 2p).
- Lớp thứ 2 là lớp ngoài cùng; có 8 electron ở lớp ngoài cùng (do 2s2 2p6); hay sai khi nói 6!.
1.3. Hướng dẫn tìm mức năng lượng cao nhất
- Tìm số electron của nguyên tử: học thuộc số Z hoặc tra bảng tuần hoàn tại đây để tìm số Z.
- Xếp số e trên theo thứ tự **.
- Phân lớp cuối cùng chính là mức năng lượng cao nhất.
Ví dụ, em hãy tìm AO có mức năng lượng cao nhất ở lớp vỏ của nguyên tử:
a) H, He, Li, Na, K, Ca.
Vừng ơi mở ra!| Nguyên tử | Z (số e) | Dãy mức E tăng dần | Mức Emax |
| H | 1 | 1s1 | 1s |
| He | 2 | 1s2 | 1s |
| Li | 3 | 1s2 2s1 | 2s |
| Na | 11 | 1s2 2s2 2p6 3s1 | 3s |
| K | 19 | 1s2 2s2 2p6 3s2 3p6 4s1 | 4s |
| Ca | 20 | 1s2 2s2 2p6 3s2 3p6 4s2 | 4s |
b) C, N, F, Ne, P, Br.
Mở ra vừng ơi!| Nguyên tử | Z (số e) | Dãy mức E tăng dần | Mức Emax |
| C | 6 | 1s2 2s2 2p2 | 2p |
| N | 7 | 1s2 2s2 2p3 | 2p |
| F | 9 | 1s2 2s2 2p5 | 2p |
| Ne | 10 | 1s2 2s2 2p6 | 2p |
| P | 15 | 1s2 2s2 2p6 3s2 3p3 | 3p |
| Br | 35 | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5 | 4p |
c) Sc, V, Fe, Zn.
Không còn là bí mật!| Nguyên tử | Z (số e) | Dãy mức E tăng dần | Mức Emax |
| Sc | 21 | 1s2 2s2 2p6 3s2 3p6 4s2 3d1 | 3d |
| V | 23 | 1s2 2s2 2p6 3s2 3p6 4s2 3d3 | 3d |
| Fe | 26 | 1s2 2s2 2p6 3s2 3p6 4s2 3d6 | 3d |
| Zn | 30 | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 | 3d |
d) Cr, Cu.
Dễ lãng quên!| Nguyên tử | Z (số e) | Dãy mức E tăng dần | Mức Emax |
| Cr | 24 | 1s2 2s2 2p6 3s2 3p6 4s2 3d4 | 3d |
| Cu | 29 | 1s2 2s2 2p6 3s2 3p6 4s2 3d9 | 3d |
2. Xác định loại nguyên tố từ mức năng lượng cao nhất
2.1. Nếu mức năng lượng cao nhất là
- s => gọi là nguyên tố s
- p => gọi là nguyên tố p
- d => gọi là nguyên tố d
- f => gọi là nguyên tố f
4 nhóm nguyên tố phân bố trong bảng tuần hoàn
- nguyên tố s và p: xếp vào nhóm A, các nguyên tố nhóm này có thể là Kim loại, Phi kim, Khí trơ (khí hiếm).
- nguyên tố d và f: xếp vào nhóm B, các nguyên tố nhóm này chỉ là Kim loại – gọi là các Kim loại chuyển tiếp.
- Lưu ý: nguyên tố f là 28 nguyên tố xếp ở 2 dãy cuối bảng tuần hoàn (họ Lantan và Actini); mình sẽ không bao giờ gặp các nguyên tố này trong chương trình Hóa 10.

2.2. Thực hành
Ở các ví dụ trên, ta thấy:
a) H, He, Li, Na, K, Ca đều có mức Emax là s => đây là các nguyên tố s; bạn nhìn bảng tuần hoàn thấy xếp ở các cột A.
b) C, N, F, Ne, P, Br đều có mức Emax là p => đây là các nguyên tố p; bạn nhìn bảng tuần hoàn thấy xếp ở các cột A.
c) Sc, V, Fe, Zn đều có mức Emax là d => đây là các nguyên tố d; bạn nhìn bảng tuần hoàn thấy xếp ở các cột B.
d) Cr, Cu đều có mức Emax là d => đây là các nguyên tố; bạn nhìn bảng tuần hoàn thấy xếp ở các cột B.
3. Cấu hình electron nguyên tử
Quy luật của tự nhiên trong phân bố electron vào các phân lớp: các nguyên tử đang tồn tại (mà con người đã biết) đều xếp electron theo thứ tự mức năng lượng từ thấp đến cao như dãy trên, do vậy
- luôn luôn phải viết theo dãy*** của mức năng lượng tăng dần trước.
- rồi mới tiếp tụcviết cấu hình electron!
3.1. Hướng dẫn viết cấu hình electron
Xếp số electron theo thứ tự mức năng lượng tăng dần như ở mục 1.
Cấu hình là phải theo đúng thứ tự lớp 1 → 2 → 3 → 4 → 5 → 6 → 7 mà không được lộn xộn, do vậy:
- khi số e ≤ 20: mức E trùng cấu hình do đã đúng thứ tự lớp.
- nhưng khi số e > 20: có sự chèn mức E (tức không đúng thứ tự lớp) => buộc phải xếp lại.
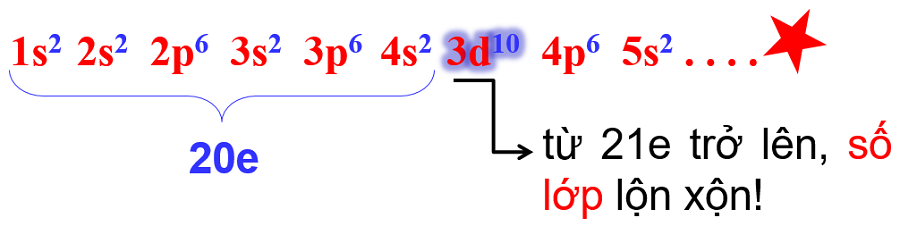
3.2. Thực hành viết cấu hình electron
Ví dụ, em hãy viết cấu hình electron nguyên tử của:
a) H, He, Li, Na, K, Ca.
Học Hóa vui lắm luôn!| Nguyên tử | Dãy mức E tăng dần | Cấu hình electrongiống bên | Số e lớp ngoài cùng |
| 1H | 1s1 | 1 phân lớp1 lớp | 1 e |
| 2He | 1s2 | 1 phân lớp1 lớp | 2 e |
| 3Li | 1s2 2s1 | 1 phân lớp2 lớp | 1 e |
| 11Na | 1s2 2s2 2p6 3s1 | 4 phân lớp3 lớp | 1 e |
| 19K | 1s2 2s2 2p6 3s2 3p6 4s1 | 6 phân lớp4 lớp | 1 e |
| 20Ca | 1s2 2s2 2p6 3s2 3p6 4s2 | 6 phân lớp4 lớp | 2 e |
b) C, N, F, Ne, P, Br.
Hóa khiến bạn tự tin!| Nguyên tử | Dãy mức E tăng dần | Cấu hình electrongiống bên TRỪ Br** | Số e lớp ngoài cùng |
| 6C | 1s2 2s2 2p2 | 3 phân lớp2 lớp | 4 |
| 7N | 1s2 2s2 2p3 | -nt- | 5 |
| 9F | 1s2 2s2 2p5 | -nt- | 7 |
| 10Ne | 1s2 2s2 2p6 | -nt- | 8 |
| 15P | 1s2 2s2 2p6 3s2 3p3 | 5 phân lớp3 lớp | 5 |
| 35Br | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5** | Phải XẾP LẠI đúng thứ tự lớp**1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p5 8 phân lớp4 lớp | 7 |
c) Sc, V, Fe, Zn.
Hóa không từ bỏ bạn!| Nguyên tử | Dãy mức E tăng dần | Cấu hình electronphải xếp lại | Số e lớp ngoài cùng |
| 21Sc | 1s2 2s2 2p6 3s2 3p6 4s2 3d1 | 1s2 2s2 2p6 3s2 3p6 3d1 4s2 | 2 |
| 23V | 1s2 2s2 2p6 3s2 3p6 4s2 3d3 | 1s2 2s2 2p6 3s2 3p6 3d3 4s2 | 2 |
| 26Fe | 1s2 2s2 2p6 3s2 3p6 4s2 3d6 | 1s2 2s2 2p6 3s2 3p6 3d6 4s2 | 2 |
| 30Zn | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 | 2 |
d) Cr, Cu.
Rất khó để lãng quên!| Nguyên tử | Dãy mức E tăng dần | Cấu hình electronphải xếp lại | Số e lớp ngoài cùng |
| 24Cr | 1s2 2s2 2p6 3s2 3p6 4s2 3d4 | 1s2 2s2 2p6 3s2 3p6 3d4 4s2 | 2 |
| 29Cu | 1s2 2s2 2p6 3s2 3p6 4s2 3d9 | 1s2 2s2 2p6 3s2 3p6 3d9 4s2 | 2 |
Cr và Cu sẽ có cấu hình electron bền hơn như sau:
- 1s2 2s2 2p6 3s2 3p6 3d5 4s1
- 1s2 2s2 2p6 3s2 3p6 3d10 4s1
4. Liên kết nhanh
Đọc thêm các bài viết Nguyên tử và Hóa lớp 10 tại đây.
🍒🍓🫒🍍 Nếu có câu hỏi hoặc ý tưởng mới, hãy ghi lại trong phần bình luận bên dưới bạn nhé. Câu hỏi và ý tưởng của bạn luôn tuyệt vời.Viết bởi Đỗ Trọng Toan từ W3chem.com
Mình là người tự thực hiện toàn bộ dự án này – bao gồm xây dựng trang web, viết nội dung, tìm tài liệu tham khảo, trả lời câu hỏi bạn gởi về. Vui lòng xem xét QUYÊN GÓP để hỗ trợ W3chem CHỈ BẰNG CÁCH CHIA SẺ BÀI VIẾT NÀY LÊN MẠNG XÃ HỘI; bởi vì trong tương lai, bạn sẽ cho mình nhiều thời gian để làm việc trên W3chem, cũng có nghĩa bạn nhận thêm nhiều nội dung mới nhanh hơn tại đây.😍 🥰 😘
Mình cảm ơn bạn rất nhiều ⤵
- Share on Facebook
- Share on Twitter
- Share on Pinterest
- Share on LinkedIn
Post navigation
Previous: Lớp và phân lớp electron, hướng dẫn tìm số electron tối đaNext: Tính chất hóa học cơ bản, dự đoán từ số e lớp ngoài cùngTừ khóa » Nguyên Tố Nhóm S Là Gì
-
Nguyên Tố S Là Gì? Nguyên Tố P Là Gì? Nguyên Tố D Là ...
-
Ý Nghĩa Của Bảng Tuần Hoàn Nguyên Tố Hóa Học Đầy Đủ Nhất
-
Nhóm S (Steadiness) - Sự Bền Vững
-
Bài 6 Trang 39 SGK Hóa 10 Nâng Cao:Nhóm Nguyên Tố Là Gì? B) Các ...
-
Khối Các Nguyên Tố S Gồm Các Nhóm Nào, được Gọi Là Các Nhóm Gì
-
Nhóm (bảng Tuần Hoàn) – Wikipedia Tiếng Việt
-
Bài 7. Bảng Tuần Hoàn Các Nguyên Tố Hóa Học - Củng Cố Kiến Thức
-
Nguyên Tố Nào Sau đây Là Nguyên Tố S ?
-
Nguyên Tố S Là Gì
-
Các Nguyên Tố S Thuộc Nhóm Nào Trong Bảng Tuần Hoàn
-
Cấu Hình Electron Nguyên Tử Của Các Nguyên Tố Nhóm A
-
Bảng Tuần Hoàn Các Nguyên Tố Hóa Học Lớp 8, 9, 10 Mới Nhất
-
Những Nguyên Tố Thuộc Nhóm A Nào Là Các Nguyên Tố S, Nguyên Tố P?
-
Vị Trí Và Cấu Tạo Của Kim Loại Kiềm