Insulin – Wikipedia Tiếng Việt
Có thể bạn quan tâm

Insulin (/ˈɪn.sjʊ.lɪn/,[1][2] từ Latin insula, nghĩa đen: 'đảo') là một hormone peptide được sản xuất bởi các tế bào beta của đảo tụy; nó được coi là hormone đồng hóa chính của cơ thể.[3] Nó điều chỉnh sự chuyển hóa carbohydrate, chất béo và protein bằng cách thúc đẩy sự hấp thụ glucose từ máu vào tế bào gan, mỡ và cơ xương.[4] Trong các mô này, glucose được hấp thụ được chuyển đổi thành glycogen thông qua glycogenesis hoặc chuyển hóa axit béo (triglyceride) thông qua quá trình lipogenesis, hoặc, trong trường hợp của gan, thông qua cả hai quá trình.[4] Sự sản xuất và bài tiết glucose của gan bị ức chế mạnh mẽ bởi nồng độ insulin cao trong máu.[5] Insulin lưu hành cũng ảnh hưởng đến quá trình tổng hợp protein trong nhiều loại mô. Do đó, nó là một hormone đồng hóa, thúc đẩy quá trình chuyển đổi các phân tử nhỏ trong máu thành các phân tử lớn bên trong các tế bào. Nồng độ insulin thấp trong máu có tác dụng ngược lại bằng cách thúc đẩy quá trình dị hóa lan rộng, đặc biệt là mỡ cơ thể dự trữ.
Các tế bào beta rất nhạy cảm với lượng đường trong máu để chúng tiết ra insulin vào máu để đáp ứng với mức glucose cao; và ức chế bài tiết insulin khi nồng độ glucose thấp.[6] Insulin tăng cường hấp thu glucose và chuyển hóa trong các tế bào, do đó làm giảm lượng đường trong máu. Các tế bào alpha lân cận của chúng, bằng cách lấy tín hiệu từ các tế bào beta,[6] tiết glucagon vào máu theo cách ngược lại: tăng tiết khi glucose trong máu thấp và giảm bài tiết khi nồng độ glucose cao. Glucagon làm tăng mức đường huyết bằng cách kích thích glycogenolysis và gluconeogenesis ở gan.[4][6] Sự tiết insulin và glucagon vào máu để đáp ứng với nồng độ glucose trong máu là cơ chế chính của cân bằng nội môi glucose.[6]
Giảm hoặc mất hoạt động của insulin dẫn đến đái tháo đường, một tình trạng của lượng đường trong máu cao (tăng đường huyết). Có hai loại bệnh. Trong đái tháo đường týp 1, các tế bào beta bị phá hủy bởi phản ứng tự miễn dịch để insulin không còn có thể được tổng hợp hoặc tiết vào máu.[7] Trong đái tháo đường týp 2, sự phá hủy các tế bào beta ít rõ rệt hơn so với bệnh tiểu đường loại 1, và không phải do quá trình tự miễn dịch. Thay vào đó, có sự tích tụ amyloid trong các đảo nhỏ tụy, có khả năng phá vỡ giải phẫu và sinh lý của chúng.[6] Cơ chế bệnh sinh của bệnh tiểu đường loại 2 chưa được hiểu rõ nhưng giảm dân số tế bào beta, giảm chức năng bài tiết của các tế bào beta nhỏ tồn tại và kháng insulin mô ngoại biên có liên quan.[3] Bệnh tiểu đường loại 2 được đặc trưng bởi sự tăng tiết glucagon không bị ảnh hưởng và không đáp ứng với nồng độ glucose trong máu. Nhưng insulin vẫn được tiết vào máu để đáp ứng với đường huyết.[6] Kết quả là glucose tích lũy trong máu.
Protein insulin của con người có công thức là C257H383N65O77S6 bao gồm 51 amino acid và có khối lượng phân tử là 5808 Da. Nó là một dimer hetero của chuỗi A và chuỗi B, được liên kết với nhau bằng liên kết disulfide. Cấu trúc của Insulin thay đổi một chút giữa các loài động vật. Insulin từ các nguồn động vật khác nhau một chút về hiệu quả (về tác dụng chuyển hóa carbohydrate) so với insulin người vì những biến thể này. Insulin lợn đặc biệt gần với phiên bản người và được sử dụng rộng rãi để điều trị bệnh nhân tiểu đường loại 1 trước khi insulin người có thể được sản xuất với số lượng lớn bằng công nghệ DNA tái tổ hợp.[8][9][10][11]
Insulin là hormone peptide đầu tiên được phát hiện.[12] Frederick Banting và Charles Herbert Best, làm việc trong phòng thí nghiệm của JJR Macleod tại Đại học Toronto, là những người đầu tiên phân lập insulin từ tuyến tụy chó vào năm 1921. Frederick Sanger đã giải trình tự cấu trúc amino acid vào năm 1951, khiến insulin trở thành protein đầu tiên được giải trình tự đầy đủ.[13] Cấu trúc tinh thể của insulin ở trạng thái rắn được xác định bởi Dorothy Hodgkin vào năm 1969. Insulin cũng là protein đầu tiên được tổng hợp hóa học và sản xuất bằng công nghệ tái tổ hợp DNA.[14] Nó nằm trong Danh sách các loại thuốc thiết yếu của WHO, gồm các loại thuốc quan trọng nhất cần có trong hệ thống y tế cơ bản.[15]
Sự tiến hóa và phân bố loài
[sửa | sửa mã nguồn]Insulin có thể có nguồn gốc từ hơn một tỷ năm trước.[16] Nguồn gốc phân tử của insulin ít nhất là từ các sinh vật nhân chuẩn đơn bào đơn giản nhất.[17] Ngoài động vật, protein giống như insulin cũng được biết là tồn tại ở các loài nấm và sinh vật nguyên sinh.[16]
Insulin được sản xuất bởi các tế bào beta của các tiểu đảo tụy ở hầu hết các động vật có xương sống và bởi cơ thể Brockmann ở một số loài cá teleost.[18] Ốc sên Conus geographus và Conus tulipa, ốc biển có nọc độc săn cá nhỏ, sử dụng các dạng insulin biến đổi trong cocktail nọc độc của chúng. Độc tố insulin, có cấu trúc gần với cá hơn là insulin tự nhiên của ốc sên, làm chậm con cá bằng cách hạ thấp mức đường huyết của chúng.[19][20]
Gen
[sửa | sửa mã nguồn]Các preproinsulin, tiền thân của insulin được mã hóa bởi các gen INS, nằm trên nhiễm sắc thể 11p15.5.[21][22]
Các alen
[sửa | sửa mã nguồn]Một loạt các alen đột biến với những thay đổi trong khu vực mã hóa đã được xác định. Một gen đọc qua, INS-IGF2, trùng lặp với gen này ở vùng 5 'và với gen IGF2 ở vùng 3'.[21]
Quy định
[sửa | sửa mã nguồn]
Trong các tế bào beta của tụy, glucose là tác nhân kích thích sinh lý chính để điều hòa tổng hợp insulin. Insulin chủ yếu được điều hòa thông qua các yếu tố phiên mã PDX1, NeuroD1 và MafA.[23][24][25][26]
Trong trạng thái glucose thấp, PDX1 (protein homeobox tụy và tá tràng 1) nằm ở ngoại vi hạt nhân do kết quả của sự tương tác với HDAC1 và 2,[27] dẫn đến điều hòa giảm bài tiết insulin.[28] Sự gia tăng nồng độ glucose trong máu gây ra sự phosphoryl hóa PDX1, dẫn đến việc nó trải qua quá trình chuyển vị hạt nhân và liên kết yếu tố A3 trong chất kích thích insulin.[29] Sau khi chuyển vị trí, nó tương tác với các hệ số điều khiển HAT p300 và SETD7. PDX1 ảnh hưởng đến việc sửa đổi histone thông qua acetyl hóa và khử acetyl cũng như methyl hóa. Nó cũng được cho là để ức chế glucagon.[30]
NeuroD1, còn được gọi là β2, điều chỉnh quá trình exocytosis insulin trong tế bào reat bằng cách trực tiếp gây ra sự biểu hiện của các gen liên quan đến exocytosis.[31] Nó được định vị trong cytosol, nhưng để đáp ứng với glucose cao, nó bị glycosyl hóa bởi OGT và/hoặc phosphoryl hóa bởi ERK, gây ra sự chuyển vị vào nhân. Trong nhân β2 dị hóa với E47, liên kết với yếu tố E1 của chất kích thích insulin và tuyển dụng đồng hoạt hóa p300 mà acetylates 2. Nó có thể tương tác với các yếu tố phiên mã khác cũng như kích hoạt gen insulin.[31]
MafA bị suy giảm do các proteasome khi mức đường huyết thấp. Nồng độ glucose tăng làm cho một protein glycosylated không xác định. Protein này hoạt động như một yếu tố phiên mã cho MafA theo cách không xác định và MafA được vận chuyển ra khỏi tế bào. MafA sau đó được chuyển trở lại vào nhân nơi nó liên kết với yếu tố C1 của chất kích thích insulin.[32][33]
Các yếu tố phiên mã này hoạt động hiệp đồng và trong một sắp xếp phức tạp. Tăng đường huyết sau một thời gian có thể phá hủy khả năng liên kết của các protein này, và do đó làm giảm lượng insulin tiết ra, gây ra bệnh tiểu đường. Các hoạt động liên kết giảm có thể được trung gian bởi stress oxy hóa gây ra bởi glucose và chất chống oxy hóa được cho là để ngăn chặn sự giảm bài tiết insulin trong các tế bào β glucotoxic tụy. Các phân tử tín hiệu căng thẳng và các loài oxy phản ứng ức chế gen insulin bằng cách can thiệp vào các đồng yếu tố liên kết các yếu tố phiên mã và chính các yếu tố phiên mã.[34]
Một số trình tự quy định trong khu vực khởi động của gen insulin người liên kết với các yếu tố phiên mã. Nói chung, các hộp A liên kết với các yếu tố Pdx1, hộp E liên kết với NeuroD, hộp C liên kết với MafA và các yếu tố phản ứng cAMP với CREB. Ngoài ra còn có trình tự tắt ức chế phiên mã.
Cấu trúc
[sửa | sửa mã nguồn]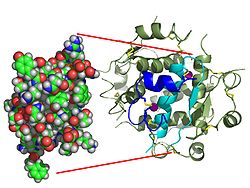
Trái với suy nghĩ ban đầu rằng các hoocmon nói chung sẽ là các phân tử hóa học nhỏ, vì hoóc môn peptide đầu tiên được biết về cấu trúc của nó, insulin được tìm thấy là khá lớn.[12] Một protein đơn (monome) của insulin người bao gồm 51 amino acid và có khối lượng phân tử là 5808 Da. Công thức phân tử của insulin người là C257H383N65O77S6.[35] Nó là sự kết hợp của hai chuỗi peptide (dimer) được đặt tên là chuỗi A và chuỗi B, được liên kết với nhau bằng hai liên kết disulfide. Chuỗi A bao gồm 21 amino acid, trong khi chuỗi B bao gồm 30 dư lượng. Các liên kết disulfide liên kết (interchain) được hình thành tại dư lượng cystein giữa các vị trí A7 - B7 và A20 - B19. Có một liên kết disulfide (xâm nhập) bổ sung trong chuỗi A giữa dư lượng cystein tại các vị trí A6 và A11. Chuỗi A thể hiện hai vùng xoắn ốc ở A1 - A8 và A12 - A19 là phản song song; trong khi chuỗi B có một chuỗi trung tâm (bao gồm dư lượng B9 - B19) nằm bên cạnh liên kết disulfide ở hai bên và hai tấm (bao gồm B7 - B10 và B20 - B23).[12][36]
Trình tự amino acid của insulin được bảo tồn mạnh mẽ và chỉ thay đổi một chút giữa các loài. Insulin bò khác với con người chỉ có ba dư lượng amino acid và insulin lợn trong một. Ngay cả insulin từ một số loài cá cũng tương tự như con người để có hiệu quả lâm sàng ở người. Insulin ở một số động vật không xương sống có trình tự khá giống với insulin người và có tác dụng sinh lý tương tự. Sự tương đồng mạnh mẽ được thấy trong chuỗi insulin của các loài khác nhau cho thấy nó đã được bảo tồn trong phần lớn lịch sử tiến hóa của động vật. Tuy nhiên, C-peptide của proinsulin khác nhau nhiều hơn giữa các loài; nó cũng là một hoóc môn, nhưng là thứ yếu.[36]
Insulin được sản xuất và lưu trữ trong cơ thể dưới dạng hexamer (một đơn vị gồm sáu phân tử insulin), trong khi dạng hoạt động là monome. Hexamer có kích thước khoảng 36000 Da. Sáu phân tử được liên kết với nhau như ba đơn vị dimeric để tạo thành phân tử đối xứng. Một tính năng quan trọng là sự hiện diện của các nguyên tử kẽm (Zn 2+) trên trục đối xứng, được bao quanh bởi ba phân tử nước và ba dư lượng histamine ở vị trí B10.[12][36]
Hexamer là một dạng không hoạt động với sự ổn định lâu dài, phục vụ như một cách để giữ cho insulin phản ứng cao được bảo vệ, nhưng vẫn có sẵn. Việc chuyển đổi hexamer-monome là một trong những khía cạnh trung tâm của các công thức insulin để tiêm. Hexamer ổn định hơn nhiều so với monome, đó là mong muốn vì lý do thực tế; tuy nhiên, monome là một loại thuốc phản ứng nhanh hơn nhiều vì tốc độ khuếch tán có liên quan nghịch với kích thước hạt. Một loại thuốc phản ứng nhanh có nghĩa là tiêm insulin không phải đi trước bữa ăn nhiều giờ, điều này sẽ giúp những người mắc bệnh tiểu đường linh hoạt hơn trong lịch trình hàng ngày.[37] Insulin có thể tổng hợp và tạo thành các tấm beta xen kẽ fibrillar. Điều này có thể gây ra bệnh amyloidosis và ngăn ngừa việc lưu trữ insulin trong thời gian dài.[38]
Tổng hợp, tác dụng sinh lý và thoái hóa
[sửa | sửa mã nguồn]Tổng hợp
[sửa | sửa mã nguồn]Insulin được sản xuất trong tuyến tụy và cơ thể Brockmann (ở một số loài cá) và được giải phóng khi phát hiện bất kỳ kích thích nào. Những kích thích này bao gồm sự gia tăng nồng độ amino acid và glucose trong huyết tương do quá trình tiêu hóa thức ăn.[39] Carbonhydrate có thể là polymer của các loại đường đơn giản hoặc chính các loại đường đơn giản. Nếu carbohydrate bao gồm glucose, thì glucose đó sẽ được hấp thụ vào máu và mức glucose trong máu sẽ bắt đầu tăng lên. Trong các tế bào đích, insulin bắt đầu truyền tín hiệu, có tác dụng tăng hấp thu và lưu trữ glucose. Cuối cùng, insulin bị thoái hóa, chấm dứt phản ứng.

Ở động vật có vú, insulin được tổng hợp trong tuyến tụy trong các tế bào beta. Một triệu đến ba triệu đảo nhỏ tụy tạo thành một phần nội tiết của tuyến tụy, chủ yếu là một tuyến ngoại tiết. Phần nội tiết chỉ chiếm 2% tổng khối lượng của tuyến tụy. Trong các tiểu đảo tụy, các tế bào beta chiếm 65%-80% của tất cả các tế bào. [cần dẫn nguồn]
Insulin bao gồm hai chuỗi polypeptide, chuỗi A- và B-, được liên kết với nhau bằng liên kết disulfide. Tuy nhiên, lần đầu tiên nó được tổng hợp dưới dạng một polypeptide đơn gọi là preproinsulin trong các tế bào beta. Preproinsulin chứa một peptide tín hiệu dư lượng 24 chỉ đạo chuỗi polypeptide mới sinh đến mạng lưới nội chất thô (RER). Peptide tín hiệu được phân cắt khi polypeptide được chuyển thành lum của RER, tạo thành proinsulin.[40] Trong RER, proinsulin gấp thành hình dạng chính xác và 3 liên kết disulfide được hình thành. Khoảng 5 phút10 sau khi được lắp ráp trong mạng lưới nội chất, proinsulin được vận chuyển đến mạng lưới xuyên Golgi (TGN) nơi hình thành các hạt chưa trưởng thành. Vận chuyển đến TGN có thể mất khoảng 30 phút.
Proinsulin trải qua quá trình trưởng thành thành insulin hoạt động thông qua hoạt động của endopeptidase tế bào được gọi là prohormone convertase (PC1 và PC2), cũng như carboxypeptidase E của exoprotease.[41] Các endopeptidase phân cắt ở 2 vị trí, giải phóng một đoạn gọi là C-peptide và để lại 2 chuỗi peptide, chuỗi B- và A-, được liên kết bởi 2 liên kết disulfide. Các vị trí phân tách được đặt sau một cặp dư lượng cơ bản (lysine-64 và arginine-65, và arginine-31 và −32). Sau khi phân tách C-peptide, 2 cặp dư lượng cơ bản này được loại bỏ bởi carboxypeptidase.[42] C-peptide là phần trung tâm của proinsulin và chuỗi proinsulin chính đi theo thứ tự "BCA" (chuỗi B và A được xác định trên cơ sở khối lượng và C-peptide được phát hiện sau đó). [cần dẫn nguồn]
Insulin trưởng thành được đóng gói bên trong các hạt trưởng thành đang chờ các tín hiệu trao đổi chất (như leucine, arginine, glucose và mannose) và kích thích dây thần kinh phế vị được đưa ra khỏi tế bào vào tuần hoàn.[43]
Việc sản xuất insulin nội sinh được quy định trong một số bước trên con đường tổng hợp:
- Tại phiên mã từ gen insulin
- Trong ổn định mRNA
- Tại bản dịch mRNA
- Trong các sửa đổi hậu kỳ
Insulin và các protein liên quan của nó đã được chứng minh là được sản xuất bên trong não và mức độ giảm của các protein này có liên quan đến bệnh Alzheimer.[44][45][46]
Sự giải phóng insulin cũng được kích thích bởi sự kích thích thụ thể beta-2 và bị ức chế bởi sự kích thích thụ thể alpha-1. Ngoài ra, cortisol, glucagon và hormone tăng trưởng đối kháng với các hoạt động của insulin trong thời gian căng thẳng. Insulin cũng ức chế giải phóng axit béo bằng lipase nhạy cảm với hormone trong mô mỡ.[4]
Giải phóng
[sửa | sửa mã nguồn]Các tế bào beta trong các tiểu đảo Langerhans giải phóng insulin theo hai giai đoạn. Bản phát hành giai đoạn đầu nhanh chóng được kích hoạt để đáp ứng với mức đường huyết tăng, và kéo dài khoảng 10 phút. Giai đoạn thứ hai là sự giải phóng chậm, duy trì các túi mới hình thành được kích hoạt độc lập với đường, đạt đỉnh trong 2 đến 3 giờ. Giảm giải phóng insulin giai đoạn đầu có thể là khiếm khuyết tế bào beta có thể phát hiện sớm nhất dự đoán khởi phát loại 2 bệnh tiểu đường.[47] Phát hành giai đoạn đầu và độ nhạy insulin là yếu tố dự báo độc lập của bệnh tiểu đường.[48] Mô tả về việc giải phóng insulin giai đoạn đầu như sau:
- Glucose đi vào tế bào thông qua các chất vận chuyển glucose, GLUT2. Các chất vận chuyển glucose này có ái lực tương đối thấp với glucose, đảm bảo rằng tốc độ glucose vào tế bào proport tỷ lệ thuận với nồng độ glucose ngoại bào (trong phạm vi sinh lý). Ở mức đường trong máu thấp, rất ít glucose đi vào tế bào;; ở nồng độ glucose trong máu cao, lượng lớn glucose vào các tế bào này.[49]
- Glucose đi vào tế bào bị phosphoryl hóa thành glucose-6-phosphate (G-6-P) bởi glucokinase (hexokinase IV) không bị ức chế bởi G-6-P theo cách mà hexokinase trong các mô khác (hexokinase I - III) bị ảnh hưởng bởi sản phẩm này. Điều này có nghĩa là nồng độ G-6-P nội bào vẫn tỷ lệ thuận với nồng độ đường trong máu.[6][49]
- Glucose-6-phosphate đi vào con đường glycolytic và sau đó, thông qua phản ứng pyruvate dehydrogenase, vào chu trình Krebs, trong đó nhiều phân tử ATP năng lượng cao được tạo ra bởi quá trình oxy hóa acetyl CoA (chất nền chu trình Krebs), dẫn đến sự gia tăng trong tỷ lệ ATP: ADP trong tế bào.[50]
- Tỷ lệ ATP: ADP nội bào tăng sẽ đóng kênh kali SUR1 / Kir6.2 nhạy cảm với ATP (xem thụ thể sulfonylurea). Điều này ngăn cản các ion kali (K +) rời khỏi tế bào bằng cách khuếch tán thuận lợi, dẫn đến sự tích tụ các ion kali nội bào. Do đó, bên trong tế bào trở nên ít âm tính hơn so với bên ngoài, dẫn đến khử cực của màng bề mặt tế bào.
- Sau khi khử cực, các kênh ion calci điện áp (Ca 2+) mở ra, cho phép các ion calci di chuyển vào tế bào bằng cách khuếch tán thuận lợi.
- Nồng độ ion calci cytosolic cũng có thể được tăng lên bằng cách giải phóng calci từ các cửa hàng nội bào thông qua kích hoạt các thụ thể ryanodine.[51]
- Nồng độ ion calci trong cytosol của các tế bào beta cũng có thể, hoặc thêm vào đó, thông qua việc kích hoạt phospholipase C do sự liên kết của một phối tử ngoại bào (hormone hoặc chất dẫn truyền thần kinh) với thụ thể màng tế bào protein G. Phospholipase C tách màng phospholipid, phosphatidyl inositol 4,5-bisphosphate, thành inositol 1,4,5-trisphosphate và diacylglycerol. Inositol 1,4,5-trisphosphate (IP3) sau đó liên kết với các protein thụ thể trong màng huyết tương của mạng lưới nội chất (ER). Điều này cho phép giải phóng các ion Ca 2+ từ ER thông qua các kênh có IP3, làm tăng nồng độ tế bào của các ion calci độc lập với tác động của nồng độ glucose trong máu cao. Kích thích ký sinh trùng của các đảo nhỏ tụy hoạt động thông qua con đường này để tăng tiết insulin vào máu.[52]
- Lượng ion calci tăng lên đáng kể trong tế bào chất của tế bào gây ra sự giải phóng vào máu của insulin được tổng hợp trước đó, được lưu trữ trong các túi tiết nội bào.
Đây là cơ chế chính để giải phóng insulin. Các chất khác được biết để kích thích sự giải phóng insulin bao gồm các amino acid arginine và leucine, phát hành đối giao cảm của acetylcholine (diễn xuất thông qua con đường phospholipase C), sulfonylurea, cholecystokinin (CCK, cũng qua phospholipase C),[53] và theo đường ruột có nguồn gốc incretin, chẳng hạn như peptide giống glucagon-1 (GLP-1) và peptide insulinotropic phụ thuộc glucose (GIP).Sự giải phóng insulin bị ức chế mạnh bởi norepinephrine (noradrenaline), dẫn đến tăng đường huyết khi bị căng thẳng. Dường như việc giải phóng catecholamine bởi hệ thống thần kinh giao cảm có những ảnh hưởng mâu thuẫn đến việc giải phóng insulin bởi các tế bào beta, bởi vì sự giải phóng insulin bị ức chế bởi thụ thể α 2 -adrenergic [54] và được kích thích bởi thụ thể 2 -adrenergic.[55] Tác dụng ròng của norepinephrine từ các dây thần kinh giao cảm và epinephrine từ tuyến thượng thận trong việc giải phóng insulin là sự ức chế do sự thống trị của các thụ thể α-adrenergic.[56]
Khi mức glucose giảm xuống mức sinh lý thông thường, sự giải phóng insulin từ các tế bào β sẽ chậm lại hoặc dừng lại. Nếu mức đường huyết giảm thấp hơn mức này, đặc biệt là ở mức thấp nguy hiểm, hãy giải phóng hormone tăng đường huyết (nổi bật nhất là glucagon từ đảo tế bào Langerhans alpha) buộc glucose giải phóng glucose vào máu từ kho dự trữ glycogen ở gan, được bổ sung bằng gluconeogenogen các kho lưu trữ trở nên cạn kiệt. Bằng cách tăng đường huyết, các hormone tăng đường huyết ngăn ngừa hoặc điều chỉnh hạ đường huyết đe dọa tính mạng.Bằng chứng về việc giải phóng insulin giai đoạn đầu bị suy yếu có thể được nhìn thấy trong xét nghiệm dung nạp glucose, được chứng minh bằng mức đường huyết tăng đáng kể sau 30 phút sau khi uống glucose (75 hoặc 100 g glucose), sau đó giảm chậm 100 phút tiếp theo, duy trì trên 120 mg / 100 ml sau hai giờ sau khi bắt đầu thử nghiệm. Ở một người bình thường, mức đường huyết được điều chỉnh (và thậm chí có thể được điều chỉnh quá mức) vào cuối thử nghiệm. Tăng đột biến insulin là 'phản ứng đầu tiên' đối với việc tăng đường huyết, phản ứng này là riêng biệt và theo liều mặc dù trước đây nó luôn được coi là loại thực phẩm cụ thể.
Dao động
[sửa | sửa mã nguồn]
Ngay cả trong quá trình tiêu hóa, nói chung, một hoặc hai giờ sau bữa ăn, sự giải phóng insulin từ tuyến tụy không liên tục, nhưng dao động trong khoảng thời gian 3–6 phút, thay đổi từ việc tạo ra nồng độ insulin trong máu hơn khoảng 800 p mol / l đến dưới 100 pmol / l (ở chuột).[57] Điều này được cho là để tránh sự điều hòa quá mức của các thụ thể insulin trong các tế bào đích và hỗ trợ gan trích xuất insulin từ máu.[57] Sự dao động này rất quan trọng để xem xét khi sử dụng thuốc kích thích insulin, vì đó là nồng độ dao động của việc giải phóng insulin, nên, lý tưởng nhất, phải đạt được, không phải là nồng độ cao không đổi.[57] Điều này có thể đạt được bằng cách cung cấp insulin nhịp nhàng đến tĩnh mạch cửa, bằng cách cung cấp kích hoạt bằng ánh sáng, hoặc bằng cách ghép tế bào đảo tới gan.[57][58][59]
Nồng độ insulin trong máu
[sửa | sửa mã nguồn]
Nồng độ insulin trong máu có thể được đo bằng các đơn vị quốc tế, chẳng hạn như µIU/mL hoặc ở nồng độ mol, chẳng hạn như pmol/L, trong đó 1µIU/mL bằng 6,945 pmol/L.[60] Mức máu điển hình giữa các bữa ăn là 8-11 μIU/mL (57-79 pmol/L).[61]
Truyền tín hiệu
[sửa | sửa mã nguồn]Tác dụng của insulin được bắt đầu bằng sự gắn kết của nó với một thụ thể có trong màng tế bào. Phân tử thụ thể chứa một tiểu đơn vị α- và.. Hai phân tử được nối với nhau để tạo thành cái được gọi là homodimer. Insulin liên kết với các tiểu đơn vị α của homodimer, phải đối mặt với ngoại bào của các tế bào. Các tiểu đơn vị have có hoạt tính enzyme tyrosine kinase được kích hoạt bởi liên kết với insulin. Hoạt động này kích thích quá trình tự phosphoryl hóa các tiểu đơn vị and và sau đó là quá trình phosphoryl hóa protein bên trong tế bào được gọi là cơ chất thụ thể insulin (IRS). Sự phosphoryl hóa của IRS kích hoạt một tầng tải tín hiệu dẫn đến việc kích hoạt các kinase khác cũng như các yếu tố phiên mã làm trung gian tác động nội bào của insulin.[62]
Dòng thác dẫn đến việc đưa chất vận chuyển glucose GLUT4 vào màng tế bào của tế bào cơ và mỡ, và tổng hợp glycogen trong mô gan và cơ, cũng như chuyển đổi glucose thành triglyceride ở gan, mỡ và tuyến vú mô tuyến, hoạt động thông qua kích hoạt, bởi IRS-1, của phosphoinositol 3 kinase (PI3K). Enzyme này chuyển đổi một phospholipid trong màng tế bào với tên là phosphatidylinositol 4,5-bisphosphate (PIP2), thành phosphatidylinositol 3,4,5-triphosphate (PIP3), từ đó kích hoạt protein kinase B (PKB). PKB được kích hoạt tạo điều kiện cho sự kết hợp của GLUT4 chứa endosome với màng tế bào, dẫn đến sự gia tăng các chất vận chuyển GLUT4 trong màng plasma.[63] PKB cũng phosphorylates glycogen synthase kinase (GSK), do đó làm bất hoạt enzyme này.[64] Điều này có nghĩa là cơ chất của nó, glycogen synthase (GS), không thể bị phosphoryl hóa, và vẫn bị khử phospho hóa, và do đó hoạt động. Enzim hoạt động, glycogen synthase (GS), xúc tác bước giới hạn tốc độ trong quá trình tổng hợp glycogen từ glucose. Sự khử phospho tương tự ảnh hưởng đến các enzyme kiểm soát tốc độ đường phân dẫn đến tổng hợp chất béo thông qua malonyl-CoA trong các mô có thể tạo ra triglyceride và cũng là enzyme kiểm soát tốc độ gluconeogenesis ở gan. Hiệu quả tổng thể của các quá trình khử phospho enzyme cuối cùng là, trong các mô có thể thực hiện các phản ứng này, sự tổng hợp glycogen và chất béo từ glucose được kích thích, và sự sản xuất glucose của gan thông qua quá trình glycogenolysis và gluconeogenesis bị ức chế.[65] Sự phân hủy triglyceride bởi mô mỡ thành axit béo tự do và glycerol cũng bị ức chế.[65]
Sau khi tín hiệu nội bào phát sinh từ sự gắn kết insulin với thụ thể của nó đã được tạo ra, việc chấm dứt tín hiệu là cần thiết. Như được đề cập dưới đây trong phần về suy thoái, endocytosis và suy thoái của thụ thể liên kết với insulin là một cơ chế chính để kết thúc tín hiệu.[43] Ngoài ra, con đường truyền tín hiệu cũng bị chấm dứt bởi sự khử phospho của dư lượng tyrosine trong các con đường truyền tín hiệu khác nhau bởi tyrosine phosphatase. Serine / Threonine kinase cũng được biết là làm giảm hoạt động của insulin.
Cấu trúc của phức hợp thụ thể insulin đã được xác định bằng cách sử dụng các kỹ thuật của tinh thể học tia X.[66]
Tác dụng sinh lý
[sửa | sửa mã nguồn]

Các tác động của insulin đối với mức độ trao đổi chất của con người bao gồm:
- Tăng sự thu nhận của tế bào với một số chất nhất định, nổi bật nhất là glucose trong cơ và mô mỡ (khoảng hai phần ba tế bào cơ thể).[67]
- Tăng sự sao chép DNA và tổng hợp protein thông qua kiểm soát sự hấp thu amino acid.
- Sửa đổi hoạt động của nhiều enzyme.
Các tác động của insulin (gián tiếp và trực tiếp) trên các tế bào bao gồm:
- Kích thích sự hấp thu glucose - Insulin làm giảm nồng độ glucose trong máu bằng cách tạo ra sự hấp thu glucose của các tế bào. Điều này là có thể bởi vì Insulin gây ra việc đưa chất vận chuyển GLUT4 vào màng tế bào của các mô cơ và mỡ cho phép glucose đi vào tế bào.[62]
- Tăng tổng hợp chất béo - insulin buộc các tế bào mỡ phải hấp thụ glucose trong máu, được chuyển hóa thành triglyceride; giảm insulin gây ra điều ngược lại.[67]
- Tăng ester hóa axit béo - buộc mô mỡ tạo ra chất béo trung tính (nghĩa là triglyceride) từ axit béo; giảm insulin gây ra điều ngược lại.[67]
- Giảm lipolysis - lực giảm chuyển đổi dự trữ lipid tế bào mỡ thành axit béo trong máu và glycerol; giảm insulin gây ra điều ngược lại.[67]
- Kích thích tổng hợp glycogen - Khi nồng độ glucose cao, insulin gây ra sự hình thành glycogen bằng cách kích hoạt enzyme hexokinase, bổ sung một nhóm phosphate trong glucose, do đó dẫn đến một phân tử không thể thoát ra khỏi tế bào. Đồng thời, insulin ức chế enzyme glucose-6-phosphatase, loại bỏ nhóm phosphate. Hai enzyme này là chìa khóa cho sự hình thành glycogen. Ngoài ra, insulin kích hoạt các enzyme phosphofurationokinase và glycogen synthase chịu trách nhiệm tổng hợp glycogen.[68]
- Giảm gluconeogenesis và glycogenolysis - giảm sản xuất glucose từ chất nền không chứa carbohydrate, chủ yếu ở gan (phần lớn insulin nội sinh đến gan không bao giờ rời khỏi gan); giảm insulin gây ra sự sản xuất glucose của gan từ các chất nền.[67]
- Giảm phân giải protein - giảm sự phân hủy protein [67]
- Giảm autophagy - giảm mức độ thoái hóa của các bào quan bị hư hỏng. Mức độ sau bữa ăn ức chế hoàn toàn autophagy.[69]
- Tăng hấp thu amino acid - buộc các tế bào hấp thụ amino acid tuần hoàn; giảm insulin ức chế sự hấp thụ.[67]
- Tác động đến trương lực cơ động mạch - buộc cơ thành động mạch phải thư giãn, tăng lưu lượng máu, đặc biệt là trong các vi thông minh; giảm insulin làm giảm lưu lượng bằng cách cho phép các cơ này co lại.[70]
- Tăng tiết axit hydrochloric bởi các tế bào thành phần trong dạ dày.[cần dẫn nguồn]
- Tăng hấp thu kali - buộc các tế bào tổng hợp glycogen (một chất rất xốp, "ướt", làm tăng hàm lượng nước nội bào và các ion K + đi kèm) [71] để hấp thụ kali từ dịch ngoại bào; thiếu insulin ức chế sự hấp thụ. Insulin tăng sự hấp thu kali của tế bào làm giảm nồng độ kali trong huyết tương. Điều này có thể xảy ra thông qua sự chuyển vị trí do insulin của các Na+/K+-ATPase lên bề mặt của các tế bào cơ xương.[72][73]
- Giảm bài tiết natri thận.[74]
Insulin cũng ảnh hưởng đến các chức năng khác của cơ thể, chẳng hạn như thay đổi điện dung mạch máu và nhận thức. Một khi insulin đi vào não người, nó sẽ tăng cường khả năng học tập và trí nhớ và đặc biệt có lợi cho trí nhớ bằng lời nói.[75] Tăng cường tín hiệu insulin não bằng phương pháp quản lý insulin nội sọ cũng giúp tăng cường phản ứng nhiệt và điều trị cấp tính đối với lượng thức ăn, cho thấy rằng insulin thần kinh trung ương góp phần vào sự phối hợp của nhiều quá trình cân bằng nội môi hoặc điều hòa trong cơ thể con người.[76] Insulin cũng có tác dụng kích thích đối với hormone giải phóng gonadotropin từ vùng dưới đồi, do đó có lợi cho khả năng sinh sản.[77]
Thoái hóa
[sửa | sửa mã nguồn]Khi một phân tử insulin đã bám vào thụ thể và thực hiện hành động của nó, nó có thể được giải phóng trở lại môi trường ngoại bào, hoặc nó có thể bị suy thoái bởi tế bào. Hai vị trí chính để giải phóng insulin là gan và thận. Gan làm sạch hầu hết insulin trong quá trình vận chuyển đầu tiên, trong khi thận sẽ loại bỏ hầu hết insulin trong tuần hoàn hệ thống. Suy thoái thường liên quan đến việc nhập bào của phức hợp thụ thể insulin, sau đó là hoạt động của enzyme phân hủy insulin. Một phân tử insulin được sản xuất nội sinh bởi các tế bào beta được ước tính sẽ bị thoái hóa trong vòng khoảng một giờ sau khi được giải phóng ban đầu (thời gian bán hủy của insulin ~ 4-6 phút).[78][79]
Điều hòa chuyển hóa endocannabinoid
[sửa | sửa mã nguồn]Insulin là một chất điều hòa chính của chuyển hóa endocannabinoid (EC) và điều trị bằng insulin đã được chứng minh là làm giảm EC nội bào, 2-arachidonylglycerol (2-AG) và anandamide (AEA), tương ứng với sự thay đổi biểu hiện nhạy cảm với insulin trong chuyển hóa EC. Trong các tế bào mỡ kháng insulin, các mẫu biểu hiện enzyme do insulin bị xáo trộn theo cách phù hợp với tổng hợp EC tăng và giảm thoái hóa EC. Các phát hiện cho thấy kháng insulin tế bào mỡ không để điều chỉnh sự trao đổi chất và giảm EC nội bào mức EC để đáp ứng với kích thích insulin, trong đó béo phì cá nhân kháng insulin triển lãm tăng nồng độ của ECS.[80][81] Rối loạn này góp phần vào sự tích tụ chất béo nội tạng quá mức và giảm giải phóng adiponectin từ mô mỡ ở bụng, và hơn nữa là sự khởi đầu của một số yếu tố nguy cơ chuyển hóa tim có liên quan đến béo phì và tiểu đường loại 2.[82]
Hạ đường huyết
[sửa | sửa mã nguồn]Hạ đường huyết, còn được gọi là "lượng đường trong máu thấp", là khi lượng đường trong máu giảm xuống dưới mức bình thường.[83] Điều này có thể dẫn đến một loạt các triệu chứng bao gồm vụng về, nói chuyện rắc rối, nhầm lẫn, mất ý thức, co giật hoặc tử vong.[83] Một cảm giác đói, đổ mồ hôi, run rẩy và yếu đuối cũng có thể có mặt.[83] Các triệu chứng thường xuất hiện nhanh chóng.[83]
Nguyên nhân phổ biến nhất của hạ đường huyết là thuốc dùng để điều trị đái tháo đường như insulin và sulfonylureas.[84][85] Nguy cơ cao hơn ở bệnh nhân tiểu đường đã ăn ít hơn bình thường, tập thể dục nhiều hơn bình thường hoặc uống rượu.[83] Các nguyên nhân khác của hạ đường huyết bao gồm suy thận, một số khối u, chẳng hạn như insulinoma, bệnh gan, suy giáp, đói, lỗi chuyển hóa bẩm sinh, nhiễm trùng nặng, hạ đường huyết phản ứng và một số loại thuốc bao gồm rượu.[83][85] Lượng đường trong máu thấp có thể xảy ra ở những trẻ khỏe mạnh không ăn trong vài giờ.[86]
Bệnh và hội chứng
[sửa | sửa mã nguồn]Có một số điều kiện trong đó rối loạn insulin là bệnh lý:
- Đái tháo đường - thuật ngữ chung đề cập đến tất cả các tình trạng được đặc trưng bởi tăng đường huyết. Nó có thể thuộc các loại sau:[87]
- Loại 1 - phá hủy tự miễn qua trung gian các tế bào producing sản xuất insulin trong tuyến tụy, dẫn đến thiếu hụt insulin tuyệt đối
- Loại 2 - hoặc sản xuất insulin không đủ bởi các tế bào β hoặc kháng insulin hoặc cả hai vì nguyên do không hoàn toàn rõ ràng.
- có mối tương quan với chế độ ăn uống, với lối sống ít vận động, béo phì, tuổi tác và hội chứng chuyển hóa. Nhân quả đã được chứng minh ở nhiều sinh vật mô hình bao gồm chuột và khỉ; quan trọng, những người không béo phì mắc bệnh tiểu đường Loại 2 do chế độ ăn uống, lối sống ít vận động và các yếu tố nguy cơ chưa biết.
- có khả năng có sự nhạy cảm di truyền để phát triển bệnh tiểu đường Loại 2 trong một số điều kiện môi trường nhất định
- Các loại dung nạp glucose bị suy yếu khác (xem Tiểu đường)
- Insulinoma - một khối u của các tế bào beta sản xuất insulin dư thừa hoặc hạ đường huyết phản ứng.[88]
- Hội chứng chuyển hóa - một tình trạng kém hiểu biết đầu tiên được gọi là hội chứng X bởi Gerald Reaven. Hiện tại vẫn chưa rõ liệu hội chứng có một nguyên nhân duy nhất, có thể điều trị được hay là kết quả của sự thay đổi cơ thể dẫn đến bệnh tiểu đường loại 2. Nó được đặc trưng bởi huyết áp tăng, rối loạn lipid máu (rối loạn ở dạng cholesterol trong máu và các lipid máu khác) và tăng chu vi vòng eo (ít nhất là ở dân số ở hầu hết các nước phát triển). Nguyên nhân cơ bản có thể là tình trạng kháng insulin xảy ra trước bệnh tiểu đường loại 2, đó là khả năng giảm đáp ứng insulin ở một số mô (ví dụ: cơ, mỡ). Thông thường các bệnh lý như tăng huyết áp cần thiết, béo phì, tiểu đường loại 2 và bệnh tim mạch (CVD) sẽ phát triển.[89]
- Hội chứng buồng trứng đa nang - một hội chứng phức tạp ở phụ nữ trong những năm sinh sản, nơi anovulation và androgen dư thừa thường được hiển thị là hirsutism. Trong nhiều trường hợp PCOS, kháng insulin có mặt.[90]
Sử dụng trong y tế
[sửa | sửa mã nguồn]
Insulin sinh tổng hợp (insulin người rDNA, INN) dùng trong lâm sàng được sản xuất bằng công nghệ DNA tái tổ hợp.[8] Insulin sinh tổng hợp của con người đã tăng độ tinh khiết khi so sánh với insulin động vật chiết xuất, tăng cường độ tinh khiết làm giảm sự hình thành kháng thể. Các nhà nghiên cứu đã thành công trong việc đưa gen cho insulin người vào thực vật như một phương pháp sản xuất insulin khác ("biopharming") trong hồng hoa.[91] Kỹ thuật này được dự đoán để giảm chi phí sản xuất.
Một số chất tương tự của insulin người có sẵn. Các chất tương tự insulin này có liên quan chặt chẽ đến cấu trúc insulin của con người, và đã được phát triển cho các khía cạnh cụ thể của kiểm soát đường huyết về mặt hành động nhanh (insulins prandial) và hành động dài (insulins cơ bản).[92] Chất tương tự insulin sinh tổng hợp đầu tiên được phát triển để sử dụng lâm sàng vào bữa ăn (insulin dạng bột), Humalog (insulin lispro),[93] nó được hấp thu nhanh hơn sau khi tiêm dưới da so với insulin thông thường, với hiệu quả 15 phút sau khi tiêm. Tương tự nhanh chóng tác dụng khác là Novorapid và Apidra, với hồ sơ tương tự.[94] Tất cả đều được hấp thụ nhanh chóng do các chuỗi amino acid sẽ làm giảm sự hình thành các chất làm mờ và hexamer (insulins monomeric được hấp thụ nhanh hơn). Insulins tác dụng nhanh không yêu cầu khoảng thời gian tiêm vào bữa ăn được khuyến nghị trước đây đối với insulin người và insulin động vật. Loại khác là insulin tác dụng dài; đầu tiên trong số này là Lantus (insulin glargine). Chúng có tác dụng ổn định trong thời gian dài từ 18 đến 24 giờ Tương tự, một chất tương tự insulin kéo dài khác (Levemir) dựa trên phương pháp acyl hóa axit béo. Một phân tử axit myristic được gắn vào chất tương tự này, liên kết phân tử insulin với albumin huyết thanh dồi dào, từ đó giúp kéo dài tác dụng và giảm nguy cơ hạ đường huyết. Cả hai chất tương tự kéo dài chỉ cần được thực hiện một lần mỗi ngày và được sử dụng cho bệnh nhân tiểu đường loại 1 dưới dạng insulin cơ bản. Một sự kết hợp giữa tác dụng nhanh và insulin kéo dài cũng có sẵn, khiến bệnh nhân có nhiều khả năng đạt được một hồ sơ insulin bắt chước việc giải phóng insulin của cơ thể.[95][96]
Insulin thường được sử dụng dưới dạng tiêm dưới da bằng ống tiêm sử dụng một lần bằng kim, qua bơm insulin hoặc bằng bút insulin sử dụng nhiều lần bằng kim dùng một lần. Insulin hít cũng có sẵn ở thị trường Mỹ.
Insulin tổng hợp có thể kích hoạt tác dụng phụ, vì vậy một số người mắc bệnh tiểu đường phụ thuộc vào insulin nguồn động vật.[97]
Không giống như nhiều loại thuốc, insulin hiện không thể dùng bằng đường uống vì gần như tất cả các protein khác được đưa vào đường tiêu hóa, nó bị phá vỡ thành các mảnh, do đó mọi tác động đều bị mất. Đã có một số nghiên cứu về cách bảo vệ insulin khỏi đường tiêu hóa, để nó có thể được dùng bằng đường uống hoặc ngậm dưới lưỡi.[98][99]
Lịch sử nghiên cứu
[sửa | sửa mã nguồn]Khám phá
[sửa | sửa mã nguồn]Năm 1869, khi đang nghiên cứu cấu trúc của tuyến tụy dưới kính hiển vi, Paul Langerhans, một sinh viên y khoa ở Berlin, đã xác định một số khối mô không được chú ý trước đó nằm rải rác trên phần lớn tuyến tụy.[100] Chức năng của "đống tế bào nhỏ", sau này được gọi là các đảo nhỏ của Langerhans, ban đầu vẫn chưa được biết đến, nhưng Édouard Laguesse sau đó cho rằng chúng có thể tạo ra dịch tiết có vai trò điều tiết trong quá trình tiêu hóa.[101] Con trai của Paul Langerhans, Archibald, cũng đã giúp hiểu được vai trò điều tiết này.
Năm 1889, bác sĩ Oskar Minkowski, phối hợp với Joseph von Mering, đã loại bỏ tuyến tụy khỏi một con chó khỏe mạnh để kiểm tra vai trò giả định của nó trong tiêu hóa. Khi kiểm tra nước tiểu, họ đã tìm thấy đường, lần đầu tiên thiết lập mối quan hệ giữa tuyến tụy và bệnh tiểu đường. Năm 1901, một bước tiến quan trọng khác đã được thực hiện bởi bác sĩ và nhà khoa học người Mỹ, Eugene Lindsay Opie, khi ông tách biệt vai trò của tuyến tụy đối với các tiểu đảo Langerhans: "Đái tháo đường khi kết quả của một tổn thương của tuyến tụy là do sự phá hủy của tuyến tụy đảo Langerhans và chỉ xảy ra khi những thi thể này bị phá hủy một phần hoặc toàn bộ ".[102][103][104]
Trong hai thập kỷ tiếp theo, các nhà nghiên cứu đã thực hiện một số nỗ lực để cô lập dịch tiết của đảo nhỏ. Năm 1906, George Ludwig Zuelzer đã đạt được một phần thành công trong việc điều trị chó bằng chiết xuất tuyến tụy, nhưng ông không thể tiếp tục công việc của mình. Trong khoảng thời gian từ 1911 đến 1912, EL Scott tại Đại học Chicago đã thử các chất chiết xuất từ tụy và ghi nhận "sự giảm nhẹ của glycosuria", nhưng không thể thuyết phục được giám đốc về giá trị công việc của mình; dự án đã bị đóng cửa. Israel Kleiner đã chứng minh những hiệu ứng tương tự tại Đại học Rockefeller năm 1915, nhưng Thế chiến I làm gián đoạn công việc của ông và ông đã không quay trở lại với nó.[105]
Năm 1916, Nicolae Paulescu đã phát triển một dịch chiết tụy dạng nước, khi được tiêm vào một con chó mắc bệnh tiểu đường, có tác dụng bình thường hóa lượng đường trong máu. Ông đã phải gián đoạn các thí nghiệm của mình vì Chiến tranh thế giới thứ nhất, và vào năm 1921, ông đã viết bốn bài báo về công việc của mình được thực hiện ở Bucharest và các thử nghiệm của ông trên một con chó mắc bệnh tiểu đường. Cuối năm đó, ông đã xuất bản "Nghiên cứu về vai trò của tuyến tụy trong việc đồng hóa thực phẩm".[106][107]
Cái tên "insulin" được Edward Albert Sharpey-Schafer đặt ra vào năm 1916 cho một phân tử giả thuyết được sản xuất bởi các đảo nhỏ của Langerhans (insula Latin cho đảo nhỏ hoặc đảo) kiểm soát quá trình chuyển hóa glucose. Không biết đến Sharpey-Schafer, Jean de Meyer đã giới thiệu từ "insuline" rất giống nhau vào năm 1909 cho cùng một phân tử.[93][108]
Phân tách và thanh lọc
[sửa | sửa mã nguồn]Vào tháng 10 năm 1920, Frederick Bilt người Canada đã kết luận rằng dịch tiết tiêu hóa mà Minkowski đã nghiên cứu ban đầu đã phá vỡ sự bài tiết của tiểu đảo, do đó không thể trích xuất thành công. Một bác sĩ phẫu thuật bằng cách đào tạo, Banting biết một số động mạch có thể bị trói sẽ dẫn đến phần lớn tuyến tụy bị teo, trong khi vẫn còn nguyên các đảo nhỏ của Langerhans. Ông lý giải rằng một chiết xuất tương đối tinh khiết có thể được tạo ra từ các đảo nhỏ một khi phần lớn phần còn lại của tuyến tụy đã biến mất. Anh ta ghi lại một ghi chú cho chính mình: "Ligate ống tụy của con chó. Giữ chó sống cho đến khi acini thoái hóa rời khỏi đảo nhỏ. Cố gắng cô lập sự bài tiết bên trong của những thứ này và làm giảm đường niệu. " [109][110]

Vào mùa xuân năm 1921, Bilt đã tới Toronto để giải thích ý tưởng của mình cho JJR Macleod, Giáo sư Sinh lý học tại Đại học Toronto. Macleod ban đầu rất hoài nghi, vì Banting không có nền tảng nghiên cứu và không quen thuộc với tài liệu mới nhất, nhưng ông đã đồng ý cung cấp không gian phòng thí nghiệm cho Banting để thử nghiệm ý tưởng của mình. Macleod cũng đã sắp xếp cho hai sinh viên đại học trở thành trợ lý phòng thí nghiệm của Bilt vào mùa hè đó, nhưng Banting chỉ cần một trợ lý phòng thí nghiệm. Charles Best và Clark Noble đã lật một đồng xu; Best đã giành được xu tung và mất ca đầu tiên. Điều này thật đáng tiếc cho Noble, vì Bilt giữ Best trong toàn bộ mùa hè và cuối cùng chia sẻ một nửa số tiền thưởng Nobel và tín dụng cho khám phá với Best.[111] Vào ngày 30 tháng 7 năm 1921, Bilt và Best đã phân lập thành công một chiết xuất ("isleton") từ các đảo nhỏ của một con chó bị buộc ống và tiêm nó vào một con chó mắc bệnh tiểu đường, phát hiện ra rằng chiết xuất đã làm giảm 40% lượng đường trong máu trong 1 giờ.[110][112]
Banting và Best đã trình bày kết quả của họ cho Macleod khi trở về Toronto vào mùa thu năm 1921, nhưng Macleod đã chỉ ra những sai sót với thiết kế thử nghiệm, và đề nghị các thí nghiệm được lặp lại với nhiều con chó và thiết bị tốt hơn. Ông đã chuyển Banting và Tốt nhất vào một phòng thí nghiệm tốt hơn và bắt đầu trả Bites một mức lương từ các khoản tài trợ nghiên cứu của mình. Vài tuần sau, vòng thí nghiệm thứ hai cũng thành công và Macleod đã giúp công bố kết quả của họ một cách riêng tư tại Toronto vào tháng 11. Bị chặn bởi nhiệm vụ tốn thời gian của những con chó buộc ống và chờ vài tuần để trích xuất insulin, Bites đánh vào ý tưởng trích xuất insulin từ tuyến tụy của thai nhi, chưa phát triển tuyến tiêu hóa. Đến tháng 12, họ cũng đã thành công trong việc chiết xuất insulin từ tuyến tụy bò trưởng thành. Macleod đã ngừng tất cả các nghiên cứu khác trong phòng thí nghiệm của mình để tập trung vào việc tinh chế insulin. Ông đã mời nhà hóa sinh James Collip giúp đỡ trong nhiệm vụ này và nhóm nghiên cứu cảm thấy sẵn sàng cho một thử nghiệm lâm sàng trong vòng một tháng.[110]

Vào ngày 11 tháng 1 năm 1922, Leonard Thompson, một bệnh nhân tiểu đường 14 tuổi nằm chết tại Bệnh viện Đa khoa Toronto, đã được tiêm insulin đầu tiên.[113][114][115][116] Tuy nhiên, chiết xuất không trong sạch đến nỗi Thompson bị phản ứng dị ứng nghiêm trọng, và việc tiêm thêm đã bị hủy bỏ. Trong 12 ngày tiếp theo ngày, Collip làm việc cả ngày lẫn đêm để cải thiện chiết xuất ox-tụy. Một liều thứ hai đã được tiêm vào ngày 23 tháng 1, loại bỏ hoàn toàn đường niệu điển hình của bệnh tiểu đường mà không gây ra bất kỳ tác dụng phụ rõ ràng nào. Bệnh nhân người Mỹ đầu tiên là Elizabeth Hughes, con gái của Ngoại trưởng Hoa Kỳ Charles Evans Hughes.[117][118] Bệnh nhân đầu tiên được điều trị tại Mỹ là nghệ sĩ khắc gỗ tương lai James D. Havens;[119] Bác sĩ John Ralston Williams đã nhập insulin từ Toronto đến Rochester, New York để điều trị cho Havens.[120]
Banting và Best không bao giờ làm việc tốt với Collip, coi anh ta chỉ như một người cộng tác, và Collip đã rời khỏi dự án ngay sau đó. Vào mùa xuân năm 1922, Best đã xoay xở để cải thiện các kỹ thuật của mình đến mức có thể chiết xuất một lượng lớn insulin theo yêu cầu, nhưng các sản phẩm thu được vẫn không sạch. Công ty dược phẩm Eli Lilly và Company đã cung cấp hỗ trợ không lâu sau các ấn phẩm đầu tiên vào năm 1921, và họ đã đưa Lilly lên lời đề nghị vào tháng Tư. Vào tháng 11, nhà hóa học trưởng của Lilly, George B. Walden đã phát hiện ra kết tủa đẳng điện và có thể sản xuất một lượng lớn insulin tinh chế cao. Ngay sau đó, insulin được rao bán cho công chúng.
Bằng sáng chế
[sửa | sửa mã nguồn]Đến cuối tháng 1 năm 1922, những căng thẳng gắn kết giữa bốn "đồng phát hiện" insulin và Collip đã đe dọa một thời gian ngắn để cấp bằng sáng chế riêng cho quá trình thanh lọc của ông. John G. FitzGerald, giám đốc của tổ chức y tế công cộng phi thương mại Connaught Lab Laboratory, do đó bước vào với tư cách là người hòa giải. Thỏa thuận kết quả ngày 25 tháng 1 năm 1922 đã xác định hai điều kiện chính: 1) rằng các cộng tác viên sẽ ký hợp đồng đồng ý không lấy bằng sáng chế với một công ty dược phẩm thương mại trong thời gian làm việc ban đầu với Connaught; và 2) không cho phép thay đổi chính sách nghiên cứu trừ khi được thảo luận lần đầu giữa FitzGerald và bốn cộng tác viên.[121] Nó đã giúp ngăn chặn sự bất đồng và gắn kết nghiên cứu với nhiệm vụ công khai của Connaught.
Ban đầu, Macleod và Banting miễn cưỡng đăng ký bằng sáng chế quy trình của họ về insulin với lý do y đức. Tuy nhiên, vẫn còn lo ngại rằng một bên thứ ba tư nhân sẽ chiếm quyền điều khiển và độc quyền nghiên cứu (như Eli Lilly và Công ty đã từng làm[122]), và phân phối an toàn sẽ khó đảm bảo nếu không có khả năng kiểm soát chất lượng. Cuối cùng, Edward Calvin Kendall đã đưa ra lời khuyên có giá trị. Ông đã phân lập thyroxin tại Phòng khám Mayo vào năm 1914 và được cấp bằng sáng chế cho quá trình này thông qua sự sắp xếp giữa ông, anh em Mayo và Đại học Minnesota, chuyển giao bằng sáng chế cho trường đại học công lập.[123] Vào ngày 12 tháng 4, Bilt, Best, Collip, Macleod và FitzGerald đã viết thư cho chủ tịch của Đại học Toronto để đề xuất một thỏa thuận tương tự với mục đích giao bằng sáng chế cho Hội đồng Thống đốc của Đại học.[124] Bức thư nhấn mạnh rằng:[125]
- Bằng sáng chế sẽ không được sử dụng cho bất kỳ mục đích nào khác ngoài việc ngăn chặn việc lấy bằng sáng chế của người khác. Khi các chi tiết về phương pháp chuẩn bị được công bố, bất kỳ ai cũng có thể tự do chuẩn bị chiết xuất, nhưng không ai có thể đảm bảo độc quyền có lợi nhuận.
Việc chuyển nhượng cho Hội đồng Thống đốc Đại học Toronto được hoàn thành vào ngày 15 tháng 1 năm 1923, với khoản thanh toán mã thông báo là 1 đô la.[126] Sự sắp xếp đã được chúc mừng trong Công trình Thế giới năm 1923 là "một bước tiến trong y đức".[127] Nó cũng đã nhận được nhiều sự chú ý của truyền thông trong những năm 2010 liên quan đến vấn đề chăm sóc sức khỏe và khả năng chi trả thuốc.
Sau những lo ngại khác liên quan đến nỗ lực của Eli Lilly trong việc tách riêng các phần bằng sáng chế của quy trình sản xuất, Trợ lý Giám đốc và Trưởng phòng Insulin của Connaught, Robert Defries đã thiết lập một chính sách tổng hợp bằng sáng chế, yêu cầu các nhà sản xuất chia sẻ tự do bất kỳ cải tiến nào trong quá trình sản xuất mà không ảnh hưởng đến khả năng chi trả.[128]
Phân tích và tổng hợp cấu trúc
[sửa | sửa mã nguồn]Insulin có nguồn gốc từ động vật được tinh chế ban đầu là loại insulin duy nhất có sẵn cho các thí nghiệm và bệnh nhân tiểu đường. John Jacob Abel là người đầu tiên tạo ra dạng kết tinh của nó vào năm 1926.[129] Bằng chứng về bản chất protein được đưa ra đầu tiên bởi Michael Somogyi, Edward A. Doisy và Philip A. Shaffer vào năm 1924.[130] Nó đã được chứng minh đầy đủ khi Hans Jensen và Earl A. Evans Jr. cô lập các amino acid phenylalanine và proline vào năm 1935.[131]
Cấu trúc amino acid của insulin được đặc trưng lần đầu tiên vào năm 1951 bởi Frederick Sanger,[13][132] và insulin tổng hợp đầu tiên được sản xuất đồng thời trong phòng thí nghiệm của Panayotis Katsoyannis tại Đại học Pittsburgh và Helmut Zahn tại Đại học RWTH Aachen ở giữa -1960 [133][134][135][136][137] Insulin bò tinh thể tổng hợp đã đạt được bởi các nhà nghiên cứu Trung Quốc vào năm 1965.[138] Cấu trúc 3 chiều hoàn chỉnh của insulin được xác định bằng tinh thể học tia X trong phòng thí nghiệm của Dorothy Hodgkin năm 1969.[139]
Loại insulin "người" tổng hợp biến đổi gen đầu tiên được sản xuất bằng E. coli vào năm 1978 bởi Arthur Riggs và Keiichi Itakura tại Viện nghiên cứu Beckman của Thành phố Hope hợp tác với Herbert Boyer tại Genentech.[9][10] Genentech, được thành lập bởi Swanson, Boyer và Eli Lilly và Company, đã tiếp tục vào năm 1982 để bán insulin sinh tổng hợp có sẵn trên thị trường dưới tên Humulin.[10] Phần lớn insulin hiện đang được sử dụng trên toàn thế giới hiện nay là insulin "người" tái tổ hợp sinh học hoặc các chất tương tự của nó.[140] Gần đây, một cách tiếp cận khác đã được sử dụng bởi một nhóm các nhà nghiên cứu tiên phong ở Canada, sử dụng một cây rum dễ trồng, để sản xuất insulin rẻ hơn nhiều.[141]
Insulin tái tổ hợp được sản xuất hoặc trong nấm men (thường là Saccharomyces cerevisiae) hoặc E. coli.[142] Trong nấm men, insulin có thể được thiết kế dưới dạng protein chuỗi đơn với endoprotease KexII (tương đồng men của PCI / PCII) tách chuỗi insulin A ra khỏi chuỗi insulin B bị cắt ngắn. Một đuôi C được tổng hợp hóa học sau đó được ghép vào insulin bằng cách phân giải protein ngược bằng cách sử dụng trypsin protease rẻ tiền; thông thường, lysine trên đuôi C được bảo vệ với nhóm bảo vệ hóa học để ngăn chặn sự phân giải protein. Sự dễ dàng của tổng hợp mô-đun và sự an toàn tương đối của các sửa đổi trong khu vực đó chiếm các chất tương tự insulin phổ biến với sửa đổi đầu C (ví dụ: lispro, aspart, glulisine). Sự tổng hợp Genentech và tổng hợp hóa học hoàn toàn như Bruce Merrifield không được ưa thích vì hiệu quả tái hợp hai chuỗi insulin thấp, chủ yếu là do sự cạnh tranh với sự kết tủa của chuỗi insulin B.
Các giải Nobel
[sửa | sửa mã nguồn]
Ủy ban giải thưởng Nobel năm 1923 đã ghi nhận việc trích xuất insulin thực tế cho một nhóm nghiên cứu tại Đại học Toronto và trao giải thưởng Nobel cho hai người đàn ông: Frederick Banting và JJR Macleod.[143] Họ đã được trao giải thưởng Nobel về sinh lý học hoặc y học năm 1923 vì phát hiện ra insulin. Banting, cho rằng Best không được đề cập,[144] đã chia sẻ giải thưởng của mình với Best, và Macleod ngay lập tức chia sẻ giải thưởng của mình với James Collip. Bằng sáng chế về insulin đã được bán cho Đại học Toronto với giá một đô la.
Hai giải thưởng Nobel khác đã được trao cho công trình về insulin. Nhà sinh vật học phân tử người Anh Frederick Sanger, người đã xác định cấu trúc chính của insulin vào năm 1955, đã được trao giải thưởng Nobel về hóa học năm 1958.[13] Rosalyn Sussman Yalow đã nhận được giải thưởng Nobel về y học năm 1977 vì sự phát triển của phương pháp miễn dịch phóng xạ cho insulin.
Một số giải thưởng Nobel cũng có mối liên hệ gián tiếp với insulin. George Minot, đồng nhận giải thưởng Nobel năm 1934 vì đã phát triển phương pháp điều trị hiệu quả đầu tiên cho bệnh thiếu máu ác tính, bị đái tháo đường. Tiến sĩ William Castle quan sát thấy rằng việc phát hiện ra insulin năm 1921, đến kịp thời để giữ cho Minot sống, do đó cũng chịu trách nhiệm cho việc phát hiện ra một phương pháp chữa bệnh thiếu máu ác tính.[145] Dorothy Hodgkin đã được trao giải thưởng Nobel về hóa học năm 1964 vì sự phát triển của tinh thể học, kỹ thuật mà bà đã sử dụng để giải mã cấu trúc phân tử hoàn chỉnh của insulin vào năm 1969.[139]
Tranh cãi
[sửa | sửa mã nguồn]
Công trình được xuất bản bởi Banting, Best, Collip và Macleod đại diện cho việc chuẩn bị chiết xuất insulin tinh khiết phù hợp để sử dụng cho bệnh nhân.[146] Mặc dù Paulescu đã khám phá ra các nguyên tắc điều trị, chiết xuất nước muối của ông không thể được sử dụng trên người; ông đã không được đề cập trong giải thưởng Nobel năm 1923. Giáo sư Ian Murray đặc biệt tích cực trong việc làm việc để sửa chữa "sai lầm lịch sử" chống lại Nicolae Paulescu. Murray là giáo sư sinh lý học tại Đại học Y khoa Anderson ở Glasgow, Scotland, trưởng khoa Bệnh chuyển hóa tại một bệnh viện hàng đầu ở Glasgow, phó chủ tịch Hiệp hội Tiểu đường Anh, và là thành viên sáng lập của Liên đoàn Đái tháo đường Quốc tế. Murray đã viết:
- Sự công nhận không đầy đủ đã được trao cho Paulescu, nhà khoa học nổi tiếng người Rumani, lúc đó, khi nhóm nghiên cứu ở Toronto đang bắt đầu nghiên cứu, họ đã thành công trong việc chiết xuất hormone chống đái tháo đường của tuyến tụy và chứng minh hiệu quả của nó trong việc giảm chứng tăng đường huyết ở chó mắc bệnh tiểu đường.[147]
Trong một cuộc trao đổi riêng tư, Giáo sư Arne Tiselius, cựu viện trưởng Viện Nobel, bày tỏ quan điểm cá nhân rằng Paulescu cũng xứng đáng với giải thưởng năm 1923.[148]
Xem thêm
[sửa | sửa mã nguồn]- Hormone Glucagon
- Hormone Adrenaline
- Hormone Cortisol
Tham khảo
[sửa | sửa mã nguồn]- ^ "Insulin | Meaning of Insulin by Lexico". Lexico Dictionaries | English. Bản gốc lưu trữ ngày 1 tháng 8 năm 2020. Truy cập ngày 2 tháng 8 năm 2020.
- ^ "insulin - WordReference.com Dictionary of English". www.wordreference.com.
- ^ a b Voet D, Voet JG (2011). Biochemistry (ấn bản thứ 4). New York: Wiley.
- ^ a b c d Stryer L (1995). Biochemistry . New York: W.H. Freeman and Company. tr. 773–74. ISBN 0-7167-2009-4.
- ^ Sonksen P, Sonksen J (tháng 7 năm 2000). "Insulin: understanding its action in health and disease". British Journal of Anaesthesia. Quyển 85 số 1. tr. 69–79. doi:10.1093/bja/85.1.69. PMID 10927996.
- ^ a b c d e f g Koeslag JH, Saunders PT, Terblanche E (tháng 6 năm 2003). "A reappraisal of the blood glucose homeostat which comprehensively explains the type 2 diabetes mellitus-syndrome X complex". The Journal of Physiology. Quyển 549 số Pt 2 (xuất bản 2003). tr. 333–46. doi:10.1113/jphysiol.2002.037895. PMC 2342944. PMID 12717005.
- ^ American Society of Health-System Pharmacists (ngày 1 tháng 2 năm 2009). "Insulin Injection". PubMed Health. National Center for Biotechnology Information, U.S. National Library of Medicine. Truy cập ngày 12 tháng 10 năm 2012.
- ^ a b Drug Information Portal NLM – Insulin human USAN http://druginfo.nlm.nih.gov/drugportal/
- ^ a b "First Successful Laboratory Production of Human Insulin Announced". News Release. Genentech. ngày 6 tháng 9 năm 1978. Bản gốc lưu trữ ngày 27 tháng 9 năm 2016. Truy cập ngày 26 tháng 9 năm 2016.
- ^ a b c Tof I (1994). "Recombinant DNA technology in the synthesis of human insulin". Little Tree Publishing. Truy cập ngày 3 tháng 11 năm 2009.
- ^ Aggarwal SR (tháng 12 năm 2012). "What's fueling the biotech engine-2011 to 2012". Nature Biotechnology. Quyển 30 số 12. tr. 1191–7. doi:10.1038/nbt.2437. PMID 23222785.
- ^ a b c d Weiss M, Steiner DF, Philipson LH (2000). "Insulin Biosynthesis, Secretion, Structure, and Structure-Activity Relationships". Trong Feingold KR, Anawalt B, Boyce A, Chrousos G, Dungan K, Grossman A, và đồng nghiệp (biên tập). Endotext. MDText.com, Inc. PMID 25905258. Truy cập ngày 18 tháng 2 năm 2020.
- ^ a b c Stretton AO (tháng 10 năm 2002). "The first sequence. Fred Sanger and insulin". Genetics. Quyển 162 số 2. tr. 527–32. PMC 1462286. PMID 12399368.
- ^ Editor (ngày 15 tháng 1 năm 2019). "The discovery and development of insulin as a medical treatment can be traced back to the 19th century". Diabetes (bằng tiếng Anh). Truy cập ngày 17 tháng 2 năm 2020. {{Chú thích web}}: |tác giả= có tên chung (trợ giúp)
- ^ "19th WHO Model List of Essential Medicines (April 2015)" (PDF). WHO. tháng 4 năm 2015. Truy cập ngày 10 tháng 5 năm 2015.
- ^ a b de Souza AM, López JA (2004). "Insulin or insulin-like studies on unicellular organisms: a review". Braz. Arch. Biol. Technol. Quyển 47 số 6. tr. 973–81. doi:10.1590/S1516-89132004000600017.
- ^ LeRoith D, Shiloach J, Heffron R, Rubinovitz C, Tanenbaum R, Roth J (tháng 8 năm 1985). "Insulin-related material in microbes: similarities and differences from mammalian insulins". Canadian Journal of Biochemistry and Cell Biology. Quyển 63 số 8. tr. 839–49. doi:10.1139/o85-106. PMID 3933801.
- ^ Wright JR, Yang H, Hyrtsenko O, Xu BY, Yu W, Pohajdak B (2014). "A review of piscine islet xenotransplantation using wild-type tilapia donors and the production of transgenic tilapia expressing a "humanized" tilapia insulin". Xenotransplantation. Quyển 21 số 6. tr. 485–95. doi:10.1111/xen.12115. PMC 4283710. PMID 25040337.
- ^ "Deadly sea snail uses weaponised insulin to make its prey sluggish". ngày 19 tháng 1 năm 2015.
- ^ Safavi-Hemami H, Gajewiak J, Karanth S, Robinson SD, Ueberheide B, Douglass AD, Schlegel A, Imperial JS, Watkins M, Bandyopadhyay PK, Yandell M, Li Q, Purcell AW, Norton RS, Ellgaard L, Olivera BM (tháng 2 năm 2015). "Specialized insulin is used for chemical warfare by fish-hunting cone snails". Proceedings of the National Academy of Sciences of the United States of America. Quyển 112 số 6. tr. 1743–48. Bibcode:2015PNAS..112.1743S. doi:10.1073/pnas.1423857112. PMC 4330763. PMID 25605914.
- ^ a b "Entrez Gene: INS insulin".
- ^ Bell GI, Pictet RL, Rutter WJ, Cordell B, Tischer E, Goodman HM (tháng 3 năm 1980). "Sequence of the human insulin gene". Nature. Quyển 284 số 5751. tr. 26–32. Bibcode:1980Natur.284...26B. doi:10.1038/284026a0. PMID 6243748.
- ^ Bernardo AS, Hay CW, Docherty K (tháng 11 năm 2008). "Pancreatic transcription factors and their role in the birth, life and survival of the pancreatic beta cell" (PDF). review. Molecular and Cellular Endocrinology. Quyển 294 số 1–2. tr. 1–9. doi:10.1016/j.mce.2008.07.006. PMID 18687378.
- ^ Rutter GA, Pullen TJ, Hodson DJ, Martinez-Sanchez A (tháng 3 năm 2015). "Pancreatic β-cell identity, glucose sensing and the control of insulin secretion". review. The Biochemical Journal. Quyển 466 số 2. tr. 203–18. doi:10.1042/BJ20141384. PMID 25697093.
- ^ Rutter GA, Tavaré JM, Palmer DG (tháng 6 năm 2000). "Regulation of Mammalian Gene Expression by Glucose". review. News in Physiological Sciences. Quyển 15 số 3. tr. 149–54. doi:10.1152/physiologyonline.2000.15.3.149. PMID 11390898.
- ^ Poitout V, Hagman D, Stein R, Artner I, Robertson RP, Harmon JS (tháng 4 năm 2006). "Regulation of the insulin gene by glucose and d acids". review. The Journal of Nutrition. Quyển 136 số 4. tr. 873–76. doi:10.1093/jn/136.4.873. PMC 1853259. PMID 16549443.
- ^ Vaulont S, Vasseur-Cognet M, Kahn A (tháng 10 năm 2000). "Glucose regulation of gene transcription". review. The Journal of Biological Chemistry. Quyển 275 số 41. tr. 31555–58. doi:10.1074/jbc.R000016200. PMID 10934218.
- ^ Christensen DP, Dahllöf M, Lundh M, Rasmussen DN, Nielsen MD, Billestrup N, Grunnet LG, Mandrup-Poulsen T (2011). "Histone deacetylase (HDAC) inhibition as a novel treatment for diabetes mellitus". Molecular Medicine. Quyển 17 số 5–6. tr. 378–90. doi:10.2119/molmed.2011.00021. PMC 3105132. PMID 21274504.
- ^ Wang W, Shi Q, Guo T, Yang Z, Jia Z, Chen P, Zhou C (tháng 6 năm 2016). "PDX1 and ISL1 differentially coordinate with epigenetic modifications to regulate insulin gene expression in varied glucose concentrations". Molecular and Cellular Endocrinology. Quyển 428. tr. 38–48. doi:10.1016/j.mce.2016.03.019. PMID 26994512.
- ^ Wang X, Wei X, Pang Q, Yi F (tháng 8 năm 2012). "Histone deacetylases and their inhibitors: molecular mechanisms and therapeutic implications in diabetes mellitus". Acta Pharmaceutica Sinica B. Quyển 2 số 4. tr. 387–95. doi:10.1016/j.apsb.2012.06.005.
- ^ a b Andrali SS, Sampley ML, Vanderford NL, Ozcan S (tháng 10 năm 2008). "Glucose regulation of insulin gene expression in pancreatic beta-cells". review. The Biochemical Journal. Quyển 415 số 1. tr. 1–10. doi:10.1042/BJ20081029. PMID 18778246.
- ^ Kaneto H, Matsuoka TA, Kawashima S, Yamamoto K, Kato K, Miyatsuka T, Katakami N, Matsuhisa M (tháng 7 năm 2009). "Role of MafA in pancreatic beta-cells". Advanced Drug Delivery Reviews. Quyển 61 số 7–8. tr. 489–96. doi:10.1016/j.addr.2008.12.015. PMID 19393272.
- ^ Aramata S, Han SI, Kataoka K (tháng 12 năm 2007). "Roles and regulation of transcription factor MafA in islet beta-cells". Endocrine Journal. Quyển 54 số 5. tr. 659–66. doi:10.1507/endocrj.KR-101. PMID 17785922.
- ^ Kaneto H, Matsuoka TA (tháng 10 năm 2012). "Involvement of oxidative stress in suppression of insulin biosynthesis under diabetic conditions". International Journal of Molecular Sciences. Quyển 13 số 10. tr. 13680–90. doi:10.3390/ijms131013680. PMC 3497347. PMID 23202973.{{Chú thích tạp chí}}: Quản lý CS1: DOI truy cập mở nhưng không được đánh ký hiệu (liên kết)
- ^ "Insulin human". PubChem. Truy cập ngày 26 tháng 2 năm 2019.
- ^ a b c Fu Z, Gilbert ER, Liu D (tháng 1 năm 2013). "Regulation of insulin synthesis and secretion and pancreatic Beta-cell dysfunction in diabetes". Current Diabetes Reviews. Quyển 9 số 1. tr. 25–53. doi:10.2174/157339913804143225. PMC 3934755. PMID 22974359.
- ^ Dunn MF (tháng 8 năm 2005). "Zinc-ligand interactions modulate assembly and stability of the insulin hexamer -- a review". Biometals. Quyển 18 số 4. tr. 295–303. doi:10.1007/s10534-005-3685-y. PMID 16158220.
- ^ Ivanova MI, Sievers SA, Sawaya MR, Wall JS, Eisenberg D (tháng 11 năm 2009). "Molecular basis for insulin fibril assembly". Proceedings of the National Academy of Sciences of the United States of America. Quyển 106 số 45. tr. 18990–5. Bibcode:2009PNAS..10618990I. doi:10.1073/pnas.0910080106. PMC 2776439. PMID 19864624.
- ^ Rhoades RA, Bell DR (2009). Medical physiology: principles for clinical medicine (ấn bản thứ 3). Philadelphia: Lippincott Williams & Wilkins. tr. 644–47. ISBN 978-0-7817-6852-8.
- ^ Kahn CR, Weir GC (2005). Joslin's Diabetes Mellitus (ấn bản thứ 14). Lippincott Williams & Wilkins. ISBN 978-8493531836.
- ^ Steiner DF, Oyer PE (tháng 2 năm 1967). "The biosynthesis of insulin and a probable precursor of insulin by a human islet cell adenoma". Proceedings of the National Academy of Sciences of the United States of America. Quyển 57 số 2. tr. 473–80. Bibcode:1967PNAS...57..473S. doi:10.1073/pnas.57.2.473. PMC 335530. PMID 16591494.
- ^ Creighton TE (1993). Proteins: Structures and Molecular Properties (ấn bản thứ 2). W H Freeman and Company. tr. 81–83. ISBN 978-0-7167-2317-2.
- ^ a b Najjar S (2001). "Insulin Action: Molecular Basis of Diabetes". Encyclopedia of Life Sciences. John Wiley & Sons. doi:10.1038/npg.els.0001402. ISBN 978-0470016176.
- ^ Gustin N (ngày 7 tháng 3 năm 2005). "Researchers discover link between insulin and Alzheimer's". EurekAlert!. American Association for the Advancement of Science. Bản gốc lưu trữ ngày 6 tháng 2 năm 2009. Truy cập ngày 1 tháng 1 năm 2009.
- ^ de la Monte SM, Wands JR (tháng 2 năm 2005). "Review of insulin and insulin-like growth factor expression, signaling, and malfunction in the central nervous system: relevance to Alzheimer's disease" (PDF). Journal of Alzheimer's Disease. Quyển 7 số 1. tr. 45–61. doi:10.3233/JAD-2005-7106. PMID 15750214.
- ^ Steen E, Terry BM, Rivera EJ, Cannon JL, Neely TR, Tavares R, Xu XJ, Wands JR, de la Monte SM (tháng 2 năm 2005). "Impaired insulin and insulin-like growth factor expression and signaling mechanisms in Alzheimer's disease—is this type 3 diabetes?" (PDF). Journal of Alzheimer's Disease. Quyển 7 số 1. tr. 63–80. doi:10.3233/jad-2005-7107. PMID 15750215.
- ^ Gerich JE (tháng 2 năm 2002). "Is reduced first-phase insulin release the earliest detectable abnormality in individuals destined to develop type 2 diabetes?". Diabetes. Quyển 51 số Suppl 1. tr. S117–21. doi:10.2337/diabetes.51.2007.s117. PMID 11815469.
- ^ Lorenzo C, Wagenknecht LE, Rewers MJ, Karter AJ, Bergman RN, Hanley AJ, Haffner SM (tháng 9 năm 2010). "Disposition index, glucose effectiveness, and conversion to type 2 diabetes: the Insulin Resistance Atherosclerosis Study (IRAS)". Diabetes Care. Quyển 33 số 9. tr. 2098–103. doi:10.2337/dc10-0165. PMC 2928371. PMID 20805282.
- ^ a b Schuit F, Moens K, Heimberg H, Pipeleers D (tháng 11 năm 1999). "Cellular origin of hexokinase in pancreatic islets". The Journal of Biological Chemistry. Quyển 274 số 46 (xuất bản 1999). tr. 32803–09. doi:10.1074/jbc.274.46.32803. PMID 10551841.
- ^ Schuit F, De Vos A, Farfari S, Moens K, Pipeleers D, Brun T, Prentki M (tháng 7 năm 1997). "Metabolic fate of glucose in purified islet cells. Glucose-regulated anaplerosis in beta cells". The Journal of Biological Chemistry. Quyển 272 số 30 (xuất bản 1997). tr. 18572–79. doi:10.1074/jbc.272.30.18572. PMID 9228023.
- ^ Santulli G, Pagano G, Sardu C, Xie W, Reiken S, D'Ascia SL, Cannone M, Marziliano N, Trimarco B, Guise TA, Lacampagne A, Marks AR (tháng 5 năm 2015). "Calcium release channel RyR2 regulates insulin release and glucose homeostasis". The Journal of Clinical Investigation. Quyển 125 số 5. tr. 1968–78. doi:10.1172/JCI79273. PMC 4463204. PMID 25844899.
- ^ Stryer L (1995). Biochemistry . New York: W.H. Freeman and Company. tr. 343–44. ISBN 0-7167-2009-4.
- ^ Cawston EE, Miller LJ (tháng 3 năm 2010). "Therapeutic potential for novel drugs targeting the type 1 cholecystokinin receptor". British Journal of Pharmacology. Quyển 159 số 5. tr. 1009–21. doi:10.1111/j.1476-5381.2009.00489.x. PMC 2839260. PMID 19922535.
- ^ Nakaki T, Nakadate T, Kato R (tháng 8 năm 1980). "Alpha 2-adrenoceptors modulating insulin release from isolated pancreatic islets". Naunyn-Schmiedeberg's Archives of Pharmacology. Quyển 313 số 2. tr. 151–53. doi:10.1007/BF00498572. PMID 6252481.
- ^ Layden BT, Durai V, Lowe WL Jr (2010). "G-Protein-Coupled Receptors, Pancreatic Islets, and Diabetes". Nature Education. Quyển 3 số 9. tr. 13.
- ^ Sircar S (2007). Medical Physiology. Stuttgart: Thieme Publishing Group. tr. 537–38. ISBN 978-3-13-144061-7.
- ^ a b c d e Hellman B, Gylfe E, Grapengiesser E, Dansk H, Salehi A (2007). "[Insulin oscillations—clinically important rhythm. Antidiabetics should increase the pulsative component of the insulin release]". Läkartidningen (bằng tiếng Thụy Điển). Quyển 104 số 32–33. tr. 2236–39. PMID 17822201.
- ^ Sarode BR, Kover K, Tong PY, Zhang C, Friedman SH (tháng 11 năm 2016). "Light Control of Insulin Release and Blood Glucose Using an Injectable Photoactivated Depot". Molecular Pharmaceutics. Quyển 13 số 11. tr. 3835–3841. doi:10.1021/acs.molpharmaceut.6b00633. PMC 5101575. PMID 27653828.
- ^ Jain PK, Karunakaran D, Friedman SH (tháng 1 năm 2013). "Construction of a photoactivated insulin depot" (PDF). Angewandte Chemie. Quyển 52 số 5. tr. 1404–9. doi:10.1002/anie.201207264. PMID 23208858. Bản gốc (PDF) lưu trữ ngày 2 tháng 11 năm 2019. Truy cập ngày 2 tháng 8 năm 2020.
- ^ A Dictionary of Units of Measurement Lưu trữ ngày 28 tháng 10 năm 2013 tại Wayback Machine By Russ Rowlett, the University of North Carolina at Chapel Hill. ngày 13 tháng 6 năm 2001
- ^ Iwase H, Kobayashi M, Nakajima M, Takatori T (tháng 1 năm 2001). "The ratio of insulin to C-peptide can be used to make a forensic diagnosis of exogenous insulin overdosage". Forensic Science International. Quyển 115 số 1–2. tr. 123–27. doi:10.1016/S0379-0738(00)00298-X. PMID 11056282.
- ^ a b "Handbook of Diabetes, 4th Edition, Excerpt #4: Normal Physiology of Insulin Secretion and Action". Diabetes In Control. A free weekly diabetes newsletter for Medical Professionals. (bằng tiếng Anh). ngày 28 tháng 7 năm 2014. Truy cập ngày 1 tháng 6 năm 2017.
- ^ McManus EJ, Sakamoto K, Armit LJ, Ronaldson L, Shpiro N, Marquez R, Alessi DR (tháng 4 năm 2005). "Role that phosphorylation of GSK3 plays in insulin and Wnt signalling defined by knockin analysis". The EMBO Journal. Quyển 24 số 8. tr. 1571–83. doi:10.1038/sj.emboj.7600633. PMC 1142569. PMID 15791206.
- ^ Fang X, Yu SX, Lu Y, Bast RC, Woodgett JR, Mills GB (tháng 10 năm 2000). "Phosphorylation and inactivation of glycogen synthase kinase 3 by protein kinase A". Proceedings of the National Academy of Sciences of the United States of America. Quyển 97 số 22. tr. 11960–75. Bibcode:2000PNAS...9711960F. doi:10.1073/pnas.220413597. PMC 17277. PMID 11035810.
- ^ a b Stryer L (1995). Biochemistry . New York: W.H. Freeman and Company. tr. 351–56, 494–95, 505, 605–06, 773–75. ISBN 0-7167-2009-4.
- ^ Menting JG, Whittaker J, Margetts MB, Whittaker LJ, Kong GK, Smith BJ, Watson CJ, Záková L, Kletvíková E, Jiráček J, Chan SJ, Steiner DF, Dodson GG, Brzozowski AM, Weiss MA, Ward CW, Lawrence MC (tháng 1 năm 2013). "How insulin engages its primary binding site on the insulin receptor". Nature. Quyển 493 số 7431. tr. 241–45. Bibcode:2013Natur.493..241M. doi:10.1038/nature11781. PMC 3793637. PMID 23302862. {{Chú thích tạp chí}}: Đã bỏ qua tham số không rõ |lay-source= (trợ giúp); Đã bỏ qua tham số không rõ |lay-url= (trợ giúp)
- ^ a b c d e f g Dimitriadis G, Mitrou P, Lambadiari V, Maratou E, Raptis SA (tháng 8 năm 2011). "Insulin effects in muscle and adipose tissue". Diabetes Research and Clinical Practice. Quyển 93 Suppl 1. tr. S52–59. doi:10.1016/S0168-8227(11)70014-6. PMID 21864752.
- ^ "Physiologic Effects of Insulin". www.vivo.colostate.edu (bằng tiếng Anh). Bản gốc lưu trữ ngày 7 tháng 5 năm 2023. Truy cập ngày 1 tháng 6 năm 2017.
- ^ Bergamini E, Cavallini G, Donati A, Gori Z (tháng 10 năm 2007). "The role of autophagy in aging: its essential part in the anti-aging mechanism of caloric restriction". Annals of the New York Academy of Sciences. Quyển 1114 số 1. tr. 69–78. Bibcode:2007NYASA1114...69B. doi:10.1196/annals.1396.020. PMID 17934054.
- ^ Zheng C, Liu Z (tháng 6 năm 2015). "Vascular function, insulin action, and exercise: an intricate interplay". Trends in Endocrinology and Metabolism. Quyển 26 số 6. tr. 297–304. doi:10.1016/j.tem.2015.02.002. PMC 4450131. PMID 25735473.
- ^ Kreitzman SN, Coxon AY, Szaz KF (tháng 7 năm 1992). "Glycogen storage: illusions of easy weight loss, excessive weight regain, and distortions in estimates of body composition" (PDF). The American Journal of Clinical Nutrition. Quyển 56 số 1 Suppl. tr. 292S – 93S. doi:10.1093/ajcn/56.1.292S. PMID 1615908. Bản gốc (PDF) lưu trữ ngày 18 tháng 10 năm 2012.
- ^ Benziane B, Chibalin AV (tháng 9 năm 2008). "Frontiers: skeletal muscle sodium pump regulation: a translocation paradigm". American Journal of Physiology. Endocrinology and Metabolism. Quyển 295 số 3. tr. E553–58. doi:10.1152/ajpendo.90261.2008. PMID 18430962.
- ^ Clausen T (tháng 9 năm 2008). "Regulatory role of translocation of Na+-K+ pumps in skeletal muscle: hypothesis or reality?". American Journal of Physiology. Endocrinology and Metabolism. Quyển 295 số 3. tr. E727–28, author reply 729. doi:10.1152/ajpendo.90494.2008. PMID 18775888.
- ^ Gupta AK, Clark RV, Kirchner KA (tháng 1 năm 1992). "Effects of insulin on renal sodium excretion". Hypertension. Quyển 19 số 1 Suppl. tr. I78–82. doi:10.1161/01.HYP.19.1_Suppl.I78. PMID 1730458.
- ^ Benedict C, Hallschmid M, Hatke A, Schultes B, Fehm HL, Born J, Kern W (tháng 11 năm 2004). "Intranasal insulin improves memory in humans" (PDF). Psychoneuroendocrinology. Quyển 29 số 10. tr. 1326–34. doi:10.1016/j.psyneuen.2004.04.003. PMID 15288712.
- ^ Benedict C, Brede S, Schiöth HB, Lehnert H, Schultes B, Born J, Hallschmid M (tháng 1 năm 2011). "Intranasal insulin enhances postprandial thermogenesis and lowers postprandial serum insulin levels in healthy men". Diabetes. Quyển 60 số 1. tr. 114–18. doi:10.2337/db10-0329. PMC 3012162. PMID 20876713[Epub'd ahead of print]{{Chú thích tạp chí}}: Quản lý CS1: postscript (liên kết)
- ^ Comninos AN, Jayasena CN, Dhillo WS (2014). "The relationship between gut and adipose hormones, and reproduction". Human Reproduction Update. Quyển 20 số 2. tr. 153–74. doi:10.1093/humupd/dmt033. PMID 24173881.
- ^ Duckworth WC, Bennett RG, Hamel FG (tháng 10 năm 1998). "Insulin degradation: progress and potential". Endocrine Reviews. Quyển 19 số 5. tr. 608–24. doi:10.1210/edrv.19.5.0349. PMID 9793760.
- ^ "Carbohydrate and insulin metabolism in chronic kidney disease". UpToDate, Inc.
- ^ D'Eon TM, Pierce KA, Roix JJ, Tyler A, Chen H, Teixeira SR (tháng 5 năm 2008). "The role of adipocyte insulin resistance in the pathogenesis of obesity-related elevations in endocannabinoids". Diabetes (bằng tiếng Anh). Quyển 57 số 5. tr. 1262–68. doi:10.2337/db07-1186. PMID 18276766.
- ^ Gatta-Cherifi B, Cota D (tháng 2 năm 2016). "New insights on the role of the endocannabinoid system in the regulation of energy balance". International Journal of Obesity. Quyển 40 số 2. tr. 210–19. doi:10.1038/ijo.2015.179. PMID 26374449.
- ^ Di Marzo V (tháng 8 năm 2008). "The endocannabinoid system in obesity and type 2 diabetes". Diabetologia. Quyển 51 số 8. tr. 1356–67. doi:10.1007/s00125-008-1048-2. PMID 18563385.
- ^ a b c d e f "Hypoglycemia". National Institute of Diabetes and Digestive and Kidney Diseases. tháng 10 năm 2008. Bản gốc lưu trữ ngày 1 tháng 7 năm 2015. Truy cập ngày 28 tháng 6 năm 2015.
- ^ Yanai H, Adachi H, Katsuyama H, Moriyama S, Hamasaki H, Sako A (tháng 2 năm 2015). "Causative anti-diabetic drugs and the underlying clinical factors for hypoglycemia in patients with diabetes". World Journal of Diabetes. Quyển 6 số 1. tr. 30–6. doi:10.4239/wjd.v6.i1.30. PMC 4317315. PMID 25685276.{{Chú thích tạp chí}}: Quản lý CS1: DOI truy cập mở nhưng không được đánh ký hiệu (liên kết)
- ^ a b Schrier RW (2007). The internal medicine casebook real patients, real answers (ấn bản thứ 3). Philadelphia: Lippincott Williams & Wilkins. tr. 119. ISBN 9780781765299. Bản gốc lưu trữ ngày 1 tháng 7 năm 2015.
- ^ Perkin RM (2008). Pediatric hospital medicine: textbook of inpatient management (ấn bản thứ 2). Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins. tr. 105. ISBN 9780781770323. Bản gốc lưu trữ ngày 1 tháng 7 năm 2015.
- ^ Macdonald IA (tháng 11 năm 2016). "A review of recent evidence relating to sugars, insulin resistance and diabetes". European Journal of Nutrition. Quyển 55 số Suppl 2. tr. 17–23. doi:10.1007/s00394-016-1340-8. PMC 5174139. PMID 27882410.
- ^ Guettier JM, Gorden P (tháng 3 năm 2010). "Insulin secretion and insulin-producing tumors". Expert Review of Endocrinology & Metabolism. Quyển 5 số 2. tr. 217–227. doi:10.1586/eem.09.83. PMC 2853964. PMID 20401170.
- ^ Saklayen MG (tháng 2 năm 2018). "The Global Epidemic of the Metabolic Syndrome". Current Hypertension Reports. Quyển 20 số 2. tr. 12. doi:10.1007/s11906-018-0812-z. PMC 5866840. PMID 29480368.
- ^ El Hayek S, Bitar L, Hamdar LH, Mirza FG, Daoud G (ngày 5 tháng 4 năm 2016). "Poly Cystic Ovarian Syndrome: An Updated Overview". Frontiers in Physiology. Quyển 7. tr. 124. doi:10.3389/fphys.2016.00124. PMC 4820451. PMID 27092084.{{Chú thích tạp chí}}: Quản lý CS1: DOI truy cập mở nhưng không được đánh ký hiệu (liên kết)
- ^ "From SemBiosys, A New Kind Of Insulin". Inside Wall Street. ngày 13 tháng 8 năm 2007. Bản gốc lưu trữ ngày 17 tháng 11 năm 2007.
- ^ Insulin analog
- ^ a b Vecchio, Ignazio; Tornali, Cristina; Bragazzi, Nicola Luigi; Martini, Mariano (ngày 23 tháng 10 năm 2018). "The Discovery of Insulin: An Important Milestone in the History of Medicine". Frontiers in Endocrinology. Quyển 9. tr. 613. doi:10.3389/fendo.2018.00613. PMC 6205949. PMID 30405529.{{Chú thích tạp chí}}: Quản lý CS1: DOI truy cập mở nhưng không được đánh ký hiệu (liên kết)
- ^ Gast, Klaus; Schüler, Anja; Wolff, Martin; Thalhammer, Anja; Berchtold, Harald; Nagel, Norbert; Lenherr, Gudrun; Hauck, Gerrit; Seckler, Robert (2017). "Rapid-Acting and Human Insulins: Hexamer Dissociation Kinetics upon Dilution of the Pharmaceutical Formulation". Pharmaceutical Research (bằng tiếng Anh). Quyển 34 số 11. tr. 2270–2286. doi:10.1007/s11095-017-2233-0. PMC 5643355. PMID 28762200.
- ^ Ulrich, Heather; Snyder, Benjamin; K Garg, Satish (2007). "Combining insulins for optimal blood glucose control in type 1 and 2 diabetes: Focus on insulin glulisine". Vascular Health and Risk Management. Quyển 3 số 3. tr. 245–254. PMC 2293970. PMID 17703632.
- ^ Silver, Bahendeka; Ramaiya, Kaushik; Andrew, Swai Babu; Fredrick, Otieno; Bajaj, Sarita; Kalra, Sanjay; Charlotte, Bavuma M.; Claudine, Karigire; Makhoba, Anthony (2018). "EADSG Guidelines: Insulin Therapy in Diabetes". Diabetes Therapy (bằng tiếng Anh). Quyển 9 số 2. tr. 449–492. doi:10.1007/s13300-018-0384-6. PMC 6104264. PMID 29508275.
- ^ "The Great Debate: Natural Animal or Artificial 'Human' Insulin?".
- ^ Wong CY, Martinez J, Dass CR (2016). "Oral delivery of insulin for treatment of diabetes: status quo, challenges and opportunities". The Journal of Pharmacy and Pharmacology. Quyển 68 số 9. tr. 1093–108. doi:10.1111/jphp.12607. PMID 27364922.
- ^ Shah RB, Patel M, Maahs DM, Shah VN (2016). "Insulin delivery methods: Past, present and future". International Journal of Pharmaceutical Investigation. Quyển 6 số 1. tr. 1–9. doi:10.4103/2230-973X.176456. PMC 4787057. PMID 27014614.{{Chú thích tạp chí}}: Quản lý CS1: DOI truy cập mở nhưng không được đánh ký hiệu (liên kết)
- ^ Sakula, A (tháng 7 năm 1988). "Paul Langerhans (1847–1888): a centenary tribute". Journal of the Royal Society of Medicine. Quyển 81 số 7. tr. 414–15. doi:10.1177/014107688808100718. PMC 1291675. PMID 3045317.
- ^ Petit, Henri. "Edouard Laguesse (1861–1927)". Museum of the Regional Hospital of Lille (bằng tiếng Pháp). Bản gốc lưu trữ ngày 3 tháng 3 năm 2016. Truy cập ngày 25 tháng 7 năm 2018.
- ^ Opie EL (1901). "Diabetes Mellitus Associated with Hyaline Degeneration of the islands of Langerhans of the Pancreas". Bulletin of the Johns Hopkins Hospital. Quyển 12 số 125. tr. 263–64.
- ^ Opie EL (1901). "On the Relation of Chronic Interstitial Pancreatitis to the Islands of Langerhans and to Diabetes Mellitus". Journal of Experimental Medicine. Quyển 5 số 4. tr. 397–428. doi:10.1084/jem.5.4.397. PMC 2118050. PMID 19866952.
- ^ Opie EL (1901). "The Relation of Diabetes Mellitus to Lesions of the Pancreas. Hyaline Degeneration of the Islands of Langerhans". Journal of Experimental Medicine. Quyển 5 số 5. tr. 527–40. doi:10.1084/jem.5.5.527. PMC 2118021. PMID 19866956.
- ^ The American Institute of Nutrition (1967). "Proceedings of the Thirty-first Annual Meeting of the American Institute of Nutrition". Journal of Nutrition. Quyển 92 số 4. tr. 509. doi:10.1093/jn/92.4.507.
- ^ Paulesco NC (ngày 31 tháng 8 năm 1921). "Recherche sur le rôle du pancréas dans l'assimilation nutritive". Archives Internationales de Physiologie. Quyển 17. tr. 85–109.
- ^ Lestradet H (1997). "Le 75e anniversaire de la découverte de l'insuline". Diabetes & Metabolism. Quyển 23 số 1. tr. 112.
- ^ de Leiva, Alberto; Brugués, Eulàlia; de Leiva-Pérez, Alejandra (2011). "The discovery of insulin: Continued controversies after ninety years". Endocrinología y Nutrición (English Edition) (bằng tiếng Anh). Quyển 58 số 9. tr. 449–456. doi:10.1016/j.endoen.2011.10.001.
- ^ Banting, Frederick G. (ngày 31 tháng 10 năm 1920). "Note dated Oct 31/20 from loose leaf notebook 1920/21". University of Toronto Libraries.
- ^ a b c Rosenfeld L (tháng 12 năm 2002). "Insulin: discovery and controversy". Clinical Chemistry. Quyển 48 số 12. tr. 2270–88. doi:10.1093/clinchem/48.12.2270. PMID 12446492.
- ^ Wright JR (tháng 12 năm 2002). "Almost famous: E. Clark Noble, the common thread in the discovery of insulin and vinblastine". CMAJ. Quyển 167 số 12. tr. 1391–96. PMC 137361. PMID 12473641.
- ^ Krishnamurthy K (2002). Pioneers in scientific discoveries. Mittal Publications. tr. 266. ISBN 978-81-7099-844-0. Truy cập ngày 26 tháng 7 năm 2011.
- ^ Bliss M (tháng 7 năm 1993). "Rewriting medical history: Charles Best and the Banting and Best myth" (PDF). Journal of the History of Medicine and Allied Sciences. Quyển 48 số 3. tr. 253–74. doi:10.1093/jhmas/48.3.253. PMID 8409364. Bản gốc (PDF) lưu trữ ngày 3 tháng 11 năm 2019.
- ^ Toronto star weekly (ngày 14 tháng 1 năm 1922). "Work on diabetes shows progress against disease". University of Toronto Libraries.
- ^ Fletcher, A. A. (ngày 17 tháng 11 năm 1962). "Early clinical experiences with insulin". Canadian Medical Association Journal. Quyển 87. tr. 1052–5. PMC 1849803. PMID 13945508.
- ^ Banting, Frederick G. (Dec 1921 – Jan 1922). "Patient records for Leonard Thompson". University of Toronto Libraries.{{Chú thích web}}: Quản lý CS1: định dạng ngày tháng (liên kết)
- ^ Zuger A (ngày 4 tháng 10 năm 2010). "Rediscovering the First Miracle Drug". The New York Times. Truy cập ngày 6 tháng 10 năm 2010. Elizabeth Hughes was a cheerful, pretty little girl, five feet tall, with straight brown hair and a consuming interest in birds. On Dr. Allen's diet her weight fell to 65 pounds, then 52 pounds, and then, after an episode of diarrhea that almost killed her in the spring of 1922, 45 pounds. By then she had survived three years, far longer than expected. And then her mother heard the news: Insulin had finally been isolated in Canada.
- ^ Banting, Frederick G. (ngày 16 tháng 8 năm 1922). "Chart for Elizabeth Hughes". University of Toronto Libraries.
- ^ Woodbury, David Oakes (tháng 2 năm 1963). "Please save my son!". University of Toronto Libraries.
- ^ Marcotte B (ngày 22 tháng 11 năm 2010). "Rochester's John Williams a man of scientific talents". Democrat and Chronicle. Rochester, New York. Gannett Company. tr. 1B, 4B. Bản gốc lưu trữ ngày 23 tháng 11 năm 2010. Truy cập ngày 22 tháng 11 năm 2010.
- ^ University of Toronto Board of Governors Insulin Committee (ngày 25 tháng 1 năm 1922). "Memorandum in reference to the co-operation of the Connaught Antitoxin Laboratories in the researches conducted by Dr. Banting, Mr. Best and Dr. Collip under the general direction of Professor J.J.R. Macleod to obtain an extract of pancreas having a specific effect on blood sugar concentration". University of Toronto Libraries.
- ^ Bliss M (2007). The discovery of insulin (ấn bản thứ 25). Chicago: University of Chicago Press. tr. 132. ISBN 9780226058993. OCLC 74987867. The Lilly company would be delighted to work with Toronto, Clowes wrote, and hinted, perhaps intentionally, perhaps not, that Toronto could be bypassed: "I have thus far refrained from starting work in our laboratories on the field of this question as I was anxious to avoid in any way intruding on the field of yourself and your associates until you had published your results. I feel, however, that the matter is now one of such immediate importance that we should take up the experimental end of the question without delay, preferably cooperating with you and your associates..."
- ^ Kendall, Edward Calvin (ngày 10 tháng 4 năm 1922). "Letter to Dr. J. J. R. Macleod 10/04/1922". University of Toronto Libraries: Discovery and Early Development of Insulin.
- ^ Macleod, J.J.R. (ngày 28 tháng 4 năm 1924). "Statement read by J. J. R. Macleod at the Insulin Committee meeting regarding patents and royalties 28/04/1924". University of Toronto Libraries: The Discovery and Early Development of Insulin.
- ^ Bliss M (2007). The discovery of insulin (ấn bản thứ 25). Chicago: University of Chicago Press. tr. 131–133. ISBN 9780226058993. OCLC 74987867.
- ^ "Assignment to the Governors of the University of Toronto". University of Toronto Libraries: Discovery and Early Development of Insulin. ngày 15 tháng 1 năm 1923.
- ^ "Copy of the article: A step forward in medical ethics". University of Toronto Libraries: The Discovery and Early Development of Insulin. The World's Work. tháng 2 năm 1923.
- ^ Bliss M (2007). The discovery of insulin (ấn bản thứ 25). Chicago: University of Chicago Press. tr. 181. ISBN 9780226058993. OCLC 74987867.
- ^ Abel JJ (tháng 2 năm 1926). "Crystalline Insulin". Proceedings of the National Academy of Sciences of the United States of America. Quyển 12 số 2. tr. 132–6. Bibcode:1926PNAS...12..132A. doi:10.1073/pnas.12.2.132. PMC 1084434. PMID 16587069.
- ^ Somogyi M, Doisy EA, Shaffer PA (tháng 5 năm 1924). "On the Preparation of Insulin" (PDF). Journal of Biological Chemistry. Quyển 60 số 1. tr. 31–58.
- ^ Jensen H, Evans EA (ngày 1 tháng 1 năm 1935). "Studies on Crystalline Insulin Xviii. the Nature of the Free Amino Groups in Insulin and the Isolation of Phenylalanine and Proline from Crystalline Insulin" (PDF). Journal of Biological Chemistry. Quyển 108 số 1. tr. 1–9.
- ^ Sanger F, Tuppy H (tháng 9 năm 1951). "The amino-acid sequence in the phenylalanyl chain of insulin. I. The identification of lower peptides from partial hydrolysates". The Biochemical Journal. Quyển 49 số 4. tr. 463–81. doi:10.1042/bj0490463. PMC 1197535. PMID 14886310.; Sanger F, Tuppy H (tháng 9 năm 1951). "The amino-acid sequence in the phenylalanyl chain of insulin. 2. The investigation of peptides from enzymic hydrolysates". The Biochemical Journal. Quyển 49 số 4. tr. 481–90. doi:10.1042/bj0490481. PMC 1197536. PMID 14886311.; Sanger F, Thompson EO (tháng 2 năm 1953). "The amino-acid sequence in the glycyl chain of insulin. I. The identification of lower peptides from partial hydrolysates". The Biochemical Journal. Quyển 53 số 3. tr. 353–66. doi:10.1042/bj0530353. PMC 1198157. PMID 13032078.; Sanger F, Thompson EO (tháng 2 năm 1953). "The amino-acid sequence in the glycyl chain of insulin. II. The investigation of peptides from enzymic hydrolysates". The Biochemical Journal. Quyển 53 số 3. tr. 366–74. doi:10.1042/bj0530366. PMC 1198158. PMID 13032079.
- ^ Katsoyannis PG, Fukuda K, Tometsko A, Suzuki K, Tilak M (1964). "Insulin Peptides. X. The Synthesis of the B-Chain of Insulin and Its Combination with Natural or Synthetis A-Chin to Generate Insulin Activity". Journal of the American Chemical Society. Quyển 86 số 5. tr. 930–32. doi:10.1021/ja01059a043.
- ^ Kung YT, Du YC, Huang WT, Chen CC, Ke LT (tháng 11 năm 1965). "Total synthesis of crystalline bovine insulin". Scientia Sinica. Quyển 14 số 11. tr. 1710–6. PMID 5881570.

- ^ Marglin A, Merrifield RB (tháng 11 năm 1966). "The synthesis of bovine insulin by the solid phase method". Journal of the American Chemical Society. Quyển 88 số 21. tr. 5051–2. doi:10.1021/ja00973a068. PMID 5978833.
- ^ Costin GE (tháng 1 năm 2004). "What is the advantage of having melanin in parts of the central nervous system (e.g. substantia nigra)?". IUBMB Life. Quyển 56 số 1. Time Inc. tr. 47–9. doi:10.1080/15216540310001659029. PMID 14992380.
- ^ Wollmer A, Dieken ML, Federwisch M, De Meyts P (2002). Insulin & related proteins structure to function and pharmacology. Boston: Kluwer Academic Publishers. ISBN 978-1-4020-0655-5.
- ^ Tsou, Chen-lu (2015). 对人工合成结晶牛胰岛素的回忆 [Memory on the research of synthesizing bovine insulin]. 生命科学 [Chinese Bulletin of Life Science] (bằng tiếng Trung). Quyển 27 số 6. tr. 777–79.
- ^ a b Blundell TL, Cutfield JF, Cutfield SM, Dodson EJ, Dodson GG, Hodgkin DC, và đồng nghiệp (tháng 6 năm 1971). "Atomic positions in rhombohedral 2-zinc insulin crystals". Nature. Quyển 231 số 5304. tr. 506–11. Bibcode:1971Natur.231..506B. doi:10.1038/231506a0. PMID 4932997.
- ^ Aggarwal SR (tháng 12 năm 2012). "What's fueling the biotech engine-2011 to 2012". Nature Biotechnology. Quyển 30 số 12. tr. 1191–7. doi:10.1038/nbt.2437. PMID 23222785.
- ^ "Safflowers may provide new insulin source | CTV News". www.ctvnews.ca. tháng 2 năm 2010. Bản gốc lưu trữ ngày 12 tháng 11 năm 2019. Truy cập ngày 12 tháng 11 năm 2019.
- ^ Kjeldsen T (tháng 9 năm 2000). "Yeast secretory expression of insulin precursors" (PDF). Applied Microbiology and Biotechnology. Quyển 54 số 3. tr. 277–86. doi:10.1007/s002530000402. PMID 11030562. Bản gốc (PDF) lưu trữ ngày 27 tháng 9 năm 2017.
- ^ "The Nobel Prize in Physiology or Medicine 1923". The Nobel Foundation.
- ^ Felman, Adam (ngày 22 tháng 11 năm 2018). "Who discovered insulin?". Medical News Today.
- ^ Castle WB (1962). "The Gordon Wilson Lecture. A Century of Curiosity About Pernicious Anemia". Transactions of the American Clinical and Climatological Association. Quyển 73. tr. 54–80. PMC 2249021. PMID 21408623.
- ^ Banting FG, Best CH, Collip JB, Campbell WR, Fletcher AA (tháng 3 năm 1922). "Pancreatic Extracts in the Treatment of Diabetes Mellitus". Canadian Medical Association Journal. Quyển 12 số 3. tr. 141–46. PMC 1524425. PMID 20314060.
- ^ Drury MI (tháng 7 năm 1972). "The golden jubile of insulin". Journal of the Irish Medical Association. Quyển 65 số 14. tr. 355–63. PMID 4560502.
- ^ Murray I (tháng 4 năm 1971). "Paulesco and the isolation of insulin". Journal of the History of Medicine and Allied Sciences. Quyển 26 số 2. tr. 150–57. doi:10.1093/jhmas/XXVI.2.150. PMID 4930788.
Liên kết ngoài
[sửa | sửa mã nguồn]
| |||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Tuyến nội tiết |
| ||||||||||||||||||||||||||
| Các loại khác |
| ||||||||||||||||||||||||||
| Cơ sở dữ liệu tiêu đề chuẩn | |
|---|---|
| Quốc tế |
|
| Quốc gia |
|
| Khác |
|
Từ khóa » Trình Bày Quy Trình Tạo Insulin Bằng Công Nghệ Gen
-
Insulin Và Công Nghệ Sản Xuất Insulin Bằng DNA Tái Tổ Hợp
-
Quy Trình Công Nghệ Sản Xuất Insulin - Tài Liệu Text - 123doc
-
Tìm Hiểu Quy Trình Sử Dụng Công Nghệ ADN Tái Tổ Hợp để Sản Xuất ...
-
Người Ta đã Sản Xuất được Insulin Bằng Công Nghệ Gen Và Sử Dụng ...
-
Trình Bày Quy Trình Tạo Insulin Bằng Công Nghệ Gen
-
Insulin Công Nghệ Gen Chữa đái Tháo đường - Tuổi Trẻ Online
-
Trình Bày Các Bước Tiến Hành để Tạo Ra Chủng Vi Khuẩn E. Coli
-
Insulin Là Gì? Vai Trò, Tác Dụng Phụ, Lưu ý Khi Sử Dụng Theo Hướng ...
-
[PDF] NGHIÊN CỨU BIỂU HIỆN INSULIN NGƯỜI Ở E. Coli - CORE
-
Insulin Và Công Nghệ Sản Xuất Insulin Trên Thế Giới
-
Đái Tháo đường (DM) - Rối Loạn Nội Tiết Và Chuyển Hóa - MSD Manuals
-
Điều Trị đái Tháo đường - Phiên Bản Dành Cho Chuyên Gia
-
Sản Xuất Insulin Tái Tổ Hợp - Luận Văn, đồ án, đề Tài Tốt Nghiệp