Lý Thuyết, Cách Viết Cấu Hình Electron Nguyên Tử Và Bài Tập Vận ...
Có thể bạn quan tâm
Trong chương trình Hóa học lớp 10, các em sẽ học về cấu hình electron nguyên tử, cách viết cấu hình electron cũng như những đặc điểm của lớp electron ngoài cùng. Team Marathon Education sẽ giúp các em ghi nhớ những kiến thức này thông qua bài viết dưới đây.
>>> Xem thêm: Lý Thuyết Và Cách Học Thuộc Nhanh Bảng Tuần Hoàn Hóa Học Lớp 10
Thứ tự của các mức năng lượng trong một nguyên tử
Ở trạng thái cơ bản, các electron (e) nguyên tử lần lượt chiếm mức năng lượng từ thấp đến cao. Đồng thời, theo chiều từ trong ra ngoài thì mức năng lượng của các lớp tăng theo thứ tự từ 1 đến 7 và năng lượng của phân lớp tăng theo thứ tự là s, p, d, f.
Cụ thể, thứ tự sắp xếp các phân lớp theo chiều tăng của năng lượng được xác định như sau: 1s 2s 3s 3p 4s 3d 4p 5s… Khi điện tích hạt nhân tăng xảy ra hiện tượng chèn mức năng lượng nên mức năng lượng 4s thấp hơn 3d.
>>> Xem thêm: Cấu Tạo Vỏ Nguyên Tử – Lý Thuyết Hóa 10 Và Bài Tập Vận Dụng
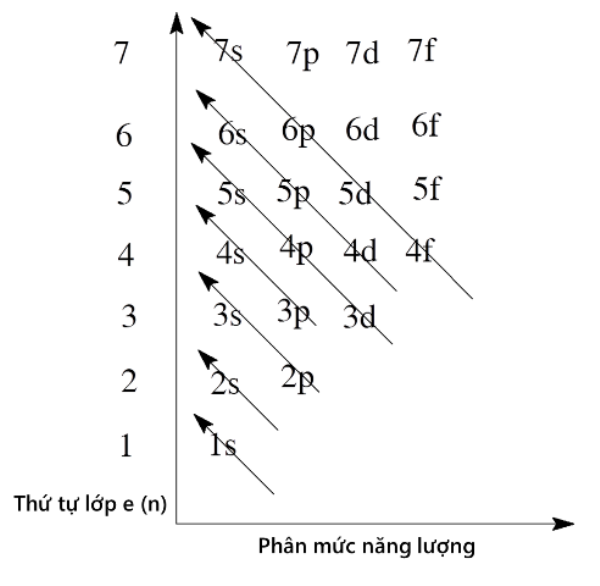
Cấu hình electron nguyên tử
Cấu hình electron nguyên tử biểu diễn sự phân bố electron trên các phân lớp thuộc các lớp khác nhau.
Cách viết cấu hình electron nguyên tử được quy ước như sau:
- Số thứ tự lớp electron được ghi bằng các chữ số 1, 2, 3,…
- Phân lớp được biểu diễn bằng các chữ cái thường như s, p, d, f
- Số electron trong một phân lớp được ghi bằng số phía trên bên phải của phân lớp ấy như s2, p6…
Ví dụ:
- Heli có cấu hình electron là 1s2.
- Kali có cấu hình electron là 1s2 2s2 2p6 3s2 3p6 4s1.
>>> Xem thêm: Lý Thuyết Hóa 10: Thành Phần Nguyên Tử, Kích Thước Và Khối Lượng
Cách viết cấu hình electron nguyên tử
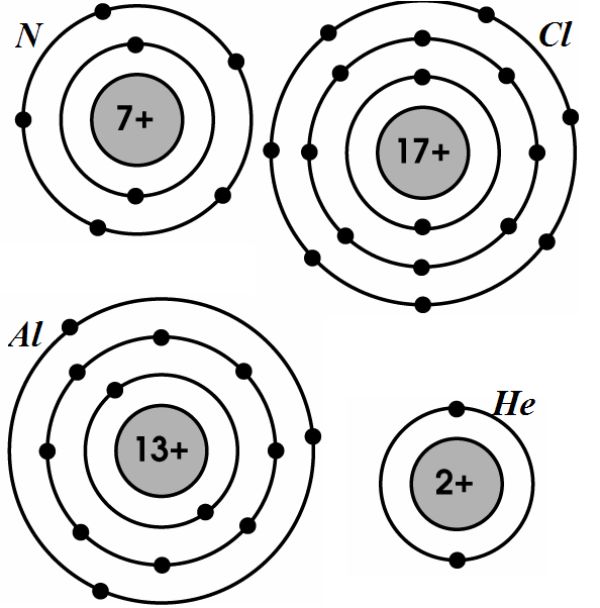
Các nguyên lý và quy tắc cần nhớ
Nguyên lý Pauli: Mỗi Obitan nguyên tử chỉ chứa tối đa hai electron.
Quy tắc Hund: Trong cùng một phân lớp, các electron được phân bố sao cho số electron độc thân là tối đa trên các obitan.
Nguyên lý vững bền: Ở trạng thái cơ bản, các electron sẽ phân bố lần lượt vào các obital có mức năng lượng từ thấp đến cao.
>>> Xem thêm: Hạt Nhân Nguyên Tử Là Gì? Cấu Tạo Của Hạt Nhân Nguyên Tử
Các bước viết cấu hình electron nguyên tử
Các em có thể viết cấu hình electron nguyên tử theo các bước như sau:
- Bước 1: Xác định đúng số electron của nguyên tử.
- Bước 2: Các electron được phân bố lần lượt vào các phân lớp theo chiều tăng của năng lượng trong nguyên tử như: 1s 2s 2p 3s 3p 4s 3d 4p,… và tuân thủ theo quy tắc sau:
- Phân lớp s chứa tối đa 2e.
- phân lớp p chứa tối đa 6e.
- Phân lớp d chứa tối đa 10e.
- Phân lớp f chứa tối đa 14e.
- Bước 3: Viết cấu hình electron bằng cách phân bố electron trên các phân lớp thuộc các lớp khác nhau như: 1s 2s 2p 3s 3p 4s 3d 4p,…
Lưu ý khi viết cấu hình e:
- Sắp xếp cấu hình electron theo thứ tự từng lớp (1 → 7), trong mỗi lớp theo thứ tự từng phân lớp (s → p → d → f).
- Cần xác định chính xác số electron nguyên tử hay ion (số e (electron) = số p (proton) = Z (số đơn vị điện tích hạt nhân)).
- Nắm vững các quy tắc và nguyên lý, kí hiệu của lớp và phân lớp.
- Nắm vững quy tắc bán bão hòa hay bão hòa trên phân lớp d và f.
Ví dụ: Viết cấu hình electron nguyên tử của các nguyên tố hóa học sau:
- Nguyên tử Hidro có 1e và Z = 1 ⇒ He: 1s1
- Nguyên tử Liti có 3e và Z = 3 ⇒ Li: 1s22s1
- Nguyên tử Neon có 10e và Z = 10 ⇒ Ne: 1s22s22p6
- Nguyên tử Clo có 17e và Z = 17 ⇒ Cl: 1s22s22p63s23p5. Cấu hình electron viết gọn của Clo là [Ne]3s23p5 với electron cuối cùng của Clo điền vào phân lớp p và [Ne] là ký hiệu cấu hình e của nguyên tử Neon.
- Nguyên tử sắt Fe có 26e và Z = 26 ⇒ Fe: 1s22s22p63s23p64s23d6. Cấu hình electron viết gọn của Fe có thể viết: [Ar]3d64s2 và electron cuối cùng của Fe điền vào phân lớp d.
Cách xác định nguyên tố s, p, d, f
- Nguyên tố s: có electron cuối cùng được viết vào phân lớp s
- Nguyên tố p: có electron cuối cùng được viết vào phân lớp p
- Nguyên tố d: có electron cuối cùng được viết vào phân lớp d
- Nguyên tố f: có electron cuối cùng được viết vào phân lớp f
* Lưu ý một số trường hợp đặc biệt: Các nguyên tố có cấu hình nguyên tử bán bão hòa:
- Cr (có Z = 24) 1s22s22p63s23p63d44s2 chuyển thành 1s22s22p63s23p63d54s1.
- Cu (có Z = 29) 1s22s22p63s23p63d94s2 chuyển thành 1s22s22p63s23p63d104s1.

Bảng cấu hình electron nguyên tử của 20 nguyên tố hóa học thường gặp
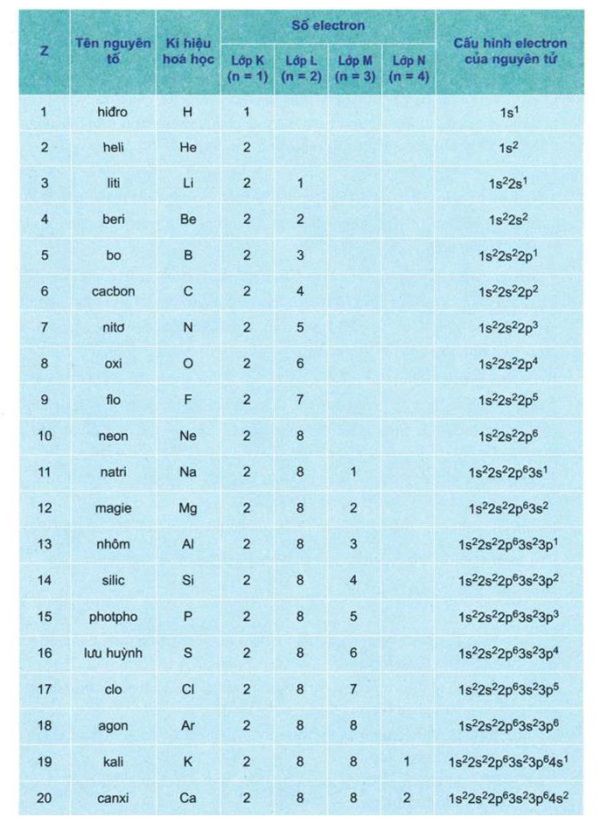
Đặc biệt, các em có thể viết cấu hình electron nguyên tử theo lớp
Ví dụ: Na có cấu hình là 1s22s22p63s1 hay được viết theo lớp là 2, 8, 1.
Axit Là Gì? Lý Thuyết Về Tính Chất Hóa Học Của Axit>>> Xem thêm: Nguyên Tố Hóa Học Là Gì? Lý Thuyết Về Nguyên Tố Hóa Học
Đặc điểm cấu tạo của lớp electron ngoài cùng
Đối với hầu hết các nguyên tố thì lớp e ngoài cùng có nhiều nhất là 8e.
Trong trường hợp các nguyên tử có 8 electron lớp ngoài cùng thì cấu hình electron của các nguyên tử này rất bền. Đây thường là các nguyên tố khí hiếm. Các nguyên tố khí hiếm tồn tại ở dạng nguyên tử trong tự nhiên.
Các nguyên tử có 1, 2, 3 e lớp ngoài cùng dễ “NHƯỜNG” e là nguyên tử của các nguyên tố kim loại (trừ He, H, B).
Các nguyên tử có 5, 6, 7 e lớp ngoài cùng dễ “NHẬN” e, thông thường đều là những nguyên tử của nguyên tố phi kim.
Các nguyên tử có 4 e lớp ngoài cùng có thể là nguyên tử của nguyên tố phi kim hay kim loại.
Do vậy, lớp electron ngoài cùng quyết định tính chất hóa học của một nguyên tố. Khi biết cấu hình electron nguyên tử cũng có thể dự đoán được loại nguyên tố.
Bài tập về cấu hình electron nguyên tử
Bài 1 Trang 27 SGK Hóa 10
Nguyên tử có Z = 11 thuộc loại nguyên tố:
A. s
B. p
C. d
D. f
Hướng dẫn:
Với Z = 11, nguyên tử sẽ có cấu hình e là 1s22s22p63s1.
Dựa trên cấu hình e, e cuối cùng rơi vào phân lớp s nên nguyên tử thuộc nguyên tố s. Vậy ta chọn đáp án A.
Bài 2 Trang 27 SGK Hóa 10
Cấu hình electron nguyên tử nào sau đây của lưu huỳnh (Z = 16):
A. 1s22s22p53s23p5
B. 1s22s22p63s23p6
C. 1s22s22p63s23p4
D. 1s22s22p63s23p3
Hướng dẫn:
Ta xét số electron và cách viết cấu hình e lần lượt của từng phương án:
A. Số e = 2 + 2 + 5 + 2 + 5 = 16 nhưng viết sai cấu hình e (phân lớp p chứa tối đa 6e)
B. Số e = 2 + 2 + 6 + 2 + 6 = 18
C. Số e = 2 + 2 + 5 + 2 + 5 = 16
D. Số e = 2 + 2 + 6 + 2 + 3 = 15
Vậy ta chọn đáp án C.
Bài 3 Trang 27 SGK Hóa 10
Cấu hình electron của nguyên tử nhôm (Z = 13) là 1s22s22p63s23p1. Tìm câu trả lời sai.
A. Lớp thứ nhất (Lớp K) có 2 electron.
B. Lớp thứ hai (Lớp L) có 8 electron.
C. Lớp thứ ba (Lớp M) có 3 electron.
D. Lớp ngoài cùng có 1 electron.
Hướng dẫn:
D là đáp án sai vì lớp ngoài cùng của nguyên tử nhôm có 2 + 1 = 3e (ở phân lớp s và phân lớp p).
Bài 4 Trang 27 SGK Hóa 10
\begin{aligned} & \small \text{Tổng số hạt proton, notron và electron trong nguyên tử của một nguyên tố là 13.} \\ & \small \text{a. Xác định nguyên tử khối. Biết rằng với các nguyên tố có số hiệu nguyên tử từ 2 đến 82 trong} \\ & \small \text{bảng tuần hoàn thì } 1 \le \frac{N}{Z} \le 1,5 \\ & \small \text{b. Viết cấu hình electron nguyên tử của nguyên tố đó.} \end{aligned}Hướng dẫn:
\begin{aligned} & \small \text{a. Theo đề bài ta có:} \\ & \small \bull P + E + N = 13 \iff 2Z + N = 13 \iff N = 13 - 2Z \\ & \small \bull 1 \le \frac{N}{Z} \le 1,5 \\ & \small \iff Z \le N \le 1,5Z \\ & \small \iff Z \le 13 - 2Z \le 1,5Z \\ & \small \iff 3,7 \le Z \le 4,3 \\ & \small \implies Z = 4 \text{ (vì Z là số nguyên dương) } \\ & \small \implies N = 13 - 8 = 5 \\ & \small \implies A = Z + N = 4 + 5 = 9 \\ & \small \text{b. Với Z = 4, nguyên tử có cấu hình e là } 1s^22s^2. \end{aligned}Bài 5 Trang 27 SGK Hóa 10
Có bao nhiêu electron ở lớp ngoài cùng trong nguyên tử của các nguyên tố có số hiệu nguyên tử lần lượt bằng 3, 6, 9, 18?
Phi kim là gì? Tính chất hóa học của phi kim - Marathon EducationHướng dẫn:
Dựa vào số hiệu nguyên tử, ta có thể viết được cấu hình e, từ đó xác định số e ở lớp ngoài cùng.
Z = 3: 1s22s1 → có 1e ở lớp ngoài cùng
Z = 6: 1s22s22p2 → có 4e ở lớp ngoài cùng
Z = 9: 1s22s22p5 → có 7e ở lớp ngoài cùng
Z = 18: 1s22s22p63s23p6 → có 8e ở lớp ngoài cùng
Gia sư Online Học Online Toán 12 Học Online Hóa 10 Học Online Toán 11 Học Online Toán 6 Học Online Toán 10 Học Online Toán 7 Học Online Lý 10 Học Online Lý 9 Học Online Toán 8 Học Online Toán 9 Học Tiếng Anh 6 Học Tiếng Anh 7Tham khảo ngay các khoá học online của Marathon Education
Với những kiến thức về cấu hình electron nguyên tử và bài tập vận dụng mà Team Marathon Education đã chia sẻ, hy vọng các em sẽ nắm vững được những lý thuyết này và giải được các dạng bài tập cấu hình electron nguyên tử trên lớp. Các em hãy theo dõi website của Marathon để học trực tuyến nhiều kiến thức Toán – Lý – Hóa – Văn bổ ích khác chúc các em học sinh luôn học tập vui vẻ và thành công!
Từ khóa » Cấu Tạo Các Lớp Electron
-
Lý Thuyết Và Bài Tập Cấu Tạo Vỏ Nguyên Tử - Lớp Và Phân Lớp Electron
-
Cấu Tạo Vỏ Electron Của Nguyên Tử - Thầy Dũng Hóa
-
Cấu Hình Electron – Wikipedia Tiếng Việt
-
Cấu Tạo Vỏ Nguyên Tử, Phân Lớp Electron Và Bài Tập - Hóa 10 Bài 4
-
Lý Thuyết Cấu Tạo Vỏ Nguyên Tử Hóa 10 Và Bài Tập Vận Dụng
-
I. Sự Chuyển động Của Các Electron Trong Nguyên Tử - SureTEST
-
Cấu Tạo Vỏ Nguyên Tử - Lý Thuyết Và Các Dạng Bài Tập Thường Gặp
-
Nguyên Tử Là Gì? Lớp Electron Là Gì? Cấu Tạo Hạt Nhân Nguyên Tử
-
CẤU TẠO CỦA VỎ ELECTRON NGUYÊN TỬ
-
Lí Thuyết Cấu Tạo Vỏ Electron Nguyên Tử - MÔN HÓA Lớp 10
-
Toàn Bộ Lý Thuyết Và Cách Viết Cấu Hình Electron Nguyên Tử Dễ Nhớ
-
Lý Thuyết Cấu Tạo Vỏ Nguyên Tử | SGK Hóa Lớp 10
-
Lớp Electron, Phân Lớp Electron, Số Electron Tối đa Trong Lớp N: Cấu ...