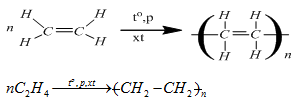Lý Thuyết Etilen | SGK Hóa Lớp 9
Có thể bạn quan tâm
I. TÍNH CHẤT VẬT LÍ
- Là chất khí, không màu, không mùi.
- Tan rất ít trong nước.
\({{M}_{{{C}_{2}}{{H}_{4}}}}=28\approx {{M}_{kk}}\)
II. CẤU TẠO PHÂN TỬ
- Etilen có công thức cấu tạo:
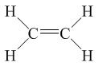 Viết gọn là : CH2=CH2
Viết gọn là : CH2=CH2
- Trong phân tử etilen C2H4, có một liên kết đôi giữa hai nguyên tử cacbon.
Chú ý: Trong liên kết đôi có một liên kết kém bền. Liên kêt này dễ đứt ra trong các phản ứng hóa học.
III. TÍNH CHẤT HÓA HỌC
1. Tác dụng với oxi:
Khi đốt trong oxi, etilen cháy tạo thành khí CO2 và H2O, tỏa nhiều nhiệt.
PTHH:
C2H4 + 3O2 \(\xrightarrow{{{t^o}}}\) 2CO2 + 2H2O
Nhận xét: Khi đốt cháy khí etilen thu được số mol CO2 bằng số mol H2O.
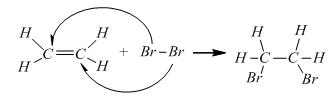
2. Tác dụng với dung dịch brom (phản ứng cộng).
PTHH:
CH2= CH2 + Br2 → Br – CH2 – CH2 – Br
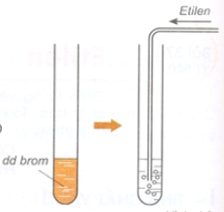
+ Dung dịch Br2 ban đầu có màu vàng nâu. Sục khí etilen vào dung dịch => dung dịch mất màu
Nhận xét:
– Liên kết kém bền trong liên kết đôi bị đứt ra và mỗi phân tử etilen đã kết hợp thêm một phân tử brom.
– Phản ứng trên gọi là phản ứng cộng. Ngoài brom, trong những điều kiện thích hợp etilen có thể tham gia phản ứng cộng với Cl2, H2, HBr…
– Các chất có liên kết đôi như etilen dễ tham gia phản ứng cộng.
3. Các phân tử etilen kết hợp với nhau (phản ứng trùng hợp)
- Ở điều kiện thích hợp các phân tử etilen kết hợp với nhau tạo ra chất có phân tử lượng rất lớn gọi là polime.
PTHH:
Chú ý:
- Phản ứng trên là phản ứng trùng hợp.
- Poli etilen là chất không tan trong nước, không độc, là nguồn nguyên liệu quan trọng trong công nghiệp chất dẻo.
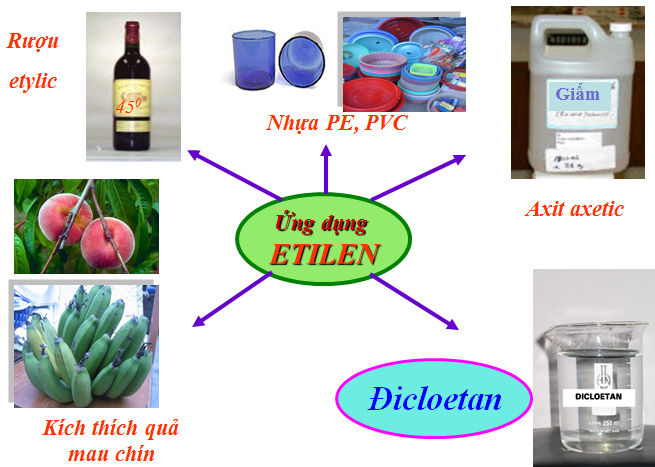
IV. ỨNG DỤNG
- Etilen dùng để điều chế axit axetic, rượu etylic, poli (vinyl clorua),...
- Etilen dùng kích thích quả mau chín.
V. ĐIỀU CHẾ
C2H5OH $\xrightarrow{{{t}^{o}}}$ CH2=CH2 + H2O
Sơ đồ tư duy: Etilen

Từ khóa » Sơ đồ Tư Duy Bài Etilen
-
E Ti Len Co So Do Tu Duy - Tài Liệu Text - 123doc
-
Etilen - Sơ đồ Tư Duy Hóa Học - Website Của Trương Thế Thảo
-
Vẽ Sơ đồ Tư Duy Bài Etilen. - Hoc24
-
Hoá Học 9 Bài 37: Etilen
-
Sơ đồ Tư Duy Hidrocacbon Dễ Hiểu, Cực Hay - TopLoigiai
-
Lý Thuyết Hóa 9: Bài 37. Etilen - TopLoigiai
-
Lý Thuyết & Bài Soạn Bài 37: Etilen - Chương 4 - Hóa Học Lớp 9
-
Giáo án Hóa Học 9 Bài 37 Etilen Mới Nhất
-
Giải Bài Tập SGK Bài 42: Luyện Tập Chương 4 Hiđrocacbon. Nhiên ...
-
SƠ ĐỒ TƯ DUY PHẦN KIẾN THỨC HÓA HỮU CƠ LỚP 9 - Yumpu
-
Sơ Đồ Tư Duy Về Ancol
-
Giải Hóa Học 9 Bài 37: Etilen
-
Bài Giảng c .pdf Tải Xuống Miễn Phí! - Tìm Văn Bản